Подгруппа брома
4. Подгруппа брома.Содержание в земной коре брома составляет 3·10-5 %, а иода 4 ·10-6 %. По характеру распределения в природе оба элемента очень похожи на хлор, но образование вторичных скоплений для них не характерно. Содержание в природе астата ничтожно мало и свойства этого элемента почти не изучены.
Природный бром состоит из смеси изотопов 79Вr (50,5 %) и 81Br (49,5 %), тогда как иод является “чистым” элементом — состоит из атомов 127I. Для астата известны только радиоактивные изотопы с небольшой продолжительностью жизни атомов (в среднем 12 ч для наиболее долгоживущего 210At).
Основными источниками промышленного получения брома являются воды некоторых соляных озер (0,01-0,5 % Вr) и морская вода (в среднем 0,007 % Вr). Частично он добывается также из бромистых соединений, примеси которых обычно содержатся в природных месторождениях калийных солей, и из буровых вод нефтеносных районов (0,01-0,1 % Br).
Для промышленной добычи иода основное значение имеют именно буровые воды, содержащие в среднем 0,003%. Другим источником этого элемента является зола морских водорослей.
Для получения свободных брома и иода можно воспользоваться вытеснением их хлором. Бром выделяется из раствора исходной соли в виде тяжелой жидкости, иод — в твердом состоянии.
Иод был открыт в 1811 г., бром — в 1826 г. Существование астата предсказывалось уже Д. И. Менделеевым. Элемент этот был получен искусственно в 1940 г. Происхождение брома и иода земной поверхности такое же как хлора и фтора — основные массы обоих элементов выделялись из горячих недр Земли в форме своих водородных соединений.
При получении брома из морской (или озёрной) воды её подкисляют серной кислотой до рН = 3,5 и обрабатывают хлором. Выделяющийся бром перегоняют током воздуха в раствор соды, который после достаточного насыщения бромом подкисляют. Реакции протекают по уравнениям:
2 NаВr + Сl2 = 2 NаСl + Вr2, затем
3 Вr2 + 3 Nа2СО3 = 5 NаВr + NаВrО3 + 3 СО2 и, наконец,
5 NаВr + NаВrO3 + 3 Н2SO4 = 3 Na2SO4 + 3 Вr2 + 3 Н2О.
Технический бром часто содержит примесь хлора. Для очистки его обрабатывают концентрированным раствором СаВr2, причем хлор вытесняет бром, который при разбавлении раствора выделяется в виде тяжелого слоя, содержащего лишь очень немного (порядка 0,05 %) растворенной воды.
В безводном состоянии бром может быть получен отгонкой из смеси с концентрированной Н2SO4. Тройной точке на его диаграмме состояния отвечает температура -7,3 °С и давление 46 мм рт. ст. Жидкий бром имеет весьма низкое значение диэлектрической проницаемости (ε = 3). Охлаждение его насыщенного водного раствора ведет к образованию кристаллогидрата Вr2·8Н2О (т. пл. 6 °С). Известен также нестойкий кристаллосольват с бензолом состава Вr2·С6Н6 (т. пл. -14 °С).
Так как содержание иода в буровых водах очень мало, основной задачей при получении является его концентрирование. Это обычно достигается выделением иода в свободном состоянии, чаще всего — по реакции:
2 NаI + 2 NаNО2 + 2 Н2SO4 = 2 Na2SO4 + I2 + 2 NО + 2 Н2О
с последующей его адсорбцией на активированном угле. Из последнего иод извлекают горячим раствором едкого натра по реакции:
3 I2 + 6 NаOH = 5 NаI + NаIO3 + 3 Н2О
После насыщения раствора подкислением его вновь выделяют свободный иод по реакции
5 NаI + NаIO3 + 3 Н2SO4 = 3 Nа2SO4 + 3 I2 + 3 Н2О
Морская вода содержит около 5·10-6 % иода, который извлекается из нее некоторыми водорослями и накапливается ими. Например, широко используемая населением Китая и Японии в качестве пищевого продукта ламинария (морская капуста) содержит в воздушно-сухом состоянии около 0,5 % иода.
Для получения иода из золы морских водорослей её обрабатывают водой и после упаривания раствора оставляют его кристаллизоваться. Бульшая часть содержащихся в золе хлористых и сернокислых солей выпадает при этом в осадок, а иодистые соли, как более растворимые, остаются в растворе. Иод извлекают затем обработкой раствора хлором (или МnО2 и Н2SO4).
По основным физическим свойствам бром и иод закономерно укладываются в один ряд с хлором и фтором, как это видно из приводимой ниже таблицы (в которую включен также водород):
При обычных условиях | |||||
Химическая формула | Молекулярный вес округленно | Агрегатное состояние | Цвет | Тпл °С | Ткип °С |
H2 | 2 | Газ | Бесцветный | -259 | -253 |
F2 | 38 | Газ | Почти Бесцветный | -220 | -188 |
Cl2 | 71 | Газ | Желто-зеленый | -101 | -34 |
Br2 | 160 | Жидкость | Темно-коричневый | -7 | 59 |
I2 | 254 | Твердое вещество | Темно-серый | 114 | 186 |
Плотность брома равна 3,1, иода 4,9 г/см3. Так как давление пара твердого иода очень велико, он при нагревании легко возгоняется. Возгонкой технического иода пользуются для его очистки.
Для температур плавления и кипения астата даются значения 227 и 317 °С. Теплоты плавления брома, иода и астата равны соответственно 10,5, 15,9 и 20,9 кДж/моль, а теплоты их испарения (при температурах кипения) — 29,7, 41,8 и 54,3 кДж/моль. Критическая температура брома равна 311, иода — 553 °С. Интересно, что давление паров брома и иода в присутствии индифферентных газов (N2 и др.) выше, чем при той же температуре без них.
Тройной точке на диаграмме состояния иода соответствует температура 116 °С и давление 90 мм рт. ст. Для получения жидкого иода необходимо, следовательно, создать такие условия, чтобы парциальное давление его паров превышало 90 мм рт. ст. Это проще всего достигается нагреванием достигается нагреванием большого количества кристаллов иода в колбе с узким горлом.
Жидкий иод имеет довольно высокое значение диэлектрической проницаемости (ε = 11). Он растворяет S, Sе, Те, иодиды ряда металлов и многих органические соединения. Раствор в нем иодистого калия проводит электрический ток. Сам иод диссоциирован по схеме I2 ⇔ I- + 1+, но диссоциация эта очень мала: (I+)(I-) = 10-42.
Темно-фиолетовые пары иода и красно-коричневые пары брома (в еще большей степени) обладают резким запахом. По действию на организмы бром близок к хлору. Бром применяется главным образом для выработки специальных добавок к моторным бензинам. Иод в виде 5 %-ного спиртового раствора (“иодной настойки”) применяется для стерилизации ран. Соединения обоих тяжелых галогенов имеют большое значение для фотографии, медицины и т. д. Ежегодная мировая выработка брома исчисляется десятками тысяч тонн, иода — тысячами тонн.
Физиологическая роль бромистых соединений в нормальной жизнедеятельности организма еще недостаточно выяснена. К их дополнительному введению наиболее чувствительна центральная нервная система: бромиды используются в медицине как успокаивающие средства при повышенной возбудимости. Чрезмерное их накопление способствует появлению кожных сыпей. Выводятся они из организма очень медленно (главным образом, с мочой). По токсическому действию паров бром похож на хлор. При ожоге кожи жидким бромом рекомендуется промыть пострадавшее место разбавленным раствором аммиака.
Соединения иода играют важную роль в регулировании обмена веществ. У животных организмов иод накапливается главным образом в щитовидной железе (аналогично ведет себя и вводимый в организм астат). Тело человека содержит около 25 мг иода, из которых примерно 15 мг находится в щитовидной железе. Из обычных продуктов питания наиболее богаты иодом лук и морская рыба. Недостаток иода служит причиной болезни, известной под названием “зоба”. Болезнью этой иногда страдает поголовно все население тех местностей (главным образом удаленных от моря возвышенностей), в которых воздух, вода и пища содержат слишком мало иода. Ежедневное потребление небольших — порядка 0,1 мг — доз иодидов (в виде примеси к поваренной соли) позволяет полностью избавиться от этой болезни. В Китае больных зобом издавна лечили золой морских губок (которая содержит до 8,5% иода). При добавлении в пищу иодсодержащих водорослей у коров увеличивается удой молока, а у овец быстрее растет шерсть. Отмечено также благотворное влияние небольших доз иодистых соединений на яйценоскость кур, откорм свиней и т. д.
Широко применяемая “иодная настойка” может быть приготовлена смешиванием в равных долях 10 %-ного раствора иода в спирте (95 %) и 4 %-ного водного раствора KI. Добавка иодистого калия повышает устойчивость жидкости при хранении. Следует отметить, что не только сам иод, но и многие его соединения (в частности, KI) хорошо всасываются организмом даже через неповреждённую кожу. Приём иодной настойки внутрь (1-5 капель на молоке) назначается иногда при атеросклерозе. Избыточное поступление иода в организм может вызвать некоторые неприятные явления (насморк, кожные сыпи и т. д.), исчезающие при прекращении приема иода.
Растворимость брома в воде составляет около 35 г, а иода — 0,3 г на литр. Оба эти галогена (и астат) гораздо лучше растворяются в различных органических растворителях.
Растворимость иода в воде сильно возрастает с повышением температуры и при 100 °С достигает 3,3 г/л. Органические жидкости растворяют его значительно лучше воды, как то видно из приводимых ниже примерных данных (в вес.% при обычных условиях):
С2H5OH | (C2H5)2O | C6H6 | CHCl3 | CCl4 | CS2 | ||
20 | 24 | 12 | 2,5 | 2,5 | 13 |
Растворы иода в разных растворителях имеют различные окраски: фиолетовую, красную, коричневую и промежуточных оттенков. Так как состоящие из свободных молекул I2 пары иода характеризуются сами по себе синей, а в смеси с воздухом фиолетовой окраской, наличие последней в растворе (например, в ССl4 или НГ) указывает на отсутствие заметной сольватации растворенных молекул иода. Напротив, коричневый цвет раствора (например, водного или спиртового) указывает на сильную сольватацию. В отличие от иода, цвет растворов брома почти не зависит от природы растворителя.
Благодаря лучшей, чем в воде, растворимости галоидов в органических растворителях, при соприкосновении водного раствора с органическим растворителем бульшая часть галогена переходит в последний. При этом галоген распределяется между органическим растворителем и водой в строго определенных отношениях. Если в качестве примера взять бром и сероуглерод (СS2), то отношение концентрации брома в сероуглеродной фазе к концентрации его в водной при различных общих количествах растворенного брома остается постоянным и равным примерно 80.
В этом постоянстве отношения концентраций (точнее, отношения активностей) распределение между двумя несмешивающимися растворителями вещества заключается так называемый закон распределения. Он верен, однако, лишь в том случае, если распределяемое вещество в обеих фазах имеет один и тот же состав (например из молекул) и не вступает в прямое химическое взаимодействие с растворителем. Найденное отношение концентраций (в данном примере 80) называется коэффициентом распределения. Величина его (при постоянной температуре) характерна для данной системы: растворитель А — распределяемое вещество — растворитель Б. Например, при замене сероуглерода на ССl4 коэффициент распределения брома становится равным примерно 30. Распределение имеет большое техническое значение, так как часто позволяет избирательно извлекать (экстрагировать) то или иное вещество из раствора смеси веществ.
По своей наиболее характерной химической функции бром и иод являются одновалентными неметаллами. Некоторые числовые характеристики обоих элементов сопоставлены ниже с аналогичными данными для хлора и фтора (Г — общее обозначение галогена):
Молекула Г2 | Ядерное расстояние пм | Энергия Диссоциации кДж/моль | Атом Г | Эффективный радиус, пм | Сродство к электрону, кДж/моль | Ион Г | Эффективный радиус, пм | Энергия гидратации, кДж/моль |
F2 | 142 | 159 | F | 71 | 339 | F- | 133 | 485 |
Cl2 | 198 | 242 | Cl | 99 | 355 | Cl- | 181 | 351 |
Br2 | 229 | 192 | Br | 114 | 330 | Br- | 196 | 318 |
I2 | 267 | 150 | I | 133 | 301 | I- | 220 | 280 |
Химическая активность брома и иода меньше, чем у хлора, но все же велика. Со многими металлами и некоторыми неметаллами (например, фосфором) они способны взаимодействовать в обычных условиях. При этом бром по активности мало уступает хлору, тогда как иод отличается от него уже значительно.
Подобно атомам фтора и хлора, в основном состоянии атомы брома (4s24р5) и иода (5s25р5) одновалентны.
При выводе количественных характеристик сравнительной металлоидной активности галоидов в отсутствие воды вместо энергий гидратации должны учитываться энергии связей (в ковалентных системах) или энергии кристаллических решеток (в ионных системах). Как показывает приводимое ниже примерное сопоставление, все эти величины изменяются приблизительно однотипно:
F | Cl | Br | I | |
Энергии гидратации ионов Г-, кДж/моль | 485 | 351 | 318 | 280 |
Энергии связей С-Г, кДж/моль | 485 | 339 | 284 | 231 |
Энергии решеток NaГ, кДж/моль | 915 | 777 | 740 | 690 |
Поэтому общий характер изменения металлоидной активности по ряду F-С1-Вr-I остается неизменным.
На образовании и последующем термическом разложении летучих иодидов основано иодидное рафинирование некоторых металлов (Сr, V, Тi и др.) Проводится оно в замкнутой системе путем взаимодействия иода с технически чистым образцом при 100-500 °С под давлением порядка 10-4 мм рт. ст., причем пары образующегося иодида тут же термически разлагаются на поверхности нагретой до 1300-1500 °С проволоки. Иод вновь вступает в реакцию, а вокруг проволоки постепенно наращивается стержень обрабатываемого металла, свободного от нелетучих при условиях опыта примесей.
Взаимодействие брома с водородом происходит лишь при нагревании. Иод с водородом реагирует только при достаточно сильном нагревании и не полностью, так как начитает идти обратная реакция — разложение иодистого водорода. Оба галогеноводорода удобно получать разложением водой соответствующих галогенидных соединений фосфора по схеме:
РГ3 + 3 Н2О = Н3РО3 + 3 НГ↑
Реакция легко идет уже при обычной температуре.
Синтез НВr из элементов протекает при 200-300 °С с измеримой скоростью по следующим уравнениям:
Вr2 + 192 кДж = 2 Вr (первоначальное возбуждение),
Вr + Н2 = НBr + Н,
затем Н+ Вr2 = НBr + Вr и т. д.
В отличие от синтеза НСl вторая реакция затруднена из-за её эндотермичности (71 кДж/моль), а обратная ей реакция
Н + НВг = Н2 + Вr
протекает легко. Поэтому возникающие цепи часто обрываются и процесс не приобретает взрывного характера. Так как реакция I + Н2 = НI + Н ещё более эндотермична (138 кДж/моль), синтез HI вообще не является цепной реакцией, а протекает по обычному бимолекулярному типу.
Подобно хлористому водороду, HBr и HI представляют собой бесцветные газы, очень хорошо растворимые в воде. Некоторые их свойства сопоставлены со свойствами HF и HCl в приводимой ниже таблице. По ряду НI-НВr-НСl свойства изменяются весьма закономерно, тогда как при дальнейшем переходе к НF наблюдается более или менее резкий их скачок, иногда даже в направлении, обратном общему ходу. Обусловлено это сильной ассоциацией фтористого водорода, отсутствующей у его аналогов.
Энергии связей Н-Вr и Н-I равны соответственно 364 и 297 кДж/моль. Жидкие галоленоводороды характеризуются при температурах кипения плотностями 2,2 (НВr) и 2,8 (НI) г/см3 и теплотами испарения 17,6 и 19,6 кДж/моль. Как растворители, они похожи на НСl. Энергии диссоциации молекул НГ на свободные газообразные ионы Н+ и Г- составляют 1517 (НF), 1359 (НСl), 1317 (НВr) и 1283 (НI) кДж/моль. Теплота образования АtН из элементов оценивается в –105 кДж/моль.
Судя по характеру изменения теплот образования гидрогалогенидов, их термическая устойчивость должна сильно уменьшаться от фтора к иоду. Действительно, распад НF на элементы становится заметен лишь выше 3500 °С, тогда как для других галоидоводородов имеем при 1000 °С следующие степени диссоциации: 0,0014 (НС1), 0,5 (НВг) и 33 % (НI). В органических растворителях (бензоле и т. п.) все гидрогалиды растворимы гораздо хуже, чем в воде.
Как и хлористый водород, НВr и НI образуют с водой азеотропные смеси, содержащие соответственно 47 % НВr (т. кип. 126 °С) и 57 % НI (т. кип. 127 °С). Для обоих галогеноводородов известны кристаллогидраты с 2, 3 и 4 молекулами воды. И для брома, и для иода были получены аналогичные соответствующему хлориду нестойкие производные типа (ХR4)НГ2, где R — органический радикал.
Увеличение электролитической диссоциации при переходе от НF к НI обусловлено, вероятно, уменьшением поверхностной плотности отрицательного заряда галоидов в связи с ростом их ионных радиусов.
В неводных растворителях галогеноводороды большей частью ведут себя как неэлектролиты или слабые электролиты. При этом обычно наблюдается гораздо более резкое усиление ионизации по мере повышения атомного номера галоида, чем в водных растворах. Так, в пиридине константы диссоциации галогеноводородов имеют следующие значения: 3·10-9 — (НF), 4·10-6 (НСl), 1·10-4 (HBr), 3·10-3 — (НI).
Галогеноводород | Теплота образования из элементов, кДж/моль | Ядерное расстояние, пм | Длина молекулярного диполя, пм | Тпл, °С | Ткип, °С | Растворимость в воде моль/л при 10 °С | Степень диссоциации в 0,1 н. растворе, % |
HF | 272 | 92 | 36 | -83 | +19,5 | ∞ | 9,0 |
HCl | 92 | 128 | 23 | -114 | -85 | 14 | 92.6 |
HBr | 33 | 141 | 17 | -87 | -67 | 15 | 93,5 |
HI | -25 | 162 | 9 | -51 | -35 | 12 | 95,0 |
По химическим свойствам НВr и НI очень похожи на хлористый водород. Подобно последнему в безводном состоянии они не действуют на большинство металлов, а в водных растворах дают очень сильные бромистоводородную и иодистоводородную кислоты. Соли первой носят название бромистых или бромидов, второй — иодистых или иодидов (а производные галогеноводородных кислот вообще — галогенидов). Растворимость бромидов и иодидов в большинстве случаев подобна растворимости соответствующих хлоридов. Возможность существования в виде отрицательно одновалентного иона установлена и для астата.
Существенное различие между НI, НВr и НСl наблюдается в их отношении к окислителям. Молекулярный кислород постепенно окисляет иодистоводородную кислоту уже при обычной температуре (причем под действием света реакция сильно ускоряется):
О2 + 4 НI = 2 Н2О + I2
Бромистоводородная кислота взаимодействует с ним гораздо медленнее, а соляная вовсе не окисляется молекулярным кислородом. Так как, однако, соляная кислота способна окисляться под действием MnО2 и т. п., из изложенного следует, что галоидоводороды (кроме НF) могут служить в качестве веществ, отнимающих кислород, т. е. в качестве восстановителей, причем наиболее активным в этом отношении является НI. Газообразный иодистый водород способен даже гореть в кислороде (с образованием Н2О и I2). Легкая окисляемость в растворах характерна и для производных отрицательно одновалентного астата.
Получение растворов иодистоводородной кислоты (вплоть до 50 %-ной концентрации) удобно вести, пропуская Н2S в водную суспензию иода. Реакция идет по схеме:
I2 + Н2S = 2 НI + S
Для предохранения водных растворов от окисления кислородом воздуха рекомендуется добавлять к ним небольшое количество красного фосфора (1 г/л), который, будучи практически нерастворимым в иодистоводородной кислоте, вместе с тем тотчас переводит образующийся при окислении свободный иод снова в НI.
Выделяющийся при частичном окислении иодистоводородной кислоты свободный иод не осаждается, а остается в растворе вследствие взаимодействия с избытком ионов I– по схеме: I– + I2 = I3– + 16,7 кДж/моль. Аналогично могут возникнуть ионы Вr3– и СI3–, а также ионы Г3– образованные разными галоидами (кроме фтора). Образующийся в растворе ион Г3– находится при этом в равновесии с продуктами своего распада: Г3– ⇔ Г– + Г2. Устойчивость ионов Г3–, зависит от природы галоида и характеризуется следующими значениями констант равновесия:
(Г3–)/(Г2)·(Г–) = K Г Сl Br I
K 0,2 16 700
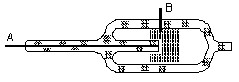
Рис. . Схема простейшего хемотрона.
Как видно из приведенных данных, по ряду С1-Вг-I устойчивость ионов Г3– быстро возрастает. Разбавление растворов и нагревание благоприятствуют смещению равновесий вправо, большая концентрация Г– — влево. Результатом существования подобных равновесий является более высокая растворимость свободных галоидов в растворах галогенидов по сравнению с чистой водой.
Система 3 I– ⇔ I3– + 2 е- часто служит рабочей средой хемотронов — электрохимических установок для разностороннего оперирования со слабыми электрическими токами. Показанный на рис. простейший хемотрон представляет собой небольшой замкнутый сосуд, заполненный раствором КI с незначительной добавкой свободного иода (т. е. содержит много ионов I– и мало ионов I3-). Из двух впаянных платиновых электродов линейный (А) имеет малую рабочую поверхность, а сетчатый (Б) — большую. При включении тока в такой установке идут реакции:
3 I– - 2 е- = I3– — у анода и 2 е- + I3– = 3 I– — у катода.
Если анодом является электрод А, а катодом — Б, то ионов I– около первого много (благодаря их высокой концентрации в растворе), ионов I3– около второго электрода тоже много (благодаря его большой поверхности), и ток свободно идет. Напротив, имеющийся около катода А небольшой запас ионов I3–, почти мгновенно исчерпывается, и ток практически прерывается. Рассматриваемая установка может, следовательно, служить выпрямителем слабых переменных токов низких частот, вообще же различные варианты хемотронов находят самое разнообразное техническое использование (например, в системах управления ракетными двигателями).
При рассмотрении кислородных соединений брома и иода, как и в случае хлора, удобно исходить из обратимой реакции
Г2 + Н2О ⇔ НГ + НОГ
равновесие которой при переходе от хлора к брому и затем иоду все более смещается влево.
В зависимости от природы галогенида, константы равновесия гидролиза имеют следующие значения:
(Н+)·(Г–)·(НОГ)/(Г2) = K 3·10-4 4·10-9 5·10-13
Г Cl Br I
В щелочной среде действительна иная трактовка гидролиза свободных галоидов, а именно по схеме:
Г2 + ОН– ⇔ НОГ + Г–
Растворы бромистоватистой (HOBr) и иодноватистой (HOI) кислот могут быть получены аналогично хлорноватистой кислоте. Обе кислоты являются неустойчивыми соединениями и сильными окислителями. По ряду HOCl-HOBr-HOI и устойчивость и окислительная активность уменьшается.
В том же направлении от хлора к иоду, ослабляется и кислотный характер соединений НОГ. Бромноватистая кислота является уже очень слабой, тогда как иодноватистая обладает амфотерными свойствами. Обе кислоты известны только в разбавленных растворах желтоватой или зеленоватой окраски со своеобразными запахами.
Вероятно, удобным путем получения бромноватистой кислоты могла бы быть реакция по схеме:
Ag2SO4 + Вr2 + Ва(ОН)2 = 2 АgВr↓ + ВаSO4↓ + 2 НОВг
Перегонку растворов НОВr (К = 2·10-9) можно производить только под уменьшенным давлением (ниже +30 °С), а НОI без разложения вообще не перегоняется. Обе кислоты известны лишь в растворах (НОВr — до 30 %-ной концентрации). Особенно неустойчивая иодноватистая кислота может быть несколько стабилизирована добавлением иода ( в результате равновесия НOI + I– ⇔ НOI2). Константа диссоциации НOI по кислотному типу (К = 2·10-11) даже меньше, чем по основному (3·10-10). Для реакции по уравнению
Н2О + Н2OI- ⇔ Н3О+ + НOI
было получено значение константы равновесия К = 3·10-2. Это значит, что при (Н3О+) = 1 (и отсутствии ионов I–) более трети всего растворенного количества НOI находится в форме ионов Н2OI+ (т. е. I+). С возможностью аналогичной основной диссоциации приходится считаться и у НОВr, и даже у НОСl.
Из солей обеих кислот в твердом состоянии были выделены только KOВr·3Н2О и кристаллогидраты NаОВr с 5 и 7 молекулами воды. Все эти светло-желтые соли очень неустойчивы, а при нагревании (или подкислении раствора) тотчас распадаются на соответствующие бромид и бромат.
43) Термическим разложением LiВгО3 при 200 °С был получен бромит лития — LiВrО3. Он представляет собой белый порошок, уже в присутствии следов воды разлагающийся по уравнению
3 LiВrО2 = LiВr + 2 LiВrО3
а при температуре плавления (225 °С) распадающийся на LiВr и O2. Аналогичные свойства характерны и для получаемого подобным же образом Ва(ВrО2)2.
44) При низких температурах (порядка -50 °С) бром окисляется озоном но реакции:
4 О3 + 3 Вr2 = 6 ВrО2
Образующийся диоксид брома (теплота образования из элементов — 54 кДж/моль) представляет собой светло-желтое твердое вещество, устойчивое лишь ниже -40 °С. Одним из продуктов её термического разложения в вакууме является коричневый гемиоксид брома (Вr2О), плавящийся при -17 °С (с разложением) и дающий с водой НОВr. Гемиоксид брома частично образуется также при действии брома на сухой оксид ртути или его взвесь в СС14. Он устойчив лишь ниже -40 °С. Аналогичный оксид иода известен только в форме оранжево-красного двойного соединения с пиридином — I2O·4С5Н5N.
Помимо окислительного распада, для HOBr и HOI очень характерны реакции по схеме:
3 НОГ = 2 НГ + НГО3
ведущие к образованию бромноватой (HBrO3) или иодноватой (HIO3) кислоты. Первая известна только в растворах, а вторая может быть выделена в виде легкорастворимых кристаллов. Обе кислоты бесцветны.
Бромноватая кислота очень похожа по свойствам на HClO3, тогда как и окислительные, и кислотные свойства иодноватой выражены значительно слабее. По ряду HClO3-HBrO3-HIO3 растворимость солей, как правило, уменьшается. Подобно хлоратам, броматы и иодаты в щелочных и нейтральных средах окислителями не являются.
Скорость реакции 3 НОГ = 2 НГ + НГО3 при переходе от хлора к брому и затем иоду быстро возрастает. Для брома было экспериментально установлено, что она максимальна при равной концентрации ОВr– и НОВr. Это позволяет предполагать активное участие в процессе молекул изобромноватистой кислоты — НВгО. И у брома, и у иода реакции протекают, вероятно, через промежуточное образование ионов ГО2–, однако аналогичные хлористой кислоте и хлоритам производные обоих элементов неизвестны. На приведенный выше основной процесс сильно налагается взаимодействие между НГ и НОГ. Поэтому общее уравнение разложения бромноватистой и иодноватистой кислот приближенно имеет вид:
5 НОГ = НГО3 + 2 Г2 + 2 Н2О.
Растворы бромноватой кислоты могут быть получены, в частности, по реакции:
5 АgВrО3 + 3 Вr2 + 3 Н2О = 5 АgВr + 6 НВгО3
Концентрировать их удается лишь до 50 %-ного содержания (т. е. приблизительно до состава НВrО3·7H2O). И окислительные, и кислотные свойства НВrО3 приблизительно таковы же, как у НСlO3. Для иона ВrО3- даются значения d(ВrО) = 178 пм и ∠ОВгО = 112°.
Иодноватая кислота образуется, в частности, под действие хлора, на водную суспензию иода по реакции:
I2 + 5 Сl2 + 6 Н2О = 2 Н2O + 10 HCl
Поэтому при добавлении к раствору иодистой соли избытка хлорной воды появляющаяся вначале окраска иода затем вновь исчезает.
Для получения НIO3 (К = 0,2) обычно пользуются взаимодействием иода с крепкой азотной кислотой:
I2 + 10 НNО3 = 2 НIO3 + 10 NО2 + 4 H2O
Выделяющиеся окcиды азота удаляют пропусканием сквозь жидкость струи воздуха. Из сконцентрированного раствора при охлаждении осаждаются бесцветные кристаллы НIO3, плавящиеся при 110 °С (с переходом в НIO3·I2О5) и расплывающиеся на воздухе. Для молекулы НIO3 даются значения d(IO) = 180 пм (две связи) и 190 пм (одна связь), ∠OIO = 98°, а для иона IO3-, значения d(IO) = 182 пм и ∠OIO = 97°. В растворах иодноватой кислоты имеет место равновесие nНIO3 = (НIO3)3, где n = 2 или 3.
Растворимость производящихся от кислот НГО3 солей по ряду Сl-Br-I обычно уменьшается. Примером могут служить приводимые ниже данные (моль на литр Н2О при 20 °С):
NaClO3 | NaBrO3 | NaIO3 | KClO3 | KBrO3 | KIO3 | ||
9,2 | 2,3 | 0,46 | 0,58 | 0,41 | 0,38 |
В противоположность НСlO3 и НВrО3, для иодноватой кислоты, характерна совместная кристаллизация с её солями. Известны NаIO3·2HIO3, КIO3·НIO3, KIO3·2НIO3 и т. д. Получены были также некоторые продукты присоединения к иодатам иодноватого ангидрида, например КIO3·I2О5 (т. пл. 316 °С).
Подобные соли иногда рассматривают как производные “трииодноватой” кислоты — НI3O8. Доводом в пользу такой трактовки может служить возможность получения свободной НI3O8 как путем частичного термического разложения НIO3, так и путем её перекристаллизации из концентрированной НNО3. Однако “молекула” НI3O8 слагается из отдельных молекул НIO3 и I2O5, между иодными и кислородными атомами которых существует лишь сильное межмолекулярное взаимодействие.
Осторожным обезвоживанием HIO3 может быть получен белый порошок иодноватого ангидрида — I2O5. Он обладает сильными окислительными свойствами, а с водой вновь дает иодную кислоту.
В отличие от оксидов других галоидов, I2O5 является экзотермичным соединением (теплота образования 184 кДж/моль). Практически он может быть получен постепенным нагреванием НIO3 до 120 °С с последующим длительным выдерживанием при этой температуре. Кристаллы иодноватого ангидрида слагаются из молекул O2I-O-IO2 со значениями d(OI) = 177÷183 пм, ∠OIO = 93÷102° для концевых частей и d(IO) = 192÷195 пм, ∠IOI = 139° — для центральной части. Продажный препарат обычно имеет розоватый или желтоватый оттенок (обусловленный следами свободного иода). Продажный ангидрид постепенно разлагается на свету и очень гигроскопичен. Применяется он главным образом при газовом анализе для определения монооксида углерода (основанного на реакции I2O5 + 5 СО = 5 СО2 + I2).
При действии тлеющего разряда на смесь паров брома с избытком охлажденного кислорода образуется триоксид брома — ВrО3 (вероятно, в димерной форме — Вr2О6). Оксид этот (которому ранее приписывали формулу Вr2О6) представляет собой бесцветное кристаллическое вещество, устойчивое лишь ниже -70 °С. С водой он образует, по-видимому, две кислоты — НBrО3 и НВrO4, из которых последняя тотчас же разлагается на HBrО3 и кислород.
Вместе с тем взаимодействием Вr2 с избытком озона были получены Br3O8 и Вr2О5, но получить таким путем Вr2О6 не удалось. Вопрос о высших оксидах брома остается, таким образом неясным.
Соли бромной кислоты (HBrO4) образуются при окислении броматов фтором в щелочной среде:
NaBrO3 + F2 + 2 NaOH = 2 NaF + NaBrO4 + H2O
Сама кислота по силе близка к хлорной, но гораздо менее устойчива (известна только в растворе) и является более сильным окислителем. Её соли (перброматы) похожи по свойствам на перхлораты.
Иодная кислота (HIO4) может быть получена электролизом раствора HIO3 (по схеме H2O + HIO3 = H2↑(катод) + HIO4(анод)). Выделяется она в виде бесцветного кристаллогидрата HIO4·2H2O. Кислотные свойства HIO4 выражены несравненно слабее, чем у HClO4, а окислительные, наоборот, гораздо более отчетливо. Большинство солей иодной кислоты (периодатов) малорастворимо в воде.
Несмотря на неоднократные попытки, бромную кислоту впервые удалось получить только в 1968 г. При обычных условиях её бесцветный раствор устойчив приблизительно до 6 М концентрации (55 %-ного содержания). Более крепкие растворы при хранении желтеют (вследствие восстановления НВrO4 до свободного брома). Как окислитель бромная кислота значительно сильнее хлорной, но окисляет она медленно (как и хлорная). Растворимость КВrО4, при комнатной температуре составляет около 0,2 М, т. е. несколько больше, чем у КСlO4. Ион ВrО4-, представляет собой тетраэдр с d(ВrО) = 161 пм. Пербромат калия термически устойчив до 280 °С (против 610 °С для КСlO4). Получен и пербромат аммония — NН4ВrO4.
Как кислота НIO4 (K = 3·10-2) слабее иодноватой. Наоборот, как окислитель она более активна, чем HIO3 (но менее, чем НOI). Весьма интересно отношение НIO4 к воде. При их взаимодействии в зависимости от условий может образоваться несколько соединений общей формулы (НIO4)n·(Н2О)m. Во всех таких соединениях водороды воды способны замещаться на металл так же, как и водород самой НIO4. В связи с этим соединения подобного типа обычно рассматривают как сложные кислоты и приписывают им следующие формулы: НIO4 (n=1, m=0), Н3IO5 (n=1, m=1), Н4I2O9 (n=2, m=1), Н5IO6 (n=1, m=2). Например, были получены К4I2O9 и следующие серебряные соли: оранжевая АgIO4, красная АgНIO5, черная Аg3IO5, зеленовато-желтая Аg2Н3IO6 и черная Аg5IO6.
При взаимодействии НIO4 с 65 %-ным олеумом образуется оранжевое твердое вещество. Судя по результатам анализа, оно представляет собой иодный ангидрид — I2O7. Свойства его пока не изучены. Двойным соединением I2O7·I2O5 является, вероятно, желтый продукт термического разложения Н5IO6 в вакууме при 110 °С.
Соли иодных кислот, как правило, труднорастворимы в воде. Некоторые из них весьма термически устойчивы (например, Nа5IO6 выдерживает без разложения нагревание до 800 °С). Получают периодаты обычно действием хлора в щелочной среде на соли иодноватой кислоты (например, по реакции
NaIO3 + 4 NаОН + Сl2 = Nа3Н2IO6 + 2 NаСl + Н2О
или же электролизом растворов солей HIO3.
Сообщалось, что термический распад Nа2Н3IO6 около 200 °С ведет к образованию Nа2IO4. Магнитные свойства препарата подтверждают как будто, что это вещество является производным шестивалентного иода. Оно устойчиво до 370 °С, а водой тотчас разлагается на иодат и периодат. Подобным же образом были получены некоторые другие соли, предположительно также являющиеся производными шестивалентного иода.
Кроме рассмотренных выше кислородных соединений брома и иода, известны еще некоторые. Из них наиболее интересны производные трёхвалентного иода, в которых он играет роль металла. Например, были получены устойчивый лишь ниже 0 °С желтый I(NО3)3, желтый IРO4, желто-зеленый I(ClO4)3·2Н2О и бесцветный I(СН3СОО)3. При электролизе последней соли иод выделяется на катоде, чем и доказывается его положительный заряд. Из аналогичных производных брома известен бесцветный Br(NO3)3.
Солеобразные производные одновалентных иода и брома очень неустойчивы сами по себе, но некоторые из них довольно устойчивы в виде двойных соединений с пиридином. Например, желтый INО3 разлагается уже выше -5 °С, тогда как бесцветный INО3·2С5H5N плавится при 138 °С без разложения. Сходные свойства имеют желтый ВrNО3 (т. пл. -42 °С) и бесцветный ВrNО3·2С5Н5N (т. пл. 80 °С). Известны также аналогичные нитратам по составу перхлораты и производящиеся от одновалентного иода соли некоторых органических кислот. Наиболее интересным из этих производных Вr+ является бромперхлорат, который был получен при -45 °С по реакции
Вr2 + 2 СlClO4 = Сl2 + 2 ВrСlO4
и представляет собой красную жидкость, еще не замерзающую при -78 °С и медленно разлагающуюся уже при -20 °С. Озонированием ВrNО3 был получен очень неустойчивый оранжевый ВrО2NО3.
Растворение смеси 2 I2+3 I2O5 (что эквивалентно 5 I2O3) в концентрированной Н2SO4 ведет к образованию желтых расплывающихся на воздухе кристаллов (IO)2SO4. При обработке дымящей Н2SО4 они белеют, по-видимому, вследствие перехода в (IO)НSО4. Обработка сульфатов иода водой сопровождается выделением I2 и желтого труднорастворимого порошка состава I2O4. Оксид этот, разлагающийся выше 100 °С на I2 и I2O5, следует рассматривать как основную иодноватокислую соль трехвалентного иода — (IO)IO3.
При обработке иода озоном образуется желтоватый расплывающийся на воздухе (с разложением) порошок состава I4O9. По-видимому, он представляет собой среднюю иодноватокислую соль трехвалентного иода — I(IO3)3. Выше 75 °С иодтрииодит разлагается с выделением иода.
Как видно из рассмотренного выше материала, аналогия брома и иода с хлором в их кислородных соединениях выражена уже далеко не столь полно, как в водородных: закономерный характер изменения свойств при переходе по ряду Cl-Br-I здесь ограничивается главным образом кислотами типов НОГ и НГО3 и их солями. О кислородных соединениях астата известно лишь, что они существуют, причем высшая степень окисления отвечает иону AtO3-, т. е. степени окисления +5.
Астат несколько менее летуч, чем иод, и из разбавленных азотнокислых растворов не отгоняется (в отличие от иода). Сероводородом в солянокислой среде он осаждается вместе с Вi2S3 и Sb2S3, а обработка осадка сернистым аммонием частично переводит At в раствор. Состав образующихся при этом его соединений не установлен. Самый концентрированный из подвергавшихся исследованиям раствор соединений астата был относительно него 10-8 М.
Наиболее сильными окислителями (в частности, НОС1) астат окисляется до иона АtО3–. Известна и другая, более низкая положительная валентность Аt, возникающая при его обработке менее сильными окислителями (Вr2, НNО3 и т. д.). По-видимому, в этих условиях образуется ион ОАt–. Установлена также возможность замещения астатом (Аt–) иода в его производных типа IХ·2С5Н5N (где Х = NО3 или СlO4). Раствор FеSO4 восстанавливает окисленные состояния Аt до элементарного. Действием Zn в кислой среде (или SnСl2 в щелочной) астат может быть далее восстановлен до иона Аt–. Последний легко вновь окисляется до элементарного Аt.