Подгруппа селена
Подгруппа селена.По электронным структурам нейтральных атомов селен и теллур являются прямыми аналогами серы. Эти три элемента, вместе взятые, иногда называют халькогенами (“рождающими медь”). Наиболее тяжелый элемент подгруппы — полоний — радиоактивен, относится к наименее распространенным (содержание в земной коре около 2·10-15 %) и сравнительно с другими мало изучен.
Теллур открыт в 1798 г., селен — в 1817 г., полоний — в 1898 г.
Природный селен состоит из изотопов с массовыми числами 74 (0,9 %), 76 (9,0 %), 77 (7,6 %), 78 (23,5 %), 80 (49,8 %), 82 (9,2 %), а теллур — из изотопов с массовыми числами 120 (0,1 %), 122 (2,4 %), 123 (0,9%), 124 (4,6 %), 125 (7,0 %), 126 (18,7 %), 128 (31,8 %), 130 (34,5 %). Приведённые данные показывают, что у обоих элементов количественно преобладают более тяжёлые разновидности атомов. Для полония известны только радиоактивные изотопы, из которых в природе встречается 210Po (средняя продолжительность жизни атома 200 дней).
По структуре внешних электронных слоев атомы селена (4s24p4), теллура (5s25р4) и полония (6s26p4) подобны атому серы и в своем основном состоянии тоже двухвалентны. Возбуждение четырехвалентного состояния требует довольно большой затраты энергии.
Источником полония ранее служили радионосные руды. В настоящее время его получают искусственно (исходя из висмута). Элементарный полоний может быть выделен из растворов его соединений с помощью электролиза (в ряду напряжений он располагается между медью и серебром). При изучении этого элемента исследованию обычно подвергаются лишь миллиграммовые количества, что обусловлено даже не столько трудностью его получения, сколько очень сильной радиоактивностью полония (в темноте можно видеть его светло-голубое самосвечение).
Содержание селена в земной коре составляет 1·10-5 %, теллура — 1·10-7 %. Для обоих элементов наиболее характерно совместное нахождение с такими металлами, как Cu, Pb, Hg, Ag и Au. Самостоятельно минералы Se и Te встречаются крайне редко, обычно же лишь в виде примесей к аналогичным минералам серы.
Основным источником промышленного получения селена и теллура служат осадки (“шламы”), образующиеся при электролитической выработке меди. Ежегодная мировая добыча селена имеет порядок 1 тыс. т, теллура — 200 т.
Извлечение Sе и Те из производственных отходов металлургической (или сернокислотной) промышленности основано на переводе обоих элементов в четырёхвалентное состояние с последующим их восстановлением сернистым газом. Восстановление первоначально ведется в крепкой (10-12 н) соляной кислоте, причём выделяется только селен. Затем, после сильного разбавления жидкости водой, выделяется теллур.
Очистка селена от примесей может быть проведена различными методами. Например, можно воспользоваться его хорошей растворимостью в горячем концентрированном растворе Nа2SО3. Если затем добавить немного раствора Аl2(SO4)3, то выпадающий осадок гидроксида (и основных солей) алюминия увлекает с собой примеси к исходному селену. Отфильтровав этот осадок, раствор затем охлаждают, что сопровождается выделением очищенного селена. Очистить последний можно также путем продувания при 450 °С струи воздуха сквозь его расплав с последующей перегонкой остатка в вакууме.
Теллур очищают перегонкой в вакууме или в токе водорода. Для его очистки пользуются также переводом теллура в основную азотнокислую соль состава Те2О3(OH)NО3 с последующим обратным выделением после очистки этой соли перекристаллизацией. Комбинированием всех трёх приемов может быть достигнута очень хорошая очистка.
Селен применяется главным образом в полупроводниковой технике (изготовление выпрямителей переменного тока и т. д.). Он используется также в стекольной промышленности, при вулканизации каучука, в фотографии и при изготовлении некоторых оптических и сигнальных приборов. Последнее применение основано на том, что электропроводность селена сильно возрастает с увеличением интенсивности его освещения. По своей спектральной характеристике селеновый фотоэлемент довольно близок к человеческому глазу, но гораздо чувствительнее.
Этим свойством в некоторой степени обладает и теллур, электропроводность которого резко возрастает также при высоких давлениях (в 100 раз при 12 тыс. атм и становится металической при 30 тыс. атм). Потребляется он главным образом в производстве свинцовых кабелей: добавка теллура (до 0,1 %) к свинцу сильно повышает его твёрдость и эластичность. Такой свинец оказывается также более стойким по отношению к химическим воздействиям. Кроме того, теллур находит применение при изготовлении полупроводников и при вулканизации каучука. Соединения его используются для окраски стекла и фарфора, в фотографии и микробиологии (для окрашивания микробов).
При выделении из растворов своих соединений оба элемента осаждаются в виде порошков, соответственно красного и коричневого цвета. Однако наиболее типичны для них те модификации, некоторые свойства которых сопоставлены ниже с соответствующими свойствами кислорода серы и полония.
Элемент | При обычных условиях | Температура плавления, | Температура кипения, | Плотность в твёрдом | |
Агрегатное состояние | Цвет | °С | °С | состоянии, г/см3 | |
O | газ | бесцв. | –218 | –183 | 1,3 |
S | твёрд. | жёлтый | 119 | 445 | 2,1 |
Se | » | серый | 221 | 685 | 4,8 |
Te | » | серебристо-белый | 450 | 990 | 6,2 |
Po | » | » » | 254 | 962 | 9,3 |
Селен и теллур устойчивы на воздухе и нерастворимы в воде. Все соединения селена сильно ядовиты.
Основные аллотропические модификации селена можно свести к трем формам, обладающим различной внутренней структурой. Самой устойчивой из них является серый селен, образованный бесконечными спиральными цепями его атомов (d(SеSе) = 232 пм, ∠SеSeSе = 105°) уложенными в кристалле параллельно друг другу. Две другие формы по отношению к этой метастабильны. Из них красный селен в двух своих кристаллических разновидностях (Sеα и Sеβ) образован кольцевыми молекулами Sе8 со средними параметрами d(SеSе) = 235 пм и ∠α = 106°. Третья форма — амфотерный селен (порошкообразный или стекловидный) — образована зигзагообразными цепями, перепутанными друг с другом. При обычных температурах метастабильные формы селена в стабильную (серую) практически не переходят. Серый селен является полупроводником р-типа с шириной запрещенной зоны 1,5 эВ.
Выделяемый действием сернистого газа при получении селена его кирпично-красный порошок настолько тонок, что лишь с трудом оседает. Около 50 °С он темнеет и спекается в почти чёрную хрупкую массу стекловидного селена (плотность 4,3 г/см3). Последний может быть получен также быстрым охлаждением расплавленного селена (например, выливанием его в воду). После такой “закалки” масса долгое время сохраняет пластичное состояние. Уже при 50 °С твердый стеклообразный селен начинает размягчаться, а около 100 °С претерпевает протекающее со значительным выделением тепла (около 46 кДж/моль) и кратковременным разжижением массы превращение в серую форму.
При контакте стекловидного селена с некоторыми органическими жидкостями (СS2 и др.) он медленно в темноте и быстрее на свету переходит в красный кристаллический селен. Последний несколько растворим в сероуглероде (около 0,05 % при обычных условиях и 0,1 % при 46 °С). Упариванием такого раствора ниже 72 °С могут быть получены моноклинные кристаллы Sе (пл. 4,5 г/см3), а выше этой температуры — гексагональные кристаллы Sе (пл. 4,4 г/см3). При быстром нагревании до 180 °С красный селен плавится без изменения, вообще же переход его в серую форму начинает протекать уже выше 110 °С.
Стабильная серая форма может быть получена также из расплавленного селена, но лишь при условии его очень медленного охлаждения. Удобнее её получать возгонкой селена под уменьшенным давлением. При нагревании выше 72 °С селен становится пластичным и легко поддается механическим деформациям. С повышением давления его температура плавления возрастает, достигая при 4 тыс. атм примерно 270 °С. Плавление сопровождается резким увеличением объёма (приблизительно на 16 %). Теплота плавления селена составляет 6,7 кДж/моль. В отличие от серы вязкость коричнево-красной жидкости (плотность около 4,05 г/см3) с повышением температуры непрерывно уменьшается. Теплота испарения селена равна 29,3 кДж/моль. В его желтоватых парах имеет место равновесие 1/4 Sе8 ⇔ 1/3 Sе6 ⇔ 1/2 Sе4 ⇔ Sе2, смещённое вправо более, чем у серы.
Обе основные формы теллура — порошкообразная тёмно-коричневая (“аморфная”) и металлоподобная серебристо-белая — слагаются из бесконечных спиральных цепей его атомов (d(ТеТе) = 286 пм, ∠ТеТеТе = 102°). Переход коричневой формы в металлоподобную (похожую по внешнему виду на олово, но хрупкую и имеющую полупроводниковые свойства) осуществляется с заметной скоростью только при нагревании (теплота перехода около 0,8 кДж/моль). Работа выхода электрона из металлоподобной формы равна 4,7 эВ. Под высокими давлениями существуют аллотропические модификации теллура, природа которых пока не изучена.

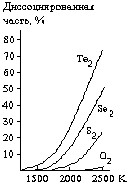
Рис. 1. Диаграмма состояния Рис. 2. Термическая диссоциация
теллура при высоких давлениях молекул Э2.
(тыс. атм).
При повышенных температурах теллур настолько пластичен, что поддаётся прессованию. В вакууме он легко возгоняется. Теплота его плавления равна 17,6, а испарения — 51 кДж/моль. Плавление сопровождается увеличением объема приблизительно на 5 %. Интересной особенностью жидкого теллура является наличие у него максимума плотности немного выше температуры плавления (как у воды). С жидким иодом он смешивается в любых соотношениях. Золотисто-жёлтые пары теллура состоят преимущественно из молекул Те2.
Полоний имеет уже явно выраженный вид металла. По физическим свойствам он более похож на Т1, Вi и Рb, чем на Те (напротив, по химическим — чрезвычайно похож на теллур). Для полония известны две аллотропические формы, переходящие друг в друга при разных температурах (α → β при 54 °С и β → α при 18 °С) и сосуществующие в этом температурном интервале. Следует отметить, что данные эти не очень надежны из-за саморазогревания полония, обусловленного его сильной радиоактивностью.
Как видно из рис. 2, термическая диссоциация молекул Sе2 и Те2 осуществляется значительно легче, чем в случаях серы и кислорода. Последнее связано с общим характером изменения ядерных расстояний и энергий диссоциации по ряду О - Те:
Молекулы | О2 | S2 | Se2 | Te2 |
d, пм | 121 | 189 | 219 | 257 |
Энергия диссоциации, кДж/моль | 497 | 418 | 318 | 217 |
Теплоты атомизации селена и теллура при 25 °С равны соответственно 226 и 192 кДж/моль.
Друг с другом селен и теллур не соединяются (но смешанные кристаллы образуют). Селен способен соединяться с серой, давая циклические смешанные молекулы SnSе8-n и образованные ими кристаллы, примерами которых могут служить красные Sе4S4, (т. пл. 113 °C) и светло-оранжевые Sе2S6 (т. пл. 122 °С). Для теллура было получено соединение с серой состава ТеS7.
Теллур уже при обычных условиях очень медленно взаимодействует с водой по схеме:
Те + 2 Н2О = ТеО2 + 2 Н2
При нагревании подобным же образом реагирует с водой и аморфный селен, тогда как кристаллический не взаимодействует с ней даже при 150 °С. Оба элемента растворяются в растворах Nа2Sn с образованием ионов SеS22- или ТеS32-. Mелкораздробленные Sе и Те растворяются в холодной концентрированной серной кислоте. Установлено, что растворение идет с образованием желтых ионов Sе42+, зеленых Sе82+ или красных Те42+. При разбавлении раствора водой происходит обратное выделение Sе или Те. Из раствора теллура в жидком серном ангидриде избыток SO3, может быть удалён нагреванием. Дальнейшее нагревание полученного таким путем ТеSO4, сопровождается отщеплением SO2 и образованием черного твердого вещества, по составу отвечающего формуле ТеО (но представляющего собой, по-видимому, смесь ТеО2 + Те). Полоний ведет себя аналогично теллуру, давая красный РоSO3 и черный РоО.
Повышенное содержание селена в почвах может обусловить частичное замещение им серы при построении белковых молекул растительных организмов. Результатом являются заболевания как самих растений, так и питающихся ими животных: у скота выпадает шерсть, размягчаются копыта и т. д. Отмечалось избирательное накопление селена мухоморами.
При приеме внутрь соединения селена действуют подобно мышьяку. После отравлений ими появляется очень неприятный запах от всего тела и выдыхаемого воздуха. Газообразные производные селена уже в ничтожных концентрациях вызывают головную боль, раздражение верхних дыхательных путей, продолжительную потерю обоняния и затяжной насморк. При попадании его соединений на кожу образуются сыпи и болезненные воспаления. Вместе с тем ничтожные дозы селенитов (порядка 3 мкг на 100 г пищи), по-видимому, предотвращают заболевания некротического характера. Отмечалось также прямая связь между остротой зрения животных и содержанием селена в сетчатке их глаз.
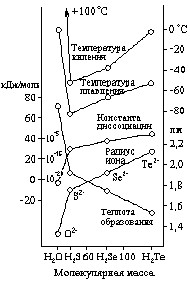
Рис. 3. Свойства водородных соединений элементов VI группы.
Соединения теллура значительно менее ядовиты. В организме они быстро восстанавливаются до элементарного Те, который затем медленно выделяется в виде постепенно образующихся органических производных, обладающих сильнейшим чесночным запасом. Последний появляется после поступления в организм даже ничтожных количеств Те (десятимиллионных долей грамма). Известен случай, когда работавшим с теллуристыми соединениями химикам пришлось на несколько недель выселиться из города, так как исходивший от них запах был невыносим для окружающих. При лечении селеновых и теллуровых отравлений рекомендуется принимать в повышенных дозах витамин С (аскорбиновую кислоту).
Недавно проведенными исследованиями установлено постоянное наличие следов полония в табачном дыме. Оказалось, что с дымом от пачки сигарет человек поглощает такую дозу облучения α-частицами, которая в 4 раза превышает признаваемую безопасной по международному соглашению. Анализ мочи курильщиков показал, что она содержит полония в 6 раз больше, чем у некурящих. Это значит, что полоний циркулирует по организму и может накапливаться (как и продукт его распада — свинец) не только в легких, но и в любом другом органе. Предполагается, что статистически установленная значительно большая частота заболеваний раком курильщиков по сравнению с некурящими обусловлена главным образом именно радиоактивностью полония.
С химической стороны селен и теллур в общем похожи на серу. Из неметаллов они наиболее энергично взаимодействуют с фтором и хлором, а с кислородом соединяются лишь после предварительного нагревания. С газообразным водородом частично реагирует при повышенных температурах только селен, тогда как теллур с ним непосредственно не соединяется. Со многими металлами Se и Te дают при нагревании аналогичные сульфидам селениды и теллуриды (например, K2Se, K2Te).
Действием на них разбавленных кислот могут быть получены селеноводород (H2Se) и теллуроводород (H2Te). Оба они при обычных условиях представляют собой бесцветные газы с неприятными запахами. Растворимость их в воде примерно такая же, как у сероводорода, причем растворы показывают ясно выраженную кислую реакцию. Некоторые свойства рассматриваемых соединений сопоставлены в приводимой ниже таблице и на рис. 3 с аналогичными свойствами H2O и H2S. Для приблизительной ориентировки в размерах соответствующих молекул приведены также радиусы ионов Э2–.
Соединения | Теплота образования, кДж/моль | Температура плавления, °С | Температура кипения, °С | Константа диссоциации K1 | Радиус иона Э2–, пм |
H2O | 68,5 | 0 | 100 | 2·10-16 | 1,32 |
H2S | 5 | –86 | –60 | 1·10-7 | 1,74 |
H2Se | –8 | –66 | –41 | 1·10-4 | 1,91 |
H2Te | –24 | –51 | –2 | 2·10-3 | 2,11 |
Из данных таблицы видно, что H2Se и H2Te являются кислотами более сильными, чем, например, уксусная (К = 2·10-5). По отношению к нагреванию чистый H2Se довольно устойчив, тогда как H2Te легко разлагается на элементы. Кислородом воздуха оба соединения постепенно окисляются и в газообразном состоянии и особенно в растворе уже при обычных температурах. В общем, восстановительные свойства характерны для H2Se и H2Te еще более, чем для сероводорода. Гидрид полония (H2Po) крайне неустойчив.
Отвечающие типичным валентным переходам селена и теллура окислительно-восстановительные потенциалы сопоставлены ниже (верхняя цифра относится к кислой среде, нижняя — к щелочной):
-2 0 +4 +6
Sе -0,40 +0,74 +1,15
-0,92 -0,37 +0,05
Те -0,72 +0.53 +1,02
-1,14 -0,57 +0,4
Для полония наиболее типична валентность +4, менее характерны -2 (полониды) и +2 (известны, в частности, черный РоS и красный РоSO3). Существование валентности +6 установлено, но отвечающие ей производные пока не выделены.
Помимо разложения селенидов, Н2Sе может быть получен пропусканием тока водорода над нагретым до 600 °С селеном. Удобнее получать его нагреванием селена с парафином или действием воды на Аl2Sе3. Образование Н2Те хорошо идет при электролизе сильно охлажденных растворов кислот с теллуровым катодом. Получить его можно также действием 4 н. НСl на Аl2Те3. Термический распад Н2Sе с заметной скоростью идет лишь выше 300 °С, тогда как Н2Те постепенно разлагается уже при обычных температурах. Селенистый водород гораздо более ядовит, чем сероводород. Растворимость его в воде при обычных условиях составляет около 3:1 по объему. Взаимодействие Н2Sе с серой медленно протекает по схеме:
S + Н2Sе = Н2S + Sе
(т. е. аналогично реакции Сl2 + 2 НВr = 2 НСl + Вr2).
По строению молекул Н2Sе и Н2Те подобны Н2S. Для селенистого водорода d(SеН) = 146 пм, ∠НSеН = 91°. Молекула теллуристого водорода изучена хуже. Для нее d(ТеН) = 169 пм, ∠НТеН = 89,5°. Средние энергии связей Sе-Н и Те-Н оцениваются соответственно в 313,5 и 263,3 кДж/моль.
Для селеноводорода (К2 = 1·10-11) известны два ряда солей — кислые и средние, для теллуроводорода (К2 = 1·10-5) — лишь средние. Из них производные наиболее активных одновалентных металлов бесцветны и легкорастворимы в воде. Некоторые относящиеся сюда соли были выделены и в форме кристаллогидратов (например, Nа2Те·9Н2О). Под действием кислорода воздуха растворы их быстро окрашиваются в красноватый цвет вследствие образования аналогичных полисульфидам полиселенидов и полителлуридов. Известны, в частности, Nа2Se6 и Nа2Те6, но производные Sе и Те типа многосернистых водородов не получены. Селениды и теллуриды большинства металлов в воде нерастворимы.
Возможность образования Н2Ро была установлена по радиоактивности газа выделяющегося при обработке соляной кислотой магния, на котором был перед тем осажден полоний. Гидрид полония еще менее стоек, чем Н2Те, из-за чего и не мог быть выделен, но производящиеся от него полониды (Nа2Ро и др.) известны. Теплота образования РоH2 из элементов оценивается в — 188 кДж/моль.
Все галоидные соединения селена и теллура могут быть получены путем взаимодействия элементов. Известны следующие галогениды:
Состав | SeF6 | SeF4 | SeCl4 | Se2Cl2 | SeBr4 | Se2Br2 |
Агрегатное состояние | газ | жидк. | тверд. | жидк. | тверд. | жидк. |
Цвет | бесцв. | бесцв. | бесцв. | коричн. | желт. | красн. |
Состав | ТеF6 | TeF4 | TeCl4 | TeCl2 | TeBr4 | TeBr2 | TeI4 |
Агрегатное состояние | газ | тверд. | тверд. | тверд. | тверд. | тверд. | тверд. |
Цвет | бесцв. | бесцв. | бесцв. | зелен. | оранж. | коричн. | серо-черн. |
Молекулы галогенидов ЭF6 имеют структуры октаэдров с атомом Э в центре (в(SеF) = 169 пм, d(ТеF) = 182 пм). Подобно SF6, гексафторид селена и теллура характеризуются высоким давлением паров в твердом состоянии (т. возг. соответственно -46 и -39 °С). Поэтому их точки плавления ( -35 и -37 °С) могут быть определены лишь под повышенным давлением. Образование обоих соединений из элементов сопровождается значительным выделением тепла (1028 и 1317 кДж/моль).
По своему общему характеру галогениды селена похожи на соответствующие производные серы, причем тип Э2Г2 в данном случае менее, а тип ЭГ4 — более устойчив. Например, Sе2Сl2 даже при осторожном нагревании распадается на Sе и SеСl4, а последний, хотя и возгоняется с разложением на SеСl2 и Сl2, но вновь образуется из них при охлаждении. По строению молекулы SеF4 подобен SF4 с параметрами d(SеF1) = 168, d(SеF2) = 177 пм, ∠F1SеF1 = 100°, ∠F2SеГ2 = 169°. Для SеF4 (т. пл. -10, т. кип. 108 °С), SеСl4 (теплота образования из элементов 188 кДж/мюль, т. возг. 196 °С) и SеВr4 известны двойные соединения с галогенидами (главным образом типа SеГ4·2МГ) и серным ангидридом (например, бесцветный SеСl4·SО3). Описано также соединение состава НgSеF4, образующееся при взаимодействии SеF4 с ртутью. Водой почти все галогениды селена легко разлагаются. Наиболее медленно протекает гидролиз SеF6.
Интересен жидкий при обычных условиях смешанный хлорид серы и селена типа Э2Сl2, который может быть, по-видимому, получен в двух формах — темно-красной (исходя из Sе и S2Сl2) и бледно-оранжевой (исходя из S и Sе2Сl2). Различие обеих форм естественно объяснялось бы их разной структурой: по типу SеSСl2 и SSеСl2. Такая трактовка, предполагающая четырехвалентность центрального атома не соответствует структуре S2Cl2, но находится в хорошем согласии со строением более устойчивой формы S2F2.
Галогениды теллура уже резко отличаются по свойствам от соответствующих производных серы. Тогда как четырехфтористая сера при обычных условиях газообразна, ТеF4 плавится лишь при 130 °С. В отличие от шестифтористой серы ТеF6 довольно легко разлагается водой и способен давать продукты присоединения (известен ТеF6·2СsF). С другой стороны, иодиды серы (и селена) вообще не получены, а черный ТеI4, образуется при совместном растирании элементов в присутствии воды. Теплоты образования ТеСl4 и ТеВr4 из элементов равны соответственно 322 и 196 кДж/моль. Тип Те2Г2 для теллура неизвестен, соединения же, отвечающие типам ТеГ2 и ТеГ4, имеют скорее характер не галогенангидридов, а солей. Водой они разлагаются лишь частично, причем для типа ТеГ2 наряду с гидролизом наблюдается распад по схеме: 2 ТеГ2 = ТеГ4 + Те. Определение пространственного строения ТеВr2 показало, что молекула треугольна (d(ТеВr) = 251 пм, ∠α = 98°).
Некоторые из рассматриваемых соединений не разлагаются ни при своих довольно высоко лежащих точках плавления (ТеСl4 — 224 °С, ТеСl2 — 208 °С, ТеВr4 — 380 °С, ТеВr2 —280 °С), ни при температурах кипения (ТеСl4 — 420 °С, ТеСl2 — 328 °С, ТеВr2 — 340 °C) . Напротив, ТеI4 начинает разлагаться уже выше 100 °С.
Для галогенидов типа ТеГ4 характерно образование продуктов присоединения с соответствующими галоидоводородными кислотами и особенно некоторыми их солями. Наиболее обычные из них отвечают общей формуле вида М2ТеГ6, где М — одновалентный металл (d(ТеСl) = 254, d(ТеВr) = 270 пм). Хлориды имеют желтую окраску, бромиды — оранжевую и иодиды — черную. Для фторидов характерен другой тип — МТеF5 (где М — Сs, Rb, К). Водой эти соли тотчас разлагаются.
Для полония были получены (в миллиграммовых количествах) следующие галогениды:
РoСl4 РoВr4 РoI4 РoСl2 РоВr2
желтый красный черный красный коричневый
Все они представляют собой твердые вещества.
Тетрахлорид плавится около 300 °С и кипит при 390 °С. Известны также двойные соединения типов РоГ4·МГ и РоГ4·2МГ. Для расстояний Ро-Сl и Ро-Вr (в производных второго типа) были найдены значения 238 и 261 пм.
При нагревании в токе воздуха или кислорода селен и теллур сгорают с образованием диоксидов. Обе они представляют собой бесцветные кристаллические вещества, сильно отличающиеся друг от друга по растворимости в воде: у SeO2 она весьма велика, у TeO2 — очень мала.
При получении SеО2 сжиганием селена (сгорающего синим пламенем) воздух или кислород полезно предварительно насытить окислами азота (пропуская его сквозь дымящую НNО3), так как сгорание идет в этом случае гораздо быстрее. Теплота образования диоксида селена из элементов равна 226 кДж/моль, а средняя энергия связи Sе=О оценивается в 426 кДж/моль. Кристаллический селендиоксид образован неплоскими цепями -O-Sе(O)O-Sе(O)- с параметрами d(OSе) = 178, d(SеО) = 173 пм, ∠OSеО = 98°, ∠SеOSе = 125° и при нагревании возгоняется (т. возг. 337 °С, теплота возгонки 92 кДж/моль). Желтовато-зеленый пар SеО2 имеет характерный запах (“гнилой редьки”) и слагается из отдельных молекул (d(SеО) = 161 пм). Сухой диоксид селена легко образует продукты присоединения. Примером может служить жидкий при обычных условиях (и устойчивый до 170 °С, когда он перегоняется с частичным разложением) желтый SеО2·2НС1.
Получение ТеО2 (т. пл. 733, т. кип. 1257 °С) удобнее вести не сжиганием теллура (сгорающего зеленовато-синим пламенем), а окислением его крепкой НNО3. При упаривании или разбавлении водой полученного раствора диоксид теллура осаждается из него в виде бесцветных кристаллов, при нагревании желтеющих. Теплота образования ТеО2 из элементов составляет 322 кДж/моль, а средняя энергия связи Те=О оценивается в 247 кДж/моль. Растворимость теллурдиоксида в воде очень мала, но он растворим в растворах сильных щелочей и кислот (с образованием солей). Так, в 1 н. НСl может быть при 25 °С получен 0,01 М раствор ТеО2. Из характерных для диоксида теллура продуктов присоединения наиболее интересен устойчивый до 300 °С (но тотчас разлагаемый водой) 2ТеО2·НСlO4.
Подобно SO2, диоксиды селена и теллура являются кислотными ангидридами: при растворении их в воде образуются соответственно селенистая (H2SeO3) и теллуристая (H2TeO3) кислоты. Обе они диссоциированы несколько слабее сернистой.
Соли селенистой кислоты (селенистокислые, или селениты) могут быть получены нейтрализацией растворов H2SeO3, соли теллуристой (теллуристокислые, или теллуриты) — растворением TeO2 в щелочах. И селениты, и теллуриты, как правило, бесцветны. По растворимости селениты в общем сходны с соответствующими сульфитами, тогда как из теллуритов хорошо растворимы в воде только производные наиболее активных одновалентных металлов (Na, K и др.).
В то время как для четырёхвалентной серы восстановительные свойства характернее окислительных, для SeIV и TeIV имеет место обратное: они довольно легко восстанавливаются до элементарных Se и Te. Напротив, перевод четырёхвалентных селена и теллура в шестивалентное состояние может быть осуществлён лишь действием наиболее сильных окислителей.
Свободная селенистая кислота (К1 = 2·10-3, K2 = 5·10-9) может быть получена растворением порошкообразного селена в разбавленной НNО3 по реакции:
3 Sе + 4 НNО3 + Н2О = 3 Н2SеО3 + 4 NО
При упаривании раствора она выделяется в виде бесцветного кристаллогидрата, расплывающегося во влажном воздухе и постепенно выветривающегося в сухом. Молекула Н2SеО3 существует только в форме SеО(ОН)2. Она устойчива лишь ниже 70 °С, а выше этой температуры распадается на SеО2 и воду даже в растворе. По другим данным, первичным продуктом термического разложения является Н2Sе2О5.
Окислительные свойства селенистой кислоты выражены не особенно сильно она окисляет SO2 и I-, но не способна окислить Вr-. Ее взаимодействие с КMnO4 протекает по уравнению:
15 Н2SеО3 + 10 КМnO4 = 5 К2SеO4 + 10 Н2SеО4 + 10 МnО2 + 5 Н2О
Из солей Н2SеО3 следует отметить труднорастворимый селенит серебра Аg2SeO3 (ПР = 1·10-15). Ион SеО32- представляет собой трехгранную пирамиду с параметрами: d(SеО) = 169 пм и ∠OSеО = 101°.
Наличие у селенистой кислоты очень слабо выраженной основной функции более отчетливо выявляется при ее взаимодействии с безводной НСO4. Реакция в этих условиях идет по уравнению:
SеО(ОН)2 + НСlO4 = (Sе(ОН)3)СlO4
Образующийся солеобразный продукт содержит пирамидальный катион (Sе(ОН)3)+ и представляет собой бесцветное и очень гигроскопичное кристаллическое вещество (т. пл. 33 °С). Аналогичными свойствами обладает сульфат селенила — (SеО)SO4, который может быть получен взаимодействием SеО2 и SO3 при нагревании (в запаянной трубке). Известен фторсульфонат селенила — SеО(SОзF)2.
Теллуристая кислота получена в виде кристаллогидрата Н2ТеO3·Н2О. Она обладает свойствами амфотерного электролита. Ее кислотная функция (К1 = 2·10-3, К2 = 2·10-8) выражена значительно сильнее основной (К1 = 3·10-11). Последняя проявляется при растворении ТеО2 в концентрированных сильных кислотах — происходит образование солей четырехвалентного теллура, например, по схеме:
ТеО2 + 4 НI = ТеI4 + 2 Н2О
Помимо галогенидов, в твердом состоянии были получены также основные сульфаты и нитраты четырехвалентного теллура.
Окислительные свойства теллуристой кислоты выражены несколько слабее, чем у селенистой. Анион ТеО32- имеет строение треугольной пирамиды с параметрами d(ТеО) = 188 пм, ∠ОТеО) = 100°.
И для селенистой и особенно для теллуристой кислот весьма характерно образование солей типа М2О·nЭО2, причем для селена известны производные с n = 2 и 4, а для теллура — с n = 2, 4 и 6. Аналогичными им соединениями серы являются соли пиросернистой кислоты, в которых n = 2.
Из других производных рассматриваемых элементов в их четырехвалентном состоянии следует отметить оксогалогениды селена. Очень ядовитый SеОСl2 образуется при совместном нагревании SеСl4 и SеО2 и представляет собой желтоватую жидкость (т. пл. 11, т. кип. 178 °С). Он является хорошим растворителем многих веществ, в частности растворяет серу, селен, теллур, бром и иод. Смеси хлористого селенила с SО3 способны растворять многие окcиды металлов (Сr2О3, Аl2O3 и т. д.). Для SеОСl2 довольно характерны окислительные свойства (особенно при нагревании). Водой он разлагается на НСl и селенистую кислоту.
Известны также бесцветный SеОF2 (т. пл. 5, т. кип. 125 °С) и желтый SеОВr2 (т. пл. 42, т. кип. 217 °С с разложением).
Диоксид полония (РоО2) образуется из элементов при 250 °С в виде красных кристаллов (т. возг. 885 °С), постепенно переходящих при хранении в более устойчивую при обычных условиях желтую форму. С химической стороны она аналогична диоксиду теллура, но отвечающая ей гидроксид обладает более основными свойствами. Так, для теллура известны лишь основные соли кислородных кислот, тогда как для полония были получены и средние соли (в частности, бесцветные Ро(SО4)2 и Ро(NО3)4). Напротив, образующиеся при взаимодействии РоО2 или его гидроксида с сильными щелочами соли полонистой кислоты (Н2РоО3) — полониты — гидролизованы значительно сильнее теллуритов ((К2РоО3)/(КОН)2 = 8·10-5).
Такое окисление идет, например, по схеме:
5 H2ЭO3 + 2 HClO3 = 5 H2ЭO4 + Cl2 + H2O.
Образующиеся селеновая (H2SeO4) и теллуровая (H2TeO4) кислоты представляют собой бесцветные кристаллические вещества, хорошо растворимые в воде. Селеновая кислота по силе близка к серной, тогда как теллуровая является кислотой весьма слабой.
Соли селеновой кислоты (селеновокислые, или селенаты) по свойствам похожи на соответствующие сульфаты. Напротив, соли теллуровой кислоты (теллуровокислые, или теллураты) существенно отличаются от них. Например, BaTeO4 выделяется из раствора с кристаллизационной водой и легко растворяется в соляной кислоте. В воде хорошо растворимы лишь теллураты наиболее активных одновалентных металлов.
Обе рассматриваемые кислоты являются сильными окислителями и, например, с HCl взаимодействуют по схеме:
H2ЭO4 + 2 HCl ⇔ H2ЭO3 + Cl2 + H2O.
В кислой среде равновесие смещается вправо, в щелочной — влево.
И для селеновой, и для теллуровой кислот характерна медленность проявления их окислительного действия (особенно — в разбавленных растворах). В ряде случаев окислительно-восстановительный процесс из-за этого практически не протекает. Относительно быстрее других восстановителей окисляются обеими кислотами галоидные ионы (I’, Вr’, Сl’). Селеновая кислота является более сильным окислителем, чем теллуровая.
Свободная селеновая кислота (К2 = 1·10-2) проще всего получается обработкой взвеси Аg2SеО3 бромной водой. Реакция идет по уравнению:
Аg2SеО3 + Вr2 + Н2О = 2 АgВr↓ + Н2SеO4
Осадок АgВr отфильтровывают, а избыток бромида удаляют кипячением жидкости. Упариванием последней в вакууме и кристаллизацией остатка селеновая кислота может быть выделена как в виде кристаллогидрата Н2SеO4·Н2О (т. пл. 26 °С), так и в безводном состоянии (т. пл. 62 °С). Известны также кристаллогидраты селеновой кислоты с 2Н2О (т. пл. -24 °С), 4Н2О (т. пл. -52 °С) и 6Н2О (т. пл. -68 °С).
В расплавленной безводной селеновой кислоте имеет место равновесие по схеме:
2 Н2SеO4 ⇔ Н3О+ + НSе2О7
При нагревании она растворяет не только серебро (как Н2SO4), но и золото. Однако платина в ней не растворяется. Выше 260 °С селеновая кислота переходит в SеО2. Подобно серной, она очень гигроскопична и обугливает многие органические вещества. Сила селеновой кислоты оценивается в 0,9 от серной. Ион SеO42- имеет структуру тетраэдра с расстоянием d(SеО) = 165 пм.
Соли селеновой кислоты легко образуются при действии хлора на щелочные растворы селенитов или сплавлении селенитов с КNО3. Из реакционной смеси обычно выделяют малорастворимый (около 2·10-4 моль/л при обычных условиях) ВаSеО4, обменным разложением которого с сульфатами других металлов можно получать их селенаты. Последние в общем похожи на соответствующие сульфаты, но лучше растворимы в воде и менее устойчивы по отношению к нагреванию.
Производным селеновой кислоты является также имеющий суммарную формулу Sе2О5 селенат селенила — (SеО)SеO4, по способу образования и свойствам аналогичный его сульфату. Удобнее получать это бесцветное кристаллическое вещество выдерживанием расплавленного SеО3 при 170 °С или взаимодействием SеО3 с SеО2 в жидкой SO2. В высоком вакууме он при 145 °С возгоняется без разложения, а выше 185 °С переходит в SеО2.
Свободная теллуровая кислота (К1 = 2·10-8, К2 = 1·10-11, К3 = 3·10-15) может быть получена взаимодействием элементарного теллура с 30 %-ной Н2О2 (при нагревании на водяной бане). Выделяется она в виде бесцветного кристаллогидрата Н2ТеО4·2Н2О. Как и у иодной кислоты водороды воды, входящей в состав этого кристаллогидрата, способны частично или полностью замещаться на металл. Например, известны соли состава Аg6ТеО6 и Нg3ТеО6, отвечающие шестиосновной ортотеллуровой кислоте — Н6ТеО6.
Хотя нагреванием последней при 100÷200 °С может быть получен порошок состава Н2ТеО4, однако эта форма для теллура нехарактерна: все двузамещенные теллураты производятся от ортотеллуровой кислоты. При температурах ниже 10 °С сама она выделяется из раствора в виде кристаллогидрата H6TeO6··4H2O. Структура Н6ТеО6 отвечает правильному октаэдру с теллуром в центре и гидроксильными группами в вершинах. В концентрированных растворах она несколько полимеризована.
Соли теллуровой кислоты удобно получать сплавлением теллуритов с КNО3 (нормальные соли состава М2ТеО3 при 450 °С окисляются уже кислородом воздуха).
Наиболее обычными теллуратами являются довольно малорастворимый Nа2Н4ТеО6 и легкорастворимый К2Н4ТеО6·3Н2О. Шестизамещенная соль натрия (Nа6ТеО6) может быть получена сплавлением Н6ТеО6 с NаОН. На воздухе она постепенно переходит в Nа2H4ТеО6·3Н2О. По данным рентгеноструктурного анализа Нg3ТеО6, ион ТеО66- имеет структуру октаэдра с d(ТеО) = 198 пм.
При нагревании Н6ТеО6 в запаянной трубке до 140 °С образуется аллотеллуровая кислота — вязкая жидкость, полностью смешивающаяся с водой и обладающая ясно выраженными кислотными свойствами. Она представляет собой, по-видимому, раствор смеси полимерных теллуровых кислот. При хранении водного раствора аллотеллуровая кислота постепенно переходит обратно в Н6ТеО6.
Отвечающий селеновой кислоте ангидрид — триоксид селена SeO3 представляет собой бесцветное кристаллическое вещество, хорошо растворимое в воде с образованием селеновой кислоты. Напротив, жёлтый триоксид теллура (TeO3) в воде почти нерастворим. Однако концентрированные растворы сильных щелочей растворяют его с образованием соответствующих теллуратов.
Триоксид селена (т. пл. 121 °С) удобно получать по схеме:
К2SеО4 + SO3 = К2SO4 + SеО3
Теплота его образования из элементов равна 171 кДж/моль. Основной молекулярной формой этого вещества для всех агрегатных состояний является тетрамер (SеО3)4 (рис. 4), в котором атомы селена (d(SеSе) = 313 пм соединены друг с другом кислородными мостиками (d(SеО) = 180 пм) и имеют по два “собственных” атома кислорода (d(SеО) = 156 пм). В парах присутствуют и мономерные молекулы SеО3 (при 120 °C порядка 25 %) с d(SеО) = 169 пм. Расплавленный селентриоксид весьма склонен к переохлаждению, а твердый известен в двух формах (из которых одна нестабильна). Выше 180 °С он разлагается на SеО2 и кислород, но в вакууме может быть возогнан без разложения.
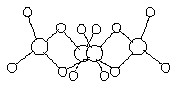
Рис. 4. Схема строения (SeO3)4.
Cелентриоксид обладает настолько сильными окислительными свойствами, что окиcляет НСl до свободного хлора даже при охлаждении. Однако из раствора в жидкой SO2 он может быть выделен без изменения. Избытком серы SеО3 восстанавливается до элементарного селена, а при взаимодействии его с селеном или теллуром образуются зеленые вещества, по-видимому, аналогичные S2O3.
При растворении SеО3 в Н2SеO4 образуются более или менее нестойкие пирокислоты селена — Н2Sе2О7 (т. пл. 19 °С), Н4Sе3О11 (т. пл. 25 °С с разл.).
Триоксид теллура может быть получена обезвоживанием теллуровой кислоты при 300-350 °С. Образующаяся при этом желтая ТеО3 аморфна и крайне малорастворима в холодной воде (примерно 0,5 г/л). Соляную кислоту ТеО3 окисляет лишь при нагревании (в отличие от SеО3).
Длительным выдерживанием ТеО3 при 406 °С был получен светло-желтый оксид состава Те2О5, переходящий в ТеО2 лишь при 485 °С. Он плохо растворим в воде но хорошо растворяется в крепком растворе КОН. Данные магнитного исследования говорят за то, что этот оксид является производным пятивалентного теллура.