Микроэлементы (цинк, железо, марганец) в системе "почва-растение" при возрастающих дозах внесения фосфорных удобрений
Цинк – один из восьми микроэлементов, необходимых для нормального здорового роста и размножения растений; остальными приходятся бор, хлор, медь, железо, марганец, молибден и никель. Эти элементы относятся к «необходимым микроэлементам», так как они требуются в сравнительно малых количествах для растительных тканей (5 – 100 мг/кг). Некоторые из этих элементов, а именно: медь, железо, марганец и цинк, вдобавок с кобальтом, хромом, йодом и селеном, являются также необходимыми для животных.
Цинковое голодание нарушает углеводный обмен у растений, процесс образования хлорофилла, изменение морфологических признаков растения (в частности, образование розеточности - побегов с укороченными междоузлиями и мелкими листьями) (Минеев, 2004).
Основным источником цинка для растений является почва. Элемент легко адсорбируется как минералами, так и органическими компонентами, поэтому в большинстве типов почв наблюдается его аккумуляция в поверхностных горизонтах (Ермохин, Синдирёва, Трубина, 2002). Недостаток цинка в почвах приводит к нарушению обмена веществ, снижению продуктивности растений и качества их продукции.
Причинами дефицита цинка могут служить низкие природные концентрации доступного растениям цинка в почвах, которые связаны:
- с низким валовым содержанием элемента в почвах;
- с факторами, обуславливающими низкую подвижность металла в почвах (высокое содержание гидроксидов железа, карбонатов, органических соединений, фосфатов). Так же отрицательно на подвижность в почвах и поступление цинка в растения влияют фосфаты почвы.
По данным А. Н. Аристархова (2000), 95.5% от площади 44 млн. га плодородных почв страны содержат недостаточное количество подвижных форм Zn.
Поскольку фосфор – один из главных элементов питания растений и постоянно вносится в возделываемую почву, его взаимодействие с цинком, как в самой почве, так и в растениях, становится одной из основных причин дефицита цинка в последних.
По данным ВНИИА на 1 января 2005 года пахотные почвы России характеризуются в основном средней обеспеченностью подвижным фосфором.Доля пахотных почв со средним и повышенным содержанием подвижного фосфора составляет 57.0% от обследованной площади. Вместе с тем, ещё имеются отдельные регионы, где преобладают почвы с низким содержанием подвижного фосфора. Всего пахотных почв с низким содержанием подвижного фосфора было 23.0 млн. га, что составляет 21.5% от обследованной площади.
Все субъекты Северо-Западного округа (кроме Вологодской области), где преобладают дерново-подзолистые почвы, имеют значительные пахотные площади с высоким и очень высоким содержанием подвижного фосфора (от 40.2% в Псковской области до 82.4% в Республике Карелия). В Центральном округе только 3 субъекта имеют более 40% таких почв (Московская область - 76.0%, Брянская - 62.0%, Тверская 47.3%).
Казалось бы, что в последнее время изучение проблем, связанных с интенсивным применением минеральных удобрений в нашей стране, не вполне актуально. Однако даже при общем резком снижении уровня применения минеральных удобрений, остались регионы (Кубань, Татарстан), где применение удобрений сохранилось на прежнем уровне. По данным Бакирова (2009) на 90-е годы ХХ века (когда в большинстве регионов удобрения не применяли) приходился пик применения удобрений в Татарстане – до 130 кг д.в. на га.
В 13 субъектах России одновременно с сокращением площадей пахотных почв с высоким содержанием подвижного фосфора увеличиваются площади с очень низким и низким содержанием. В общей сложности по 27 субъектам площадь пахотных почв с низкой обеспеченностью фосфором увеличилась на 478.7 тыс. га.
Около 30% территорий мира, занятых под сельское хозяйство, обладают почвами с низкой доступностью для растений железа (Chen, Barak, 1982) и около 50% территорий, используемых для выращивания зерновых культур, - низкой доступностью цинка (Graham, Welch, 1996).
Состояние в почвах и обеспеченность растений цинком, марганцем и железом зависит от уровня фосфатов в почве, от доз внесения фосфорных удобрений. Наиболее часто встречающаяся ситуация (по данным Аристархова) – недостаточное количество цинка, обуславливающее дефицит его в растениях. По тем же данным, даже на хорошо обеспеченных подвижными формами цинка почвах при интенсивном ведении сельскохозяйственного производства рекомендуется применять цинковые микроудобрения. В существующих градациях по обеспеченности почв к группе высоко обеспеченных относятся почвы, содержащие более 5 мг/кг наиболее мобильных соединений элемента. Верхняя граница допустимого количества – ПДК, равная 23 мг/кг. Большинство исследователей изучает состояние цинка в системе почва-растение либо при выраженной недостаточности цинка в почвах, либо при моделировании его загрязнения в единицах, кратных ПДК. Диапазон значений содержания цинка в почве от 5 до 23 мг/кг, как правило, выпадает. Однако, при попадании концентрации цинка в этот диапазон возможно проявление его фитотоксического действия, особенно на чувствительные культуры, что может служить поводом для пересмотра существующих ПДК.
В связи с этим, целью работы послужило изучение состояния цинка, железа и марганца в дерново-подзолистой высоко обеспеченной элементом почве и их накопления растениями ячменя при внесении возрастающих доз фосфорных удобрений.
Задачами работы стали:
· оценка влияния возрастающих доз фосфорных удобрений на агрохимическую характеристику дерново-подзолистой почвы
· оценка состояния цинка, железа и марганца в почве опыта (валовое содержание и подвижные формы)
· изучение эффективности цинковых микроудобрений для ячменя на высоко обеспеченных элементом и фосфатами почвах
· изучение эффективности возрастающих доз фосфорных удобрений для растений ячменя на высоко обеспеченной цинком и фосфатами почве
· оценка накопления микро- и макроэлементов растениями ячменя на высоко обеспеченной цинком и фосфатами почве
· изучение влияния возрастающих доз фосфорных удобрений и Zn-микроудобрения на содержание Zn, Fe, Mn, P и N в растениях ячменя.
Глава 1.Обзор литературы
1.1 Металлы в почве
1.1.1. Цинк
Основным источником цинка в почве являются материнские породы. Дополнительными источниками служат атмосферные осадки (пыль и аэрозоли – коллоидные частицы в сухом состоянии или с дождями) и агрохимические средства (удобрение, известкование). Почвы на речных поймах получают микроэлементы из потока воды и оседающих частиц. Все из этих источников могут сильно отличаться по значимости и приводить к тому, что в почвах будут широкие диапазоны содержания микроэлементов. Пространства в почве, в которых сконцентрирован цинк, доступный для корней растений или миграционноспособный, определяются рядом почвенных свойств (Alloway, 2004).
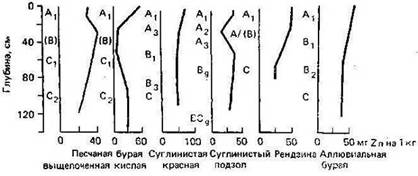
Рисунок 1
При растворении минералов Zn в процессе выветривания образуется подвижный ион Zn2+, особенно в кислых окислительных средах. Однако Zn легко адсорбируется как минералами, так и органическими компонентами, поэтому в большинстве типов почв наблюдается его аккумуляция в поверхностных горизонтах (рис.) (Кабата-Пендиас, Пендиас, 1989).
Дополнительный приход цинка в почву возможен в зонах воздействия различных промышленных производств (Софронов, 2003). Как отмечают И. И. Судницын и И. И. Сашина, загрязнение почв веществами, содержащими цинк, систематически происходит вблизи автомагистралей. С дождевыми осадками и ветром мелкие частицы, содержащие цинк, могут переноситься на различные расстояния и оседать на поверхности почвы, листьях растений. Затем (в процессах реакций обмена и замещения, адсорбции, аккумуляции, миграции) происходит поглощение цинка растениями либо его накопление в почве и перемещение вниз по профилю. Накопление происходит в виде гидроксидов, карбонатов, сульфидов и органических комплексов. Однако кислотность среды способствует растворимости цинка, и при высокой концентрации его подвижные формы выщелачиваются, что приводит к дефициту цинка для растений. Органическое вещество способно связывать цинк в устойчивые формы, вследствие чего он накапливается в верхних горизонтах культурных и органогенных почв (Судницын, Сашина, 2006).
По обобщённым данным А. Кабата-Пендиас и Х. Пендиаса (1989), средние содержания Zn в поверхностных слоях почв различных стран изменяются в пределах 17—125 мг/кг. Эти значения могут рассматриваться как фоновые содержания Zn. Наибольшие средние величины установлены для некоторых аллювиальных почв, солончаков и каштанозёмов, а наиболее низкие — для светлых минеральных и органических почв. Баланс Zn в поверхностных слоях почв в различных экосистемах показывает, что атмосферное поступление этого металла превышает его вынос за счет выщелачивания и образования биомассы.
Основной и наиболее подвижной формой Zn в почвах считается Zn2+, однако в почвах могут присутствовать и некоторые другие ионные формы (рис.2) (Кабата-Пендиас, Пендиас, 1989)
Рисунок 2
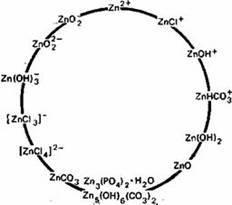
Цинк наиболее подвижен и биологически доступен в кислых легких минеральных почвах. Как установлено Норришем (цитировано по Кабата-Пендиас, Пендиасу, 1989), фракция Zn, связанная с оксидами Fe и Mn, по-видимому, более доступна растениям. Растворимость и доступность Zn в почвах обнаруживают отрицательную корреляцию со степенью насыщенности кальцием и с содержанием соединений фосфора. Эти соотношения могут отражать как влияние адсорбции и осаждения, так и взаимодействие между этими элементами. Кроме того, в области высоких значений pH необходимо учитывать влияние на растворимость и доступность Zn, образования растворимых Zn-органических комплексов и комплексных анионных форм Zn (рис.3).
Однако твёрдой и жидкой фазами почв может осуществляться иммобилизация цинка в процессах изоморфного замещения ионов в первичных и вторичных минералах, образования труднорастворимых соединений элемента, специфической адсорбции его органическими и неорганическими компонентами почвы с образованием прочных связей координационного типа, окклюзии оксидами и гидроксидами железа, алюминия, марганца и кремния, поглощения и включения в состав тканей живой фазы почвы (Переломов, Пинский, 2005). Как отмечает И. Г. Юлушев (1999), недостаток цинка возможен в первую очередь на карбонатных почвах.
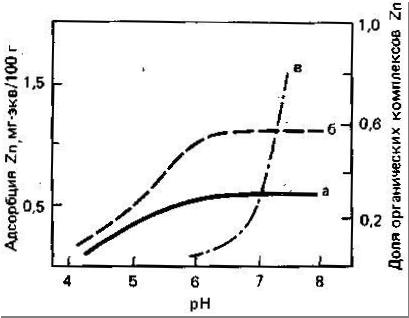 |
Рисунок 3
Расчёт факторов биологической доступности и коэффициента биологического поглощения в работе Л. В. Переломова и Д. Л. Пинского (2005) показал, что способность почв прочно связывать цинк играет важную роль в доступности металла растениям. Несмотря на увеличение потенциальной доступности цинка с ростом дозы вносимого элемента, относительные показатели поглощения металла растениями в целом максимальны в контрольных вариантах, при концентрациях, к которым растения эволюционно адаптированы. Это также свидетельствует о том, что растение поглощает цинк не только из подвижных, но и из прочносвязанных форм металла. По данным Стивенсона и Ардакани (Stevenson, Ardakani, 1972), такие прочносвязанные формы образуют распространённые в почвенном растворе алифатические и ароматические кислоты.
В своей работе А. Ю. Кудеярова (2005) отмечает, что способность почвы связывать поступающие извне соединения цинка в основном определяется реакциями координации, которые происходят на поверхностях раздела твёрдых и жидких фаз (сорбент – почвенный раствор). Как правило, химическое связывание (хемосорбция) экзогенных соединений осуществляется на поверхностях, представленных металлогумусовыми комплексами, которые способны связывать катионы и анионы почвенного раствора. Большой вклад в связывание катионов цинка вносят железогумусовые комплексы, свойственные кислым почвам.
По данным Я. В. Пейве (цитировано по Минееву, 2004), почвы по обеспечённости их подвижным цинком делятся на следующие группы (мг/кг почвы):
<0.2 – очень бедные,
0.3 – 1.0 – бедные,
1.1 – 3.0 – среднеобеспеченные,
3.1 – 5.0 – богатые,
>5.1 – очень богатые.
Эта группировка почв ориентировочная и должна уточняться в конкретных почвенно-климатических условиях путём закладки полевых опытов.
1.1.2 Железо
Железо – один из главных компонентов литосферы и составляет приблизительно 5% её массы (Кабата-Пендиас, Пендиас, 1989). Поведение железа в окружающей среде во многом определяется его способностью легко изменять валентность в зависимости от физико-химических условий среды и тесно связано с геохимическими циклами кислорода, серы и углерода. Как правило, сообщают Кабата-Пендиас и Пендиас (1989), окислительные и щелочные условия среды способствуют осаждению железа, а кислые и восстановительные – растворению его соединений. Свободное железо фиксируется, образуя оксиды и гидроксиды, органо-комплексы и замещая магний и алюминий в минералах.
В почвах железо присутствует главным образом в виде оксидов и гидроксидов, находящихся в форме небольших частиц или связанных с поверхностью некоторых минералов. Однако в богатых органическим веществом горизонтах Fe находится преимущественно в хелатной форме. По данным А. Кабата-Пендиас и Х. Пендиаса (1989), микроорганизмы также могут принимать участие в преобразовании железа, вовлекаясь в круговорот элемента и аккумулируя его на поверхности живых клеток.
В растворении почвенного железа участвуют многие реакции, но наиболее значимыми из них являются гидролиз и процессы комплексообразования. По данным В. Л. Линдсея (цитировано по Кабата-Пендиас, Пендиасу, 1989), подвижность железа в почвах во многом определяется растворимостью аморфных водных оксидов Fe3+ и Fe2+. Однако на растворимость железа может существенно влиять образование других его соединений, таких, как фосфаты, сульфиды и карбонаты.
Минимальные содержания растворимого железа отмечаются при щелочных значениях pH. Поэтому кислые почвы более обогащены растворимым неорганическим железом, нежели нейтральные и щелочные (Кабата-Пендиас, Пендиас, 1989). Таким образом, катионы Fe2+ в кислых анаэробных почвах могут достигать токсичных для растений уровней, а в щелочных хорошо аэрируемых почвах низкие концентрации растворимого железа не могут удовлетворить потребности растений в этом элементе.
Подобно соединениям марганца, соединения железа активно влияют на поведение некоторых элементов питания и многих микроэлементов. Степень ответственности железа за растворимость микроэлементов и их доступность для растений во многом зависят от некоторых почвенных факторов.
Для почвенного железа характерно сильное сродство к подвижным органическим комплексам и хелатам. Эти соединения ответственны за миграцию и перераспределение железа в почвенных горизонтах, а также выщелачивание его из почвенных профилей. Кроме того, комплексные соединения играют большую роль в обеспечении железом корневых систем растений (Кабата-Пендиас, Пендиас, 1989).
Количество железа в почвах определяется как составом материнских пород, так и характером почвенных процессов. Как правило, сообщают Кабата-Пендиас и Пендиас (1989), содержание железа изменяется от 0.5 до 5%. На бедных железом почвах не отмечается его абсолютного дефицита для растений, а фиксируется лишь недостаток его легкорастворимых форм.
1.1.3 Марганец
Марганец – один из наиболее распространённых микроэлементов в литосфере, его содержание в горных породах изменяется в пределах 350 – 2000 мг/кг (Кабата-Пендиас, Пендиас, 1989).
Марганец образует ряд минералов, в которых он обычно присутствует в виде ионов Mn2+, Mn3+ и Mn4+, однако наиболее распространённым в породообразующих силикатных минералах является его окисленное состояние +2. Катион Mn2+ обладает способностью замещать двухвалентные катионы некоторых элементов (Fe2+, Mg2+) в силикатах и оксидах (Кабата-Пендиас, Пендиас, 1989). При выветривании в атмосферных условиях соединения марганца окисляются, а образующиеся при этом оксиды вновь осаждаются и формируют вторичные минералы. Поведение марганца в почвах исключительно сложное и зависит от различных факторов, из которых наибольшее значение имеют pH и Eh среды.
Маккензи (цитировано по Кабата-Пендиас, Пендиасу, 1989) отметил, что Mn распространён в почвах в виде оксидов и гидроксидов, осаждённых как на почвенных частицах, так и в виде конкреций различного диаметра, способных концентрировать железо и некоторые другие микроэлементы почв.
Значение соединений марганца для состояния почв очень велико, поскольку этот элемент не только жизненно необходим растениям, но и контролирует поведение ряда других питательных микроэлементов. Соединения марганца способны быстро окисляться и восстанавливаться в изменчивых условиях почвенной среды. Следовательно, окислительные условия могут заметно снижать доступность марганца и связанных с ним питательных веществ, тогда как восстановительные способствуют увеличению их доступности для растений даже до токсичных значений. (Кабата-Пендиас, Пендиас, 1989).
Растворимость марганца в почвах зависит от pH и Eh среды, поэтому наиболее распространёнными являются реакции окисления-восстановления и гидролиза (Кабата-Пендиас, Пендиас, 1989). Из-за низкой растворимости соединений марганца в окислительных условиях при значении pH, близких к нейтральным, даже незначительные изменения Eh – pH могут оказать существенное влияние на содержание элемента в почвенном растворе.
С помощью экстрагирующих растворителей установлено (Кабата-Пендиас, Пендиас, 1989), что наиболее активно поглощаются растениями водорастворимые, способные к обмену и легко восстанавливаемые формы марганца.
Растворимые формы марганца имеют важно е экологическое значение, поскольку его содержание в растениях определяется пулом растворимого в почвах Mn (Кабата-Пендиас, Пендиас, 1989). В хорошо дренируемых почвах растворимость Mn всегда возрастает с увеличением кислотности почв. Однако способность марганца образовывать анионные комплексы и комплексы с органическими лигандами может приводить к увеличению его растворимости и в щелочных условиях.
Распределение марганца в почвенной толще весьма неоднородно. Марганец может накапливаться в различных почвенных горизонтах, особенно в обогащённых оксидами и гидроксидами железа, однако обычно элемент аккумулируется в верхнем слое почв за счёт фиксации органическим веществом (Кабата-Пендиас, Пендиас, 1989).
По данным А. Кабата-Пендиас и Х. Пендиаса (1989), содержание марганца в почвах Мира изменяется от 10 до 9000 мг/кг, а общее среднее оценивается в 545 мг/кг.
1.2 Микроэлементы в растениях
1.2.1 Цинк
Форма поступления Zn в корни растений точно не установлена. Однако в целом мнения сходятся на том, что преобладает поглощение иона Zn2+ и гидратированных форм Zn. А. Д. Халворсен и В. Л. Линдсей (цитировано по Кабата-Пендиас, Х. Пендиасу, 1989) пришли к заключению, что корни кукурузы поглощают только Zn2+ и что даже очень низкие концентрации этого иона достаточны для развития растений.
Среднее содержание цинка в растениях – 0.002%.
В растениях цинк не участвует в окислительно-восстановительных реакциях, поскольку не меняет степень окисления. Он входит в состав более 30 ферментов, в т. ч. фосфатазы, карбоангидразы, алкогольдегидрогеназа, РНК-полимераза и др. Карбоангидраза катализирует разложение гидрата окиси углерода на воду и углекислый газ. Эта реакция важна для процесса фотосинтеза. Фермент карбоангидраза, катализируя высвобождение CO, из гидрата окиси углерода, способствует его использованию в процессе фотосинтеза. Кроме того, цинк активирует такие ферменты, как енолаза, альдолаза, гексокиназа, триозофосфатдегидрогеназа. В этой связи понятно значение цинка для процессов дыхания и фотосинтеза.
Цинк играет важную роль при образованиифитогормона ауксина. Это связано с тем, что цинк, повышая активность триптофансинтетазы, влияет на образование аминокислоты триптофана — предшественника ауксина. Внесение цинка повышает содержание ауксинов и заметно сказывается на темпах роста растений. При дефиците цинка возрастает проницаемость мембран, что свидетельствует о роли этого элемента в структуре мембран, в поддержании их интеграции.
Цинк влияет на белковый синтез, на активность РНКазы. Обнаружены белки, содержащие цинк и участвующие в репликации ДНК и транскрипции. Цинк входит в состав одного из факторов регуляции транскрипции в соединении с остатками гистидина и цистеина («цинковые пальцы») (Якушина, Бахтенко, 2005).
Кочиан (Kochian, цитировано по Alloway, 2004) предложил, что перемещение цинка через плазматическую мембрану направлен мощным отрицательным зарядом, и, следовательно, этот процесс термодинамически пассивен. Этот отрицательный заряд плазматической мембраны движет цинк во множестве потоков дивалентных катионов в двудольных и однодольных за исключением злаков. Кочиан (Kochian, цитировано по Alloway, 2004) предположил, что безбелковые аминокислоты, именуемые «фитосидерофорами» или «фитометаллофорами», создают комплексное соединение с цинком и выводят его на поверхность плазматической мембраны корневой клетки. Эти фитосидерофоры выделяются из корней в результате дефицита железа и цинка. Получившийся комплекс в дальнейшем транспортируется в клетку с помощью белка-транспортёра.
Цинк поглощается в форме Zn2+ или Zn(OH)2 при высоких значениях pH. По причине низкой концентрации цинка в почвенном растворе поглощение происходит преимущественно через прямой корневой контакт, и оно метаболически контролируемо. Пространственные взаимодействия возможны между поглотительными процессами цинка и других микроэлементов, например цинк – медь, которые обоюдно задерживают друг друга, указывая на то, что они оба абсорбированы по одинаковому механизму транспортных узлов. Рис с цинковым дефицитом показывает повышенное впитывание кадмия, но количество перемещённого цинка в надземные органы оказывается значительно выше количества кадмия в этих органах. Добавление цинка в пропитанные водой почвы выявило увеличение количества экстрагируемого диэтилентриаминпентауксусной кислотой марганца и уменьшение поступления и перемещения меди, железа и фосфора (Alloway, 2004)
Чодри и Лонераган (Chaudry, Loneragan) сообщают, что щелочноземельные катионы неконкурирующе задерживают абсорбцию цинка (по значимости: Mg2+ > Ba2+ > Sr2+ = Ca2+) (цитировано по Alloway, 2004).
Растворимые формы Zn доступны для растений, и, по имеющимся данным А. Кабата-Пендиас и Х. Пендиаса (1989), потребление Zn линейно возрастает повышением его концентрации в питающем растворе и в почвах (рис.4).
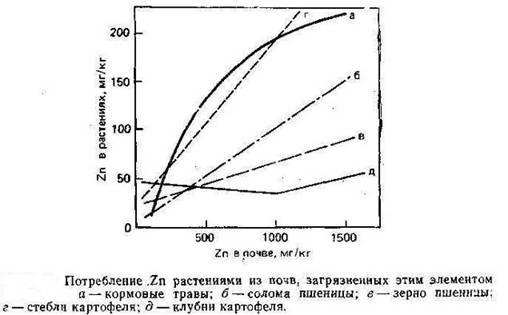
Рисунок 4
Скорость поглощения Zn сильно колеблется в зависимости от вида растений и условий среды роста. Большое значение имеет состав питающего раствора, в особенности присутствие Ca. По вопросу о том, является ли потребление Zn активным или пассивным процессом, существуют разногласия. При всей дискуссионности результаты явно свидетельствуют о том, что потребление Zn контролируется метаболизмом растений, но может участвовать и неметаболический процесс.
По мнению А. Кабата-Пендиас и Х. Пендиаса (1989), связывание Zn низкомолекулярными органическими соединениями в соках ксилемы и в экстрактах из других растительных тканей может означать, что он очень подвижен в растениях. Доля Zn, связанного в комплексы с отрицательным зарядом, составляет более половины его общего содержания в растениях.
Некоторые авторы считают Zn очень подвижным элементом, другие же полагают, что он обладает умеренной подвижностью (Кабата-Пендиас, Х. Пендиас, 1989). В действительности, при оптимальном поступлении Zn некоторые виды растений перемещают заметные количества этого элемента из старых листьев в генеративные органы, но в условиях дефицита Zn эти же виды мобилизовали только небольшие количества или вообще не мобилизовали цинк из старых листьев.
Корневые системы часто содержат гораздо больше Zn, чем надземные части, в особенности, если растение выросло на почве, богатой Zn. При оптимальном уровне содержания Zn в почве этот элемент может перемещаться из корней и накапливаться в верхних частях растений. По опубликованным данным Zn концентрируется в хлоропластах. У некоторых видов это особенно заметно, например у шпината. Цинк, вероятно, накапливается также в жидкости, заполняющей вакуоли, и в клеточных мембранах (Кабата-Пендиас, Пендиас, 1989).
Намбиар (Nambiar, цитировано по Alloway, 2004) показал, что растения могут получать цинк из сухой почвы с помощью выделенного клейкого вещества, но результаты подобного питания составляют лишь 40% от результатов питания во влажной почве. Как отмечают Лавадо, Поркелли и Альварес (Lavado, Porcelli, Alvarez, 1998), в их опыте экстрагируемая концентрация и стратификация цинка были связаны с органическим веществом и pH.
Растительные виды и разновидности сильно различаются по чувствительности к дефициту Zn. Хотя такой дефицит относительно обычен, установить его довольно сложно. Наилучший диагноз получается при совместном использовании визуальных симптомов, анализов химического состава растений и почвенных тестов. Следует отметить, что для ряда культур и почв два экстрагента-хелатообразователя (ДТПА и ЭДТА) дают линейную зависимость между содержанием Zn в растении и запасом его растворимых форм в почве (Кабата-Пендиас, Пендиас, 1989).
Согласно Намбиару и Мотирамани (цитировано по Кабата-Пендиас, Пендиасу, 1989), при использовании для предсказания дефицита цинка содержаний его в тканях часто получаются неверные результаты, тогда как отношение Fe/Zn в тканях представляется более перспективным для предсказания даже скрытого дефицита Zn. Критическое значение отношения Fe к Zn в кукурузе составляет примерно 0,6. Линдсей (цитировано по Кабата-Пендиас и Х. Пендиасу, 1989) опубликовал обзор данных о проявлениях дефицита Zn и его распространении на Земле. Согласно этому автору, наиболее важными факторами, участвующими в создании дефицита цинка, являются:
1) низкое содержание Zn в почве;
2) карбонатность почв и значения pH больше 7;
3) низкие содержания органических веществ в почве;
4) слабая микробиологическая активация Zn в почве;
5) ограниченное поглощение Zn корнями, вызванное сужением зоны развития корневых систем и холодными весенними сезонами;
6) различия свойств видов и генотипов растений;
7) антагонистические эффекты.
Внесение цинка в почву снижает концентрации Fe, Mn и Cu в растениях и повышает содержание цинка. Обогащение зерна Zn, Fe и Mn (в сбалансированном соотношении) благоприятно для здоровья человека. Однако, как сообщает Ареф (Aref, цитировано по Zhu и др., 2007), при стрессе от дефицита цинка растения абсорбируют большие количества Fe и Mn, усугубляя неблагоприятный эффект дефицита.
Несмотря на то, что дефицит цинка известен как наносящий вред широкому ряду злаков в разных частях Света, генотипические отличия между хлебами делают некоторые виды более восприимчивыми к дефициту, чем остальные (табл.1). Отдельно от внешних отличий существуют также важные внутренние, которые могут быть в некоторых случаях более значимыми, чем просто различия между видами. На примере пшеницы, твёрдая пшеница (Triticum durum) более устойчива к нехватке цинка, чем мягкая (Triticum aestivum). Однако имеются важные сортовые отличия в обоих видах пшеницы (Alloway, 2004).
Сорта хлебов, пшеницы или риса, которые, как выяснилось, более толерантны к нехватке цинка, были описаны как рационально расходующие цинк.
Из таблицы видно, что кукуруза, рис и бобовые культуры наиболее чувствительны к нехватке цинка, и только пшеница имеет низкий показатель. Тем не менее, пшеница во многих местах на Земле подвержена цинковому дефициту, несмотря на врождённую низкую восприимчивость к недостатку в сравнении с кукурузой и подобными. Цинковая недостаточность, до сих пор, - главная проблема пшеницы. Если кукуруза или бобовые росли на той же почве, что и пшеница, они, скорее всего, будут жёстко поражены. Следовательно, градацию из таблицы можно использовать для сравнения чувствительностей к недостатку и откликов на цинковые удобрения, но не для определения пределов поражения этих злаков цинковым дефицитом в разных районах мира (Alloway, 2004).
Таблица 1. Врождённая чувствительность к дефициту цинка (Alloway. 2004)
| высокая | средняя | низкая |
| бобовые | ячмень | люцерна |
| цитрусовые | хлопчатник | спаржа |
| лён | салат-латук | морковь |
| фруктовые деревья (лиственные) | картофель | клевер |
| виноград | соя | петрушка, укроп |
| хмель | сахарный тростник | овёс |
| кукуруза | суданская трава | горох |
| луковичные | свёкла | рожь |
| орех пекан | томат | пшеница |
| рис | ||
| сорго | ||
| сладкая кукуруза |
Браун и Джонс (Brown, Jones, цитировано по Alloway, 2004) отметили в своей статье, что отклик растения на микроэлементный стресс – генетически контролируемая адаптация. Сложные механизмы могут содержать способность впитывания питательных веществ в количестве ниже оптимума, мобилизировать элементы в почве с помощью секреции корневых выделений и усиливать их впитывание корнями и перемещать впитанные вещества внутри растения. Грэм и др. (Graham et al., цитировано по Alloway, 2004) сообщили, что в пшенице, ячмене и овсе могут быть обнаружены различные вариации цинковой усвояемости. Это качество может быть плохо связано с усвояемостями других микроэлементов, таких как марганец, который вызывает независимый механизм и генетический контроль цинковой продуктивности. Работая с различными типами почв в Южной Австралии, они обнаружили, что характерные черты цинковой усвояемости в бедных питательными веществами песчаных и в богатых ими глинистых почвах были генетически различными. Генотипы цинковой усвояемости обуславливают потребление большего количества цинка из дефицитных почв, производят больше сухого вещества и больше урожая зерна, но не обязательно имеют высокие концентрации цинка в листьях или зёрнах. Высокое содержание цинка в зёрнах выглядит генетически контролируемым, но не связано напрямую с цинковой усвояемостью. Оно же влияет на развитие побега и важно для человеческих диет, основанных на крупах (Alloway, 2004).
Известно, что некоторые виды и генотипы обладают большой толерантностью к Zn и большой способностью к селективному поглощению его из почв. Таким образом, по данным Е. А. Софронова (2003), овёс концентрирует цинк и имеет значительные коэффициенты биоаккумуляции его в зерне (от 4.9 до 11.7) и соломе (в большинстве >1.0).
Изменения содержания Zn в среде роста обычно отражаются на составе растений, поэтому растения — хороший индикатор для биогеохимических исследований. Некоторые генотипы, растущие на богатых цинком почвах или в областях с большим его поступлением из атмосферы, могут накапливать экстремально высокие количества этого элемента без видимых симптомов токсикоза. Выносливые виды могут ослаблять действие избыточных концентраций Zn либо путем метаболической адаптации и комплексообразования, либо путем ограничения присутствия элемента в клетках, либо переводя его в нерастворимую форму в запасающих тканях (А. Кабата-Пендиас, Х. Пендиас, 1989).
Большинство растительных видов и генотипов обладает высокой толерантностью к избыточным количествам цинка. Обычные симптомы токсикоза Zn — хлороз, особенно у молодых листьев, и ослабление роста растений.
Цинк не считается сильно фитотоксичным. Предел токсичности Zn зависит как от видовой принадлежности и генотипа растения, так и от стадии развития. Например, есть данные, что 300 мг Zn на 1 кг почвы ядовиты для молодого ячменя, в то время как для овса в начале стадии кущения токсичны примерно 400 мг/кг. В тканях корней, где Zn иммобилизован в стенках клеток или связан в комплексы с неспособными к диффузии протеинами, его критические концентрации гораздо выше (А. Кабата-Пендиас, Х. Пендиас, 1989).
Ренджел (Rengel, цитировано по Alloway, 2004) суммировал различные возможные механизмы улучшения поглощения цинка и его перераспределения в растении:
1) большее равномерное распределение длинных, тонких корней (<0.2 мм в диаметре),
2) характеристические изменения в химии и биологии ризосферы, включая внушительное выделение хелатов – фитосидерофоров,
3) повышенное впитывание, приводящее к увеличению роста аккумуляции цинка,
4) более продуктивная утилизация и компартментализация цинка внутри клеток, тканей и органов, в