Нарушение экспрессии D-глюкуронил С5-эпимеразы как возможная причина изменения структуры протеогликанов в опухоли молочной железы человека
1.1 Протеогликаны
1.2 Отличие протеогликанов от гликопротеинов
1.3 Классификация протеогликанов
1.4 Строение и классификация гликозаминогликанов
1.5 Присоединение цепей ГАГ к коровому белку
1.7 Хондроитинсульфат протеогликаны
1.8 Дерматансульфат протеогликаны
1.9 Гепарансульфат протеогликаны и гепарин
1.10 Кератансульфат протеогликаны
1.11 Биосинтез протеогликанов
1.13 Локализация и функции протеогликанов
1.14 Состав протеогликанов в трансформированных клетках
1.14.1 Декорин
1.14.2 D-глюкуронил С5-эпимераза
Глава 2. Материалы и методы
2.1.1 Операционный материал
2.2 Методы
2.2.1 Выделение протеогликанов
2.2.2 Очистка препаратов протеогликанов от примесей нуклеиновых кислот
2.2.3 Идентификация протеогликанов
2.2.4 Аналитические методы
2.2.6 Электрофорез
Глава 3. Результаты и обсуждение
3.1 Выделение протеогликанов
3.2 Отработка условий проведения электрофореза протеогликанов в агарозном геле
3.3 Очистка препаратов протеогликанов от примесей нуклеиновых кислот
3.3.1 Обработка препаратов протеогликанов щелочью
3.3.2 Обработка препаратов протеогликанов нуклеазами
3.4 Сравнение состава протеогликанов в контрольной и опухолевой ткани молочной железы человека
3.5 Количественная оценка протеогликанов
3.6 Идентификация фракций протеогликанов
3.6.1 Обработка препаратов протеогликанов специфическими ферментами
3.6.2 Обработка препаратов протеогликанов азотистой кислотой
3.7 Определение экспрессии декорина в контрольной и опухолевой ткани молочной железы человека
Заключение
Список сокращений
АТ - антитела
ВКМ - внеклеточный матрикс
ГАГ - гликозаминогликаны
ГС - гепарансульфат
Ге - гепарин
ГК - гиалуроновая кислота
ДС - дерматансульфат
КС - кератансульфат
НК - нуклеиновые кислоты
ПААГ - полиакриламидный гель
ПГ - протеогликаны
ПЦР - полимеразная цепная реакция
ХС - хондроитинсульфат
Эпимераза - D-глюкуронил С5-эпимераза
Ac - ацетил
Gal - галактоза
GalN - галактозамин
GlcN - глюкозамин
GlcUA - глюкуроновая кислота
IdoUA - идуроновая кислота
Fuc - фукоза
Man - манноза
SA - сиаловая кислота
Xyl - ксилоза
Введение
Проблема регуляции клеточной пролиферации является одной из ключевых проблем биологии. Нарушения в регуляции деления клеток приводят к изменению их митотической активности, что влечет за собой возникновение различных патологических состояний, в том числе злокачественную трансформацию.
В регуляции клеточного деления принимают участие различные биологические молекулы, в том числе и сложные белково-углеводные молекулы - протеогликаны.
Известно, что определенные представители протеогликанов обладают антимитотической активностью. В нашей группе было показано, что состав и количество протеогликанов в трансформированных клетках меняется. В опухолевых тканях, наряду с общим увеличением количества протеогликанов, снижается содержание дерматансульфат протеогликанов, характерных для покоящихся клеток, и возрастает содержание хондроитинсульфат протеогликанов, характерных для эмбриональных и активно пролиферирующих тканей. Были получены данные, что протеогликаны являются тканеспецифичными, но не видоспецифичными ингибиторами деления клеток и привлекают внимание как регуляторы клеточной пролиферации, в том числе как перспективные ингибиторы роста злокачественных опухолей.
Для некоторых протеогликанов, в частности, для декорина (дерматансульфат протеогликана), показан механизм антипролиферативного действия (через усиление экспрессии р21-белка и подавление активности циклин-зависимых киназ). Было показано, что в опухолевых клетках содержание декорина уменьшается. Добавление экзогенного декорина или генноинженерных конструкций, содержащих ген декорина, в культуру опухолевых клеток приводило к возвращению опухолевых клеток к нормальному фенотипу. Однако вопрос о причинах уменьшения содержания декорина в опухолевых клетках до сих пор не поднимался.
Нашей группой было выдвинуто предположение, что возможно, в опухолевых клетках происходят изменения в процессе биосинтеза протеогликанов.
Известно, что ключевым ферментом биосинтеза дерматансульфат протеогликанов является D-глюкуронил С5-эпимераза - фермент, осуществляющий модификацию углеводной цепи хондроитинсульфата в дерматансульфат. Нарушение экспрессии или изменение активности фермента D-глюкуронил С5-эпимеразы может служить причиной изменения соотношения хондроитинсульфатов и дерматансульфатов в тканях - уменьшению количества зрелого дерматансульфата (в том числе и декорина).
Для проверки этой гипотезы требуется провести параллельное определение состава протеогликанов и уровня экспрессии/активности D-глюкуронил С5-эпимеразы в одних и тех же образцах нормальной и опухолевой ткани. В качестве объекта исследования нами выбрана нормальная и опухолевая ткань молочной железы человека.
Данная дипломная работа посвящена определению состава протеогликанов и экспрессии белковой молекулы D-глюкуронил С5-эпимеразы в нормальной и опухолевой ткани молочной железы человека.
Глава 1. Обзор литературы1.1 Протеогликаны
Протеогликаны (ПГ) - это семейство сложных макромолекулярных соединений, состоящих из белкового кора и ковалентно присоединенных к нему углеводных цепей - гликозаминогликанов (ГАГ) (рис.1).
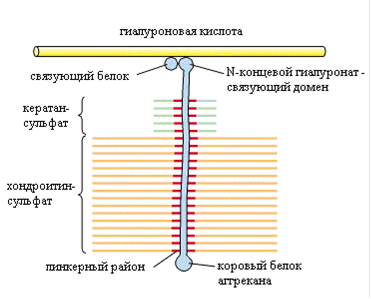
Рис.1. Структура протеогликана аггрекана
1.2 Отличие протеогликанов от гликопротеиновЕще недавно бытовало общепринятое разделение: гликопротеин - гликозилированный белок, протеогликан - углеводная молекула с небольшой белковой частью. Это разделение слишком неопределенное.
Существуют более четкие отличительные параметры, позволяющие выделить портеогликаны в обособленный класс белково-углеводных молекул.
Протеогликан - это гликопротеин, к которому присоединены углеводные цепи ГАГ. Гликозаминогликаны являются регулярными (повторяющиеся дисахаридные единицы), неразветвленными, высокозаряженными полимерами. Они присоединяются к коровому белку через кислород остатков серина (за некоторым исключением) - О-гликозилирование. В то время как гликопротеины, к которым относится большинство белков, модифицированы углеводными цепями, не имеющими регулярного строения, эти цепи зачастую не являются линейными (имеют ветвления) и либо состоят из нейтральных моносахаров, либо несут незначительный заряд. Олиго - или полисахаридные цепи в гликопротеинах присоединяются к полипептидным цепям через кислород остатков серина или (чаще) азот остатков аспарагина (О - или N-гликозилирование).
К тому же цепи ГАГ значительно превосходят по длине углеводные цепи гликопротеинов. Например, цепь ГАГ с молекулярным весом 20 кДа содержит около 50 остатков сахаров, в то время как типичный N-гликан содержит 10-12 остатков.
Протеогликаны могут нести на своем коровом белке помимо ГАГ-цепей также короткие нерегулярные олигосахариды. При этом свойства сложной молекулы определяются в основном типом ГАГ-цепи, хотя олигосахариды могут также влиять на биологическую активность.
Если к гликопротеину присоединена хотя бы одна цепь ГАГ, он является протеогликаном.
1.3 Классификация протеогликановКлассифицируют протеогликаны по типу доминантных цепей ГАГ, присоедненных к коровому белку.
1.4 Строение и классификация гликозаминогликановГликозаминогликаны представляют собой линейные гетерополисахариды, составленные из повторяющихся дисахаридных единиц, каждая из которых состоит из гексозамина (D-глюкозамина - GlcN или D-галактозамина - GalN), соединенного с гексуроновой кислотой (D-глюкуроновой - GlcUA, или L-идуроновой - IdоUA), присутствующей во всех ГАГ, за исключением кератансульфата, где она замещена остатками галактозы (Gal).
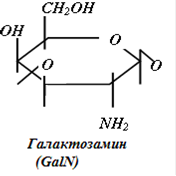
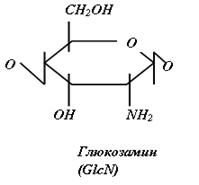
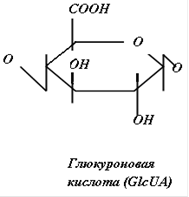
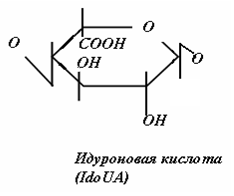
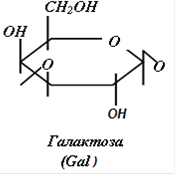
Дисахаридные единицы могут быть N - и O-сульфатированы и/или ацетилированы. Степень сульфатирования ГАГ намного выше, чем других макромолекул и достигает 3-4 сульфатных групп на дисахарид.
Благодаря сульфатным и карбоксильным группам ГАГ имеют очень высокую плотность отрицательного заряда, что во многом определяет их биологические свойства и регулирует их взаимодействие с другими молекулами.
В зависимости от структуры дисахарида, а также степени сульфатирования, все ГАГ разделяют на несколько классов: гиалуроновая кислота (ГК), хондроитинсульфаты (ХС), дерматансульфаты (ДС), гепарансульфаты (ГС), гепарин (Ге), кератансульфаты (КС) (таблица 1 и рис.2). Зачастую на одном белковом коре находятся разные типы ГАГ-цепей.
Таблица 1. Классы гликозаминогликанов (ГАГ)
| Класс ГАГ | Мол. Вес, кДа | Повторяющаяся дисахаридная единица | Сульфогруппа (O-, N-связанная) | Количество сульфо-групп на 1 дисахарид | Другие сахара, встречаю-щиеся в связующем участке |
| Гиалуроновая кислота, ГК | 1-8000 | D-GlcUA, D-GlcN | - | - | - |
Хондроитин- сульфат, ХС | 10-50 | D-GlcUA, D-GalN | O- | 0,1-1,3 | D-Gal, D-Xyl |
| Дерматан-сульфат, ДС | 10-40 | D-GlcUA/ L-IdоUA, D-GalN | O- | 1-2,5 | D-Gal, D-Xyl |
| Гепаран-сульфат, ГС | 10-40 | D-GlcUA/L-IdоUA, D-GlcN | O-, N- | 0,4-2,0 | D-Gal, D-Xyl |
| Гепарин, Ге | 5-25 | D-GlcUA/L-IdоUA, D-GlcN | O-, N- | 1,5-3,0 | D-Gal, D-Xyl |
| Кератан - сульфат I, KC I | 5-25 | D-Gal, D-GlcN | O- | 0,9-1,8 | D-Man, L-Fuc, SA |
| Кератан - сульфат II, KC II | 5-15 | D-Gal, D-GlcN | N- | 0,9-1,8 | D-GalN, SA |
Подобные работы: