Геоэкологическая характеристика фосфора
«...Да! Это была собака, огромная, черная, как смоль. Но такой собаки еще никто из нас, смертных, не видывал. Из ее отверстой пасти вырывалось пламя, глаза метали искры, по морде и загривку переливался мерцающий огонь. Ни в чьем воспаленном мозгу не могло возникнуть видение более страшное, более омерзительное, чем это адское существо, выскочившее на нас из тумана... Страшный пес, величиной с молодую львицу. Его огромная пасть все еще светилась голубоватым пламенем, глубоко сидящие дикие глаза были обведены огненными кругами. Я дотронулся до этой светящейся головы и, отняв руку, увидел, что мои пальцы тоже засветились в темноте. Фосфор, – сказал я».
Артур Конан-Дойл. «Собака Баскервилей».

Пятая группа Периодической системы включает два типических элемента азот и фосфор – и подгруппы мышьяка и ванадия. Между первым и вторым типическими элементами наблюдается значительное различие в свойствах.
В состоянии простых веществ азот – газ, а фосфор – твердое вещество. Эти два вещества получили большую область применения, хотя когда азот впервые был выделен из воздуха, его посчитали вредным газом, а на продаже фосфора удавалось заработать большое количество денег (в фосфоре ценили способность светиться в темноте).
Фосфор - аналог азота. Хотя физические и химические свойства этих элементов очень различаются, есть у них и общее, в частности то, что эти элементы совершенно необходимы животным и растениям. Академик Ферсман называл фосфор "элементом жизни и мысли", и это определение вряд ли можно отнести к категории литературных преувеличений. Фосфор обнаружен буквально во всех органах зеленых растений: в стеблях, корнях, листьях, но больше всего его в плодах и семенах. Растения накапливают фосфор и снабжают им животных. В организме животных фосфор сосредоточен главным образом в скелете, мышцах и нервной ткани. Тело человека содержит в среднем около полутора килограмм фосфора. Из этого количества 1,4 кг приходится на кости, около 130 грамм - на мышцы и 12 грамм на нервы и мозг. Почти все важнейшие физиологические процессы, происходящие в нашем организме, связаны с превращениями фосфор-органических веществ. В состав костей фосфор входит главным образом в виде фосфата кальция. Зубная эмаль - это тоже соединение фосфора, которое по составу и кристаллическому строению соответствует важнейшему минералу фосфора апатиту. Ca5(PO4)3 (FCl). Естественно, что, как и всякий жизненно необходимый элемент, фосфор совершает в природе круговорот. Из почвы его берут растения, от растений этот элемент попадает в организмы человека и животных. В почву фосфор возвращается с экскрементами и при гниении трупов. Фосфобактерии переводят органический фосфор в неорганические соединения. Однако в единицу времени из почвы выводится значительно больше фосфора, чем поступает в почву, Мировой урожай сейчас ежегодно уносит с полей больше 3 млн. т фосфора. Естественно, что для получения устойчивых урожаев этот фосфор должен быть возвращен в почву, и потому нет ничего удивительного в том, что мировая добыча фосфоритной руды сейчас составляет значительно больше 100 млн. тонн в год.
2. ИСТОРИЧЕСКИЕ АСПЕКТЫ ВОПРОСА
2.1. История открытия фосфора
 Обычно датой открытия фосфора считается 1669 г., однако имеются некоторые указания, что он был известен и ранее. Гефер, например, сообщает, что в алхимическом манускрипте из сборника, хранящегося в Парижской библиотеке, говорится о том, что еще около ХII в. некто Алхид Бехиль получил при перегонке мочи с глиной и известью вещество, названное им "эскарбукль". Может быть, зто и был фосфор, составляющий большой секрет алхимиков. Во всяком случае известно, что в поисках философского камня алхимики подвергали перегонке и другим операциям всевозможные материалы, втомчисле мочу, зкскременты, кости и т. д. С древних времен фосфорами называли вещества, способные светиться в темноте. В XVII в. был известен болонский фосфор - камень, найденный в горах вблизи Болоньи; после обжига на углях камень приобретал способность светиться. Описывается также "фосфор Балдуина", приготовленный волостным старшиной алдуином из прокаленной смеси мела и азотной кислоты. Свечение подобных веществ вызывало крайнее удивление и почиталось чудом.
Обычно датой открытия фосфора считается 1669 г., однако имеются некоторые указания, что он был известен и ранее. Гефер, например, сообщает, что в алхимическом манускрипте из сборника, хранящегося в Парижской библиотеке, говорится о том, что еще около ХII в. некто Алхид Бехиль получил при перегонке мочи с глиной и известью вещество, названное им "эскарбукль". Может быть, зто и был фосфор, составляющий большой секрет алхимиков. Во всяком случае известно, что в поисках философского камня алхимики подвергали перегонке и другим операциям всевозможные материалы, втомчисле мочу, зкскременты, кости и т. д. С древних времен фосфорами называли вещества, способные светиться в темноте. В XVII в. был известен болонский фосфор - камень, найденный в горах вблизи Болоньи; после обжига на углях камень приобретал способность светиться. Описывается также "фосфор Балдуина", приготовленный волостным старшиной алдуином из прокаленной смеси мела и азотной кислоты. Свечение подобных веществ вызывало крайнее удивление и почиталось чудом.
В 1669 г. гамбургский алхимик-любитель Бранд, разорившийся купец, мечтавший с помощью алхимии поправить свои дела, подвергал обработке самые разнообразные продукты. Предполагая, что физиологические продукты могут содержать "первичную материю", считавшуюся основой философского камня, Бранд заинтересовался человеческой мочой.
Он собрал около тонны мочи из солдатских казарм и выпаривал ее до образования сиропообразной жидкости. Эту жидкость он вновь дистиллировал и получил тяжелое красное "уринное масло". Перегнав это масло еще раз, он обнаружил на дне реторты остаток "мертвой головы" (Caput mortuum), казалось бы ни к чему непригодной. Однако, прокаливая этот остаток длительное время, он заметил, что в реторте появилась белая пыль, которая медленно оседала на дно реторты и явственно светилась. Бранд решил, что ему удалось извлечь из "маслянистой мертвой головы" элементарный огонь, и он с еще большим рвением продолжил опыты. Превратить этот "огонь" в золото ему, конечно, не удалось, но он все же держал в строгом секрете свое открытие фосфора (от греч.- свет и "несу", т.е. светоносца). Однако о секрете Бранда узнал некто Кункель, служивший в то время алхимиком и тайным камердинером у саксонского курфюрста. Кункель попросил своего сослуживца Крафта, отправлявшегося в Гамбург, выведать у Бранда какие-либо сведения о фосфоре. Крафт, однако, сам решил воспользоваться секретом Бранда. Он купил у него секрет за 200 талеров и, изготовив достаточное количество фосфора, отправился в путешествие по Европе, где с большим успехом демонстрировал перед знатными особами свечение фосфора. В частности, в Англии он показывал фосфор королю Карлу II и ученому Бойлю. Тем временем Кункелю удалось самому приготовить фосфор способом, близким к способу Бранда, и в отличие от последнего он широко рекламировал фосфор, умалчивая, однако, о секрете его изготовления. В 1680 г. независимо от предшественников новый элемент был получен знаменитым английским физиком и химиком Робертом Бойлем, который, так же как и Кункель, опубликовал данные о свойствах фосфора, но о способе его получения сообщил в закрытом пакете лишь Лондонскому королевскому обществу (это сообщение было опубликовано только через 12 лет, уже после смерти Бойля), а ученик Бойся – А. Ганквиц изменил чистой науке и вновь возродил «фосфорную спекуляцию» в виде широкой производственной деятельности по изготовлению этого вещества: 50 лет он широко торговал фосфором по весьма высокой цене. В Голландии, например, унция (31,1 г) фосфора стоила в то время 16 дукатов. По поводу природы фосфора высказывались самые фантастические предположения. В XVIII в. фосфором занимались многие крупные ученые и среди них Маргграф, усовершенствовавший способ получения фосфора из мочи путем добавления к последней хлорида свинца (1743).
В 1777 г. Шееле установил наличие фосфора в костях и рогах животных в виде фосфорной кислоты, связанной с известью. Некоторые авторы, впрочем, приписывают это открытие другому шведскому химику Гану, однако именно Шееле разработал способ получения фосфора из костей. Элементарным веществом фосфор был признан Лавуазье на основе его известных опытов по сжиганию фосфора в кислороде. В таблице простых тел Лавуазье поместил фосфор во второй группе простых тел, неметаллических, окисляющихся и дающих кислоты. С XIX в. фосфор получил широкое применение главным образом в виде солей, используемых для удобрения почв.
Итак, более трехсот лет отделяют нас от того момента, когда гамбургский алхимик Геннинг Бранд открыл новый элемент – фосфор. Подобно другим алхимикам, Бранд пытался отыскать эликсир жизни или философский камень, с помощью которых старики молодеют, больные выздоравливают, а неблагородные металлы превращаются в золото. Не забота о благе людском, а корысть руководила Брандом. Об этом свидетельствуют факты из истории единственного настоящего открытия, сделанного им. На первом, пятидесятилетнем этапе истории фосфора, кроме открытия Бойля, лишь одно событие отмечено историей науки: в 1715 г. Генсинг установил наличие фосфора в мозговой ткани. После опытов Маркграфа история элемента, приобретшего много лет спустя номер 15, стала историей многих больших открытий.
2.2. Хронология открытий, связанных с фосфором
В 1715 году Генсинг установил наличие фосфора в мозговой ткани...
 В 1743 году немецкий химик, почетный член Санкт-Петербургской Академии наук А.С. Маргграф разработал новый способ получения фосфора.
В 1743 году немецкий химик, почетный член Санкт-Петербургской Академии наук А.С. Маргграф разработал новый способ получения фосфора.
![]() В 1769 году Ю.Ган доказал, что в костях содержится много фосфора. То же самое подтвердил через два года шведский химик К.Шееле, предложивший способ получения фосфора из золы, образующейся при обжиге костей. Ещё несколькими годами позже Ж.Л.Пруст и М.Клапрот, исследуя различные природные соединения, доказали, что фосфор широко распространён в земной коре, главным образом в виде фосфата кальция.
В 1769 году Ю.Ган доказал, что в костях содержится много фосфора. То же самое подтвердил через два года шведский химик К.Шееле, предложивший способ получения фосфора из золы, образующейся при обжиге костей. Ещё несколькими годами позже Ж.Л.Пруст и М.Клапрот, исследуя различные природные соединения, доказали, что фосфор широко распространён в земной коре, главным образом в виде фосфата кальция.
![]()
 1797 году в России А.А.Мусин-Пушкин получил аллотропную разновидность фосфора – фиолетовый фосфор. Однако в литературе открытие фосфора ошибочно приписывается И.Гитторфу, который, используя методику А.А.Мусина-Пушкина, получил его только в 1853 году.
1797 году в России А.А.Мусин-Пушкин получил аллотропную разновидность фосфора – фиолетовый фосфор. Однако в литературе открытие фосфора ошибочно приписывается И.Гитторфу, который, используя методику А.А.Мусина-Пушкина, получил его только в 1853 году.
В 1799 году Дондональд доказал, что соединения фосфора необходимы для нормального развития растений.
В 1839 году другой англичанин, Лауз, впервые получил суперфосфат - фосфорное удобрение, легко усвояемое растениями.
 В 1842 годув Англии было организовано первое в мире промышленное производство суперфосфата. В России такие производства появились в 1868 и 1871 годах.
В 1842 годув Англии было организовано первое в мире промышленное производство суперфосфата. В России такие производства появились в 1868 и 1871 годах.
![]() В 1848 году австрийский химик А.Шрёттер открыл аллотропическое видоизменение фосфора - красный фосфор. Этот фосфор он получил нагреванием белого фосфора до температуры 250 градусов в атмосфере СО (оксида углерода два). Интересно отметить, что А.Шрёттер первый указал на
В 1848 году австрийский химик А.Шрёттер открыл аллотропическое видоизменение фосфора - красный фосфор. Этот фосфор он получил нагреванием белого фосфора до температуры 250 градусов в атмосфере СО (оксида углерода два). Интересно отметить, что А.Шрёттер первый указал на  возможность применения красного фосфора при изготовлении спичек.
возможность применения красного фосфора при изготовлении спичек.
В 1926 Году А.Е.Ферсманом и его сотрудниками были открыты огромные запасы апатиты на Кольском полуострове.
![]() В 1934 году, американский физик П.Бриджмен, изучая влияние высоких давлений на разные вещества, выделил похожий на графит черный фосфор.
В 1934 году, американский физик П.Бриджмен, изучая влияние высоких давлений на разные вещества, выделил похожий на графит черный фосфор.
3. СВОЙСТВА ФОСФОРА КАК ХИМИЧЕСКОГО ЭЛЕМЕНТА
3.1. Физические свойства
Фосфор (P) – вследствие высокой активности в свободном состоянии в природе не встречается.
Электронная конфигурация 1S22S22P63S23P3
Фосфор – неметалл (то, что раньше называли металлоид) средней активности. На наружной орбите атома фосфора находятся пять электронов, причем три из них не спарены. Поэтому он может проявлять валентности 3–, 3+ и 5+.
Для того чтобы фосфор проявлял валентность 5+, необходимо какое-либо воздействие на атом, которое бы превратило в не спаренные два спаренных электрона последней орбиты.
Фосфор часто называют многоликим элементом. Действительно, в разных условиях он ведет себя по-разному, проявляя то окислительные, то восстановительные свойства. Многоликость фосфора – это и его способность находиться в нескольких аллотропных модификациях.
3.2. Распространение в природе
Фосфор широко распространен в природе и составляет 0,12% земной коры. Он входит в состав белков растительного и животного происхождения. Человеческий скелет содержит примерно 1400 г фосфора, мышцы – 130 г, мозг и нервы – 12 г. Фосфор составляет существенную долю в химическом составе растений и поэтому является важным удобрением. Основным сырьем для производства удобрений служат апатит CaF2Ч3Ca3(PO4)2 и фосфориты, основой которых являются фосфат кальция Ca3(PO4)2. Элементный фосфор получают электротермическим восстановлением при 1400–1600°С из фосфоритов и апатитов в присутствии SiO2. Апатит добывают в России, Бразилии, Финляндии и Швеции. Крупным источником фосфора является фосфоритовая руда, в больших количествах добываемая в США, Марокко, Тунисе, Алжире, Египте, Израиле. Гуано, другой источник фосфора, добывают на Филиппинах, Сейшельских островах, в Кении и Намибии.
3.3. Важнейшие аллотропные модификации
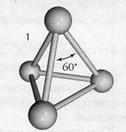 Белый фосфор. Пожалуй, самая известная модификация элемента №15 – мягкий, как воск, белый или желтый фосфор. Это ее открыл Бранд, и благодаря ее свойствам элемент получил свое имя: по-гречески «фосфор» значит светящийся, светоносный. Молекула белого фосфора состоит из четырех атомов, построенных в форме тетраэдра. Плотность 1,83, температура плавления 44,1°C, кипения 280°С, Белый фосфор ядовит, чрезвычайно реакционноспособен, легко окисляется. Растворим в сероуглероде, жидких аммиаке и SO2, бензоле, эфире, летуч. Имеет резкий чесночный запах. В воде почти не растворяется. Светится в темноте.
Белый фосфор. Пожалуй, самая известная модификация элемента №15 – мягкий, как воск, белый или желтый фосфор. Это ее открыл Бранд, и благодаря ее свойствам элемент получил свое имя: по-гречески «фосфор» значит светящийся, светоносный. Молекула белого фосфора состоит из четырех атомов, построенных в форме тетраэдра. Плотность 1,83, температура плавления 44,1°C, кипения 280°С, Белый фосфор ядовит, чрезвычайно реакционноспособен, легко окисляется. Растворим в сероуглероде, жидких аммиаке и SO2, бензоле, эфире, летуч. Имеет резкий чесночный запах. В воде почти не растворяется. Светится в темноте.
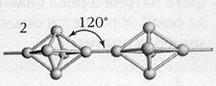 Êðàñíûé ôîñôîð. Ïðè íàãðåâàíèè áåç äîñòóïà âîçäóõà âûøå 250°C áåëûé ôîñôîð ïðåâðàùàåòñÿ â êðàñíûé. Ýòî óæå ïîëèìåð, íî íå î÷åíü óïîðÿäî÷åííîé ñòðóêòóðû. Ðåàêöèîííàÿ ñïîñîáíîñòü ó êðàñíîãî ôîñôîðà çíà÷èòåëüíî ìåíüøå, ÷åì ó áåëîãî. Îí íå ñâåòèòñÿ â òåìíîòå, íå ðàñòâîðÿåòñÿ â ñåðîóãëåðîäå. (Âñåãäà ñîäåðæèò íåáîëüøèå êîëè÷åñòâà áåëîãî ôîñôîðà, âñëåäñòâèå ÷åãî ìîæåò îêàçàòüñÿ ÿäîâèòûì.). Ïëîòíîñòü åãî íàìíîãî áîëüøå, ñòðóêòóðà ìåëêîêðèñòàëëè÷åñêàÿ. Áåç çàïàõà, öâåò êðàñíî-áóðûé. Àòîìíàÿ êðèñòàëëè÷åñêàÿ ðåø¸òêà î÷åíü ñëîæíàÿ, îáû÷íî àìîðôåí. Íåðàñòâîðèì â âîäå è â îðãàíè÷åñêèõ ðàñòâîðèòåëÿõ. Óñòîé÷èâ. Ôèçè÷åñêèå ñâîéñòâà çàâèñÿò îò ñïîñîáà ïîëó÷åíèÿ.
Êðàñíûé ôîñôîð. Ïðè íàãðåâàíèè áåç äîñòóïà âîçäóõà âûøå 250°C áåëûé ôîñôîð ïðåâðàùàåòñÿ â êðàñíûé. Ýòî óæå ïîëèìåð, íî íå î÷åíü óïîðÿäî÷åííîé ñòðóêòóðû. Ðåàêöèîííàÿ ñïîñîáíîñòü ó êðàñíîãî ôîñôîðà çíà÷èòåëüíî ìåíüøå, ÷åì ó áåëîãî. Îí íå ñâåòèòñÿ â òåìíîòå, íå ðàñòâîðÿåòñÿ â ñåðîóãëåðîäå. (Âñåãäà ñîäåðæèò íåáîëüøèå êîëè÷åñòâà áåëîãî ôîñôîðà, âñëåäñòâèå ÷åãî ìîæåò îêàçàòüñÿ ÿäîâèòûì.). Ïëîòíîñòü åãî íàìíîãî áîëüøå, ñòðóêòóðà ìåëêîêðèñòàëëè÷åñêàÿ. Áåç çàïàõà, öâåò êðàñíî-áóðûé. Àòîìíàÿ êðèñòàëëè÷åñêàÿ ðåø¸òêà î÷åíü ñëîæíàÿ, îáû÷íî àìîðôåí. Íåðàñòâîðèì â âîäå è â îðãàíè÷åñêèõ ðàñòâîðèòåëÿõ. Óñòîé÷èâ. Ôèçè÷åñêèå ñâîéñòâà çàâèñÿò îò ñïîñîáà ïîëó÷åíèÿ.
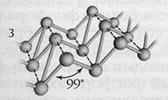 Чёрный фосфор - полимерное вещество с металлическим блеском, похож на графит, без запаха, жирный на ощупь. Нерастворим в воде и в органических растворителях. Атомная кристаллическая решётка, полупроводник. t°кип.= 453°С (возгонка), t°пл.= 1000°C (при p=1,8 • 109 Па), устойчив.
Чёрный фосфор - полимерное вещество с металлическим блеском, похож на графит, без запаха, жирный на ощупь. Нерастворим в воде и в органических растворителях. Атомная кристаллическая решётка, полупроводник. t°кип.= 453°С (возгонка), t°пл.= 1000°C (при p=1,8 • 109 Па), устойчив.
Менее известны другие, еще более высокомолекулярные модификации фосфора – фиолетовый и коричневый, отличающиеся одна от другой молекулярным весом и степенью упорядоченности макромолекул. Эти модификации – лабораторная экзотика и в отличие от белого и красного фосфора практического применения пока не нашли.
3.4. Получение фосфора
Фосфор приготовляется в больших размерах на химических заводах с тех пор, как для него найдены значительные технические применения, главным образом для приготовления фосфорных спичек. Материалом для его получения уже не служит более выпаренная моча, а фосфорнокислый кальций костей или тот, который встречается в минеральном царстве.
Как ни велико сродство фосфора к кислороду, оно все-таки менее сродства раскаленного угля. Фосфорный ангидрид, смешанный в надлежащей форме с углем и нагретый до светлокрасного каления, вполне восстановляется им с образованием окиси углерода:
P2O5 + 5C = P2 + 5CO
Если накаливать с углем фосфорнокислый кальций, встречающийся в минеральном царстве или содержащийся в обожженых добела костях, то фосфор не восстанавливается, так как он может быть получен только из свободного фосфорного ангидрида или такого фосфорнокислого кальция, который содержит более элементов фосфорного ангидрида, нежели средняя соль.
Для получения такой соли, обыкновенный средний фосфорнокислый кальций измельчается в тонкий порошок, обливается разведенною серною кислотою и нагревается. При этом получается кислый фосфорнокислый кальций и трудно растворимый в воде сернокислый кальций (гипс):
Ca3(PO4)2 + 2H2SO4 = Ca(H2PO4)2 + 2CaSO4
Образовавшийся кислый фосфорнокислый кальций переходит в раствор и отделяется от гипса сливанием и отжиманием.
Этот раствор концентрируется выпариванием в свинцовых сосудах, затем смешивается с измельченным древесным углем и нагревается до слабого каления. При этом происходит выделение воды из кислой фосфорнокислой соли и образуется метафосфорнокислый кальций:
Ca(H2PO4)2 = 2H2O + Ca(PO3)2
Метафосфорнокислый кальций можно рассматривать, как состоящий из среднего фосфорнокислого кальция и фосфорного ангидрида:
3Ca(PO3)2 = Ca3(PO4)2 + 2P2O5
Из этого то последнего соединения и выделяется фосфор при сильном накаливании с углем, а в остатке получается средний фосфорнокислый кальций:
3Ca(PO3)2 + 5C2 = 2P2 + 10CO + Ca3(PO4)2
Накаливание производится в глиняных ретортах, соединенных с глиняными же, наполненными водою приемниками, в которых парообразный фосфор сгущается и собирается под водою. Полученный таким образом сырой продукт еще не чист и очищается перегонкою в чугунных ретортах.
Около 80% от всего производства белого фосфора идет на синтез чистой ортофосфорной кислоты. Она в свою очередь используется для получения полифосфатов натрия (их применяют для снижения жесткости питьевой воды) и пищевых фосфатов. Оставшаяся часть белого фосфора расходуется для создания дымообразующих веществ и зажигательных смесей.
В производстве фосфора и его соединений требуется соблюдение особых мер предосторожности, т.к. белый фосфор – сильный яд. Продолжительная работа в атмосфере белого фосфора может привести к заболеванию костных тканей, выпадению зубов, омертвению участков челюстей. Воспламеняясь, белый фосфор вызывает болезненные, долго не заживающие ожоги. Хранить белый фосфор следует под водой, в герметичных сосудах. Горящий фосфор тушат двуокисью углерода, раствором CuSO4 или песком. Обоженную кожу следует промыть раствором KmnO4 или CuSO4. Противоядием при отравлении фосфором является 2%-ый раствор CuSO4.
3.5. Химические свойства
1. Реакции с кислородом:
4P0 + 5O2 –t°= 2P2+5O5
(при недостатке кислорода: 4P0 + 3O2 –t°= 2P2+3O3)
2. С галогенами и серой:
2P + 3Cl2 = 2PCl3
2P + 5Cl2 = 2PCl5
2P + 5S –t°= P2S5
галогениды фосфора легко разлагаются водой, например:
PCl3+3H2O=H3PO3+3HCl
PCl5 + 4H2O = H3PO4 + 5HCl
3. С азотной кислотой:
3P0 + 5HN+5O3 + 2H2O = 3H3P+5O4 + 5N+2O
4. С металлами образует фосфиды, в которых фосфор проявляет степень окисления - 3:
2P0 + 3Mg = Mg3P2-3
фосфид магния легко разлагается водой
Mg3P2 + 6H2O = 3Mg(OH)2 + 2PH3(фосфин)
3Li + P =Li3P-3
5. Со щелочью:
4P + 3NaOH + 3H2O = PH3 + 3NaH2PO2
В реакциях (1,2,3) - фосфор выступает как восстановитель, в реакции (4) - как окислитель; реакция (5) - пример реакции диспропорционирования.
3.6. Стереохимические особенности фосфора и его соединений. Псевдовращение.
 îòëè÷èå îò àçîòà ôîñôîð ìîæåò îáðàçîâûâàòü ïÿòü êîâàëåíòíûõ ñâÿçåé ïóòåì ðàñøèðåíèÿ ñâîåé âàëåíòíîé îáîëî÷êè îò îêòåòà äî äåöåòà. Ìîëåêóëû, öåíòðàëüíûé àòîì êîòîðûõ èìååò áîëåå âîñüìè ýëåêòðîíîâ â âàëåíòíîé îáîëî÷êå, íàçûâàþòñÿ ãèïåðâàëåíòíûìè. Ïîäîáíûå ñîåäèíåíèÿ ïðèîáðåòàþò êîíôèãóðàöèþ òðèãîíàëüíîé áèïèðàìèäû, íàïðèìåð:

Пять заместителей занимают стереохимически неодинаковое положение: три из них (а, b и с в формуле LXV) называют экваториальными, а два (d и е) - апикальными. Интересно, что молекула LXV с пятью разными заместителями у атома фосфора, в принципе, может существовать в виде 20 хиральных изомеров, составляющих 10 пар энантиомеров. Если два заместителя одинаковы, число изомеров сокращается до 10, среди которых две пары будут энантиомерами.
Молекулы, в которых центральный атом имеет координационное число 4 или 6 обычно сохраняют устойчивую форму тетраэдра или октаэдра. Однако в пентакоординационных соединениях лиганды непрерывно меняют свое положение. По этой причине пятикоординационные соединения фосфора (а также многие другие, отличающиеся аналогичным типом химического поведения) принято называть конфигурационно-неустойчивыми. Для объяснения непрерывной смены положения лигандов в тригональной бипирамиде предложен механизм псевдовращения - обратимый переход между конфигурациями тригональной бипирамиды и тетрагональной пирамиды:
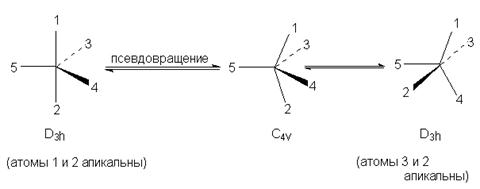
В процессе этого мнимого вращения один из экваториальных заместителей, называемый опорным лигандом (в нашем случае обозначен цифрой 5) остается в экваторальном положении, в то время как другие лиганды формируют собой основание воображаемой тетрагональной пирамиды за счет искажения валентных углов. Валентный угол между связями 1-Р-2 уменьшается от 180 до 1200, а между связями 3-Р-4 увеличивается от 120 до 1800, т.е. апикальные лиганды 1 и 2 в конце концов займут экваториальные, а экваториальные лиганды 3 и 4 - апикальные положения. В результате образуется диастереомер исходной системы, т.е. происходит кажущийся поворот лигандов на 900 относительно опорного лиганда 5.
Псевдовращение происходит потому, что энергетическая разница между конфигурациями D3h и C4v в пентакоординационных соединениях фосфора очень невелика.
3.7. Изотопы фосфора
Природный фосфор в отличие от подавляющего большинства элементов состоит только из одного изотопа 31Р. В ядерных реакциях синтезировано несколько короткоживущих радиоактивных изотопов элемента №15. Один из них – фосфор-30 оказался вообще первым изотопом, полученным искусственным путем. Это его получили в 1934 г. Фредерик и Ирен Жолио-Кюри при облучении алюминия альфа-частицами. Фосфор-30 имеет период полураспада 2,55 минуты и, распадаясь, излучает позитроны («положительные электроны»). Сейчас известны шесть радиоактивных изотопов фосфора. Наиболее долгоживущий из них 33Р имеет период полураспада 25 дней. Изотопы фосфора применяются главным образом в биологических исследованиях.
4. СОЕДИНЕНИЯ ФОСФОРА
4.1. Неорганические соединения фосфора и их свойства
4.1.1. Галогениды и оксиды фосфора
Хлорид фосфора(III) PCl3 – жидкость, кипящая при 75° С. Под действием воды полностью разлагается на HCl и фосфорную кислоту H3PO3.
Хлорид фосфора(V) PCl5 – твердое белое вещество. Получается при пропускании хлора в PCl3. Водой разлагается на HCl и фосфорную кислоту H3PO4.
Аналогичные соединения образуются с бромом, иодом и фтором, но соединение PI5 неизвестно.
Оксид фосфора(III) P2O3 (устар. фосфористый ангидрид) – белое кристаллическое вещество, плавящееся при 23,8° С. Образуется при медленном окислении или горении фосфора при ограниченном доступе кислорода. Молекулярная формула при низких температурах – P4O6. Медленно реагирует с холодной водой с образованием фосфористой кислоты H3PO3, P2O3, и H3PO3 – сильные восстановители.
Химические свойства оксида фосфора III
1. Все свойства кислотных оксидов.
P2O3 + 3H2O = 2H3PO3
2. Сильный восстановитель
O2+ P2+3O3 = P2+5O5
Фосфорный ангидрид P2+5O5 (оксид фосфора (V)).
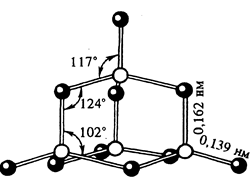
Белые кристаллы, t°пл.= 570°С, t°кип.= 600°C, r = 2,7 г/см3. Имеет несколько модификаций. В парах состоит из молекул P4H10, очень гигроскопичен (используется как осушитель газов и жидкостей).
Получение
4P + 5O2 = 2P2O5
Химические свойства фосфорного ангидрида
Все химические свойства кислотных оксидов: реагирует с водой, основными оксидами и щелочами
1) P2O5 + H2O = 2HPO3 (метафосфорная кислота)
P2O5 + 2H2O = H4P2O7 (пирофосфорная кислота)
P2O5 + 3H2O = 2H3PO4 (ортофосфорная кислота)
2) P2O5 + 3BaO = Ba3(PO4)2
3) P2O5 + 6KOH = 2K3PO4+ 3H2O
P2O5 - сильное водоотнимающее средство:
4) P2O5+ 2HNO3 = 2HPO3 + N2O5
P2O5+ 2HClO4 = 2HPO3+ Cl2O7
4.1.2. Фосфорные кислоты
Формула | Название |
HPO3 | Метафосфорная |
H3PO2 | Фосфорноватистая (Диоксофосфорная) |
H3PO3 | Ортофосфористая |
H3PO4 | Ортофосфорная |
H3PO5 | Мононадфосфорная |
H4P2O5 | Пирофосфористая (Дифосфористая) |
H4P2O6 | Фосфорноватная (Гексаоксодифосфорная) |
H4P2O7 | Пирофосфорная |
H4P2O8 | Динадфосфорная |
Свойства основных кислот
HP+5O3 Метафосфорная кислота
![]()
Получение
P2O5+ H2O = 2HPO3
Соли метафосфорной кислоты - метафосфаты (KPO3 – метафосфат калия)
Химические свойства
Характерны все свойства кислот.
H3P+5O3 Фосфористая кислота
![]()
Бесцветное кристаллическое вещество; t°пл.= 74°С, хорошо растворимое в воде.
Получение
PCl3+ 3H2O = H3PO3+ 3HCl
Химические свойства
1) Водный раствор H3PO3 - двухосновная кислота средней силы (соли – фосфиты):
H3PO3+ 2NaOH = Na2HPO3+ 2H2O
2) При нагревании происходит превращение в ортофосфорную кислоту и фосфин:
4H3PO3 = 3H3PO4+ PH3
3) Восстановительные свойства:
H3PO3+ HgCl2+ H2O = H3PO4+ Hg + 2HCl
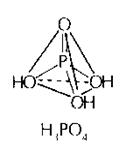 H3P+5O4 Ортофосфорная кислота
H3P+5O4 Ортофосфорная кислота
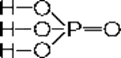
Белое твердое вещество, гигроскопичное, хорошо растворимое в воде; t°пл.= 42°С, r = 1,88 г/см3.
Диссоциация:
H3PO4 ↔ 3H+ + PO4-3
H3PO4+ 3H2O ↔ 3H3O+ + PO43-
H3PO4 ↔ H+ + H2PO4-
H2PO4- ↔ H+ + HPO42-
HPO42- ↔ H+ + PO43-
Ортофосфорная кислота - средней силы, не является окислителем, трехосновная. Она образует средние соли - ортофосфаты (Na3PO4) и два типа кислых солей - дигидрофосфаты (NaH2PO4) и гидрофосфаты (Na2HPO4).
Получение
1)
P2O5+ 3H2O ↔ 2H3PO4
Промышленный способ:
2)
Ca3(PO4)2(твердый) + 3H2SO4(конц.) ↔ 2H3PO4+ 3CaSO4¯
3)
3P + 5HNO3+ 2H2O ↔ 3H3PO4+ 5NO
Химические свойства
Для ортофосфорной кислоты характерны все свойства кислот – неокислителей. При нагревании она превращается в пирофосфорную кислоту:
2H3PO4 –t°↔ H4P2O7 + H2O
Качественная реакция на обнаружение в растворе анионов PO43-
3Ag+ + PO43- = Ag3PO4¯(ярко-желтый осадок)
Ортофосфорная кислота - сильная кислота по первой ступени диссоциации (К1 = 7,6*10-3), довольно слабая (слабее уксусной) по второй (К2 = 6,2*10-8) и очень слабая (слабее угольной) по третьей (К3 = 4,4*10-13).
4.1.3. Фосфин
Фосфин (PH3) – бесцветный газ с запахом чеснока. Очень ядовит. Сгорает с образованием фосфорного ангидрида P2O5. С наиболее сильными кислотами (HClO4, HCl) образует соли фосфония PH4+ – очень непрочные соединения, которые при действии воды разлагаются на фосфин и HCl.
Cуществует несколько водородных соединений фосфора. Наиболее изучены РН3 (фосфин), а также Р2Н4 - жидкий фосфористый водород (дифосфин). Наибольшую известность и практическое значение имеет газообразный РН3. При комнатной температуре он представляет собой бесцветный, тяжёлый (пл.1.53 г/дм), чрезвычайно ядовитый газ с неприятным запахом.
Максимальная концентрация его в воздухе при 8-часовом рабочем дне не должна превышать 0,3 млн-1. Концентрация в 50-100 млн-1 переносима без осложнений лишь очень короткое время, концентрация в 400 млн-1 ведёт к моментальной смерти, что служит серьёзным препятствием для его практического использования . Ниже –87,8o С фосфин - бесцветная жидкость, которая затвердевает при –133,5 о С. Вплоть до температур в несколько сот градусов его диссоциация незначительна. Константа скорости распада при 500о С составляет около 8.10-3 сек-1. Фосфин является сильным восстановителем, самопроизвольно реагирует при комнатной температуре с хлором, образуя хлориды фосфора и НCl. Чистый газ воспламеняется на воздухе при 150о С. Загрязненный примесями газ (следы дифосфина Р2Н4 или тетрафосфора Р4) может самовоспламеняться при комнатной температуре. Условия воспламенения фосфина и кислорода зависят от состава смеси, содержания воды, присутствия инородных газов и температуры. Окисление фосфина происходит по цепному механизму и имеет пределы критического давления:
0: + РН3 РН + НОН
РН + 02 НРО + 0:
Первая стадия проходит быстро, поскольку она экзотермична и, вероятно, включает перенос не спаренного электрона от кислорода к фосфору (p*- уровень кислорода может быть по энергии выше, чем 3d-уровень фосфора). Продукты окисления состоят из различных кислот фосфора (Н3РО2, Н3РО3, Н3РО4 и т.д.) и воды.
Фосфин почти не образует водородных связей и об отсутствии межмолекулярной ассоциации в РН3 свидетельствуют аномальное соотношение температур плавления и кипения РН3 (-133,3о;-87,4o C) и NH3 (-77,75o;-33,35o C). На это указывает также низкая по сравнению с NH3 растворимость фосфина в воде. В 100 мл воды при 17о С растворяется 22,8 мл газообразного РН3. Водный раствор является одновременно и слабой кислотой и слабым основанием. Обмен дейтерия между D2О и РН3 протекает в кислом растворе через РН4+-ион, в основном растворе через РН2--ион. Из кинетических данных и принятого механизма обмена авторы для равновесной постоянной реакции рассчитали:
РН3 + НОН = РН2- + Н3О+, kкисл.= 1,6.10-29;
РН3 + НОН = РН4+ + ОН-, kосн. = 4.10-28
Несколько лучше он растворяется в органических растворителях: бензине, хлороформе и четырёххлористом углероде. Молекула фосфина полярна (m = 0,58) и имеет форму тригональной пирамиды c атомом фосфора в вершине. Все три атома водорода в молекуле равноценны, расстояние Р-Н составляет 1,419 А, высота пирамиды 0,764 А, угол связи Н-Р-Н 93,7, энергия связи Р-Н 77 ккал/моль. Образование связей Р-Н происходит за счёт р-орбиталей фосфора, а не поделенная пара электронов имеет сферическую симметрию и расположена на s-орбитали. Участие d-орбиталей в образовании связей, по-видимому, невелико. Такое строение фосфина чрезвычайно затрудняет образование донорно-акцепторных связей с его участием как донора электронов. Именно затруднение sp3_гибридизации орбиталей атомов фосфора обуславливает слабость донорных свойств фосфина и соответственно его плохо выраженные основные свойства. Этим объясняется малый дипольный момент молекулы РН3, уменьшение основности и способности к координации по сравнению с аммиаком, устойчивость и нейтральность фосфина в обычных условиях. Присоединение протона к РН3 (переход 3р ® 3sр3) сопровождается перестройкой валентных углов и протекает с большой затратой энергии, поэтому соли фосфония известны лишь для немногих кислот (НСIО4, НВr, НI), причём они весьма нестойки.
Фосфин способен осаждать тяжёлые металлы из их солей. Окисление проходит через стадию образования комплексного соединения металл-фосфин. Эффективными окислителями выступают металлы, у которых на d-оболочке больше 5, но меньше 10 электронов. Не поделенная пара электронов фосфора молекулы РН3 может передаваться на ds- орбиталь металла, образуя координационную связь. Согласно теории поля лигандов, среди группы d–орбиталей металла ds–орбитали всегда относятся к наивысшим энергетическим уровням. Поэтому соответствующая ds-орбиталь (dz2, dx2-y2) будет вакантной и способной к координационному связыванию фосфина. Вакантные dp-орбитали фосфора участвуют в образовании p-дативной связи М ® РН3. Комплексы с фосфином сравнительно немногочисленны, а соединения, в которых РН3 единственный лиганд, редки.
Фосфин, первичные и вторичные фосфины образуют комплексы с солями Al, Ti, Cu, Ni, Co, Fe, Pd, Pt и других металлов. Комплексообразование РН3 с различными металлами переменной валентности, проблемы катализа реакций окисления фосфина в отходящих газах химических производств широко освещены в работах .
Жидкий гидрид фосфора Р2Н4 представляет собой бесцветную жидкость с температурой кипения 60оС, самовозгорающуюся на воздухе. На свету происходит самопроизвольный распад Н2Р-РН2:
3 Р2Н4 2 РН3 + Р4Н2 + 2Н2
В отличие от гидразина H2N-NH2 (стехиометрического аналога Н2Р-РН2), жидкий фосфористый водород Р2Н4 не обладает основными свойствами из-за слабости донорных свойств фосфора, проявляющихся даже у РН3. Твёрдый гидрид фосфора Р4Н2 – жёлтое твёрдое вещество, загорающееся на воздухе выше 160оС.
4.1.4. Фосфонитрилхлориды
Самостоятельный класс веществ составили фосфонитрилхлориды – соединения фосфора с азотом и хлором. Мономер фосфонитрилхлорида способен к полимеризации. С ростом молекулярного веса меняются свойства веществ этого класса, в частности заметно уменьшается их растворимость в органических жидкостях. Когда молекулярный вес полимера дости