Гальванические элементы
Химические источники тока в течении многих лет прочно вошли в нашу жизнь. В быту потребитель редко обращает внимание на отличия используемых химических источниках тока. Для него это батарейки и аккумуляторы. Обычно они используются в устройствах таких, как карманные фонари, игрушки, радиоприемники или автомобили. В том случае, когда потребляемая мощность относительно велика (10Ач), используются аккумуляторы, в основном кислотные, а также никель - железные и никель - кадмиевые. Они применяются в портативных электронных вычислительных машинах (Laptop, Notebook, Palmtop), носимых средствах связи, аварийном освещении и пр.
В силу ряда обстоятельств химические генераторы электрической энергии являются наиболее перспективными. Их преимущества проявляются через такие параметры, как высокий коэффициент выхода энергии; бесшумность и безвредность; возможность использования в любых условиях, в том числе в космосе и под водой, в стационарных и переносных устройствах, на транспорте и т.д.
В последние годы такие аккумуляторы широко применяются в резервных источниках питания ЭВМ и электромеханических системах, накапливающих энергию для возможных пиковых нагрузок и аварийного питания электроэнергией жизненно – важных систем.
Цели и задачи. В данной работе мне необходимо разобрать принцип действия гальванических элементов, познакомиться с историей их создания, особенностями классификации и устройством различных видов гальванических элементов, а также применением в тех или иных видов химических источников тока в повседневной жизни и различных сферах производства.
I.История создания химических источников тока
Химические источники тока (аббр. ХИТ) — устройства, в которых энергия протекающих в них химических реакций непосредственно превращается в электрическую энергию.
История создания
Вольтов столб
Первый химический источник тока был изобретён итальянским учёным Алессандро Вольта в 1800 году. Это был элемент Вольта — сосуд с солёной водой с опущенными в него цинковой и медной пластинками, соединенными проволокой. Затем учёный собрал батарею из этих элементов, которая в последствии была названа Вольтовым столбом. Это изобретение в последствии использовали другие учёные в своих исследованиях. Так, например, в 1802 году русский академик В. В. Петров сконструировал Вольтов столб из 2100 элементов для получения электрической дуги. В 1836 году английский химик Джон Дэниель усовершенствовал элемент Вольта, поместив цинковый и медный электроды в раствор серной кислоты. Эта конструкция стала называться «элементом Даниэля». В 1859 году французский физик Гастон Плантэ изобрёл свинцово-кислотный аккумулятор. Этот тип элемента и по сей день используется в автомобильных аккумуляторах. В 1865 году французский химик Ж. Лекланше предложил свой гальванический элемент (элемент Лекланше), состоявший из цинкового стаканчика, заполненного водным раствором хлористого аммония или другой хлористой соли, в который был помещён агломерат из оксида марганца(IV) MnO2 с угольным токоотводом. Модификация этой конструкции используется до сих пор в солевых батарейках для различных бытовых устройств. В 1890 году в Нью-Йорке Конрад Губерт, иммигрант из России, создаёт первый карманный электрический фонарик. А уже в 1896 году компания National Carbon приступает к массовому производству первых в мире сухих элементов Лекланше «Columbia».
II.Принцип действия
Устройство «багдадских батареек» (200 г. до н. э.).
Основу химических источников тока составляют два электрода (катод, содержащий окислитель и анод, содержащий восстановитель), контактирующих с электролитом. Между электродами устанавливается разность потенциалов — электродвижущая сила, соответствующая свободной энергии окислительно-восстановительной реакции. Действие химических источников тока основано на протекании при замкнутой внешней цепи пространственно разделённых процессов: на катоде восстановитель окисляется, образующиеся свободные электроны переходят, создавая разрядный ток, по внешней цепи к аноду, где они участвуют в реакции восстановления окислителя.
В современных химических источниках тока используются:
в качестве восстановителя (на аноде) — свинец Pb, кадмий Cd, цинк Zn и другие металлы;
в качестве окислителя (на катоде) — оксид свинца(IV) PbO2, гидроксид никеля NiOOH, оксид марганца(IV) MnO2 и другие;
в качестве электролита — растворы щелочей, кислот или солей.
III. Классификация, устройство и принцип действия
По возможности или невозможности повторного использования химические источники тока делятся на:
1. Гальванический элемент
Гальванический элемент - химический источник электрического тока, названный в честь Луиджи Гальвани. Принцип действия гальванического элемента основан на взаимодействии двух металлов через электролит, приводящем к возникновению в замкнутой цепи электрического тока. ЭДС гальванического элемента зависит от материала электродов и состава электролита. Это первичные ХИТ, которые из-за необратимости протекающих в них реакций, невозможно перезарядить.
Гальванические элементы являются источниками электрической энергии одноразового действия. Реагенты (окислитель и восстановитель) входят непосредственно в состав гальванического элемента и расходуются в процессе его работы. Гальванический элемент характеризуется ЭДС, напряжением, мощностью, емкостью и энергией, отдаваемой во внешнюю цепь, а также сохраняемостью и экологической безопасностью.
ЭДС определяется природой протекающих в гальваническом элементе процессов. Напряжение гальванического элемента U всегда меньше его ЭДС в силу поляризации электродов и потерь сопротивления:
U = Eэ – I(r1–r2) – ΔE,
где Еэ – ЭДС элемента; I – сила тока в режиме работы элемента; r1 и r2 – сопротивление проводников I и II рода внутри гальванического элемента; ΔЕ – поляризация гальванического элемента, складывающаяся из поляризаций его электродов (анода и катода). Поляризация возрастает с увеличением плотности тока (i), определяемой по формуле i = I/S, где S – площадь поперечного сечения электрода, и ростом сопротивления системы.
В процессе работы гальванического элемента его ЭДС и, соответственно, напряжение постепенно снижаются в связи с уменьшением концентрации реагентов и увеличением концентрации продуктов окислительно-восстановительных процессов на электродах (вспомним уравнение Нернста). Однако чем медленнее снижается напряжение при разряде гальванического элемента, тем больше возможностей его применения на практике. Емкостью элемента называют общее количество электричества Q, которое гальванический элемент способен отдать в процессе работы (при разрядке). Емкость определяется массой запасенных в гальваническом элементе реагентов и степенью их превращения. При увеличении тока разряда и снижении температуры работы элемента, особенно ниже 00С, степень превращения реагентов и емкость элемента снижаются.
Энергия гальванического элемента равна произведению его емкости на напряжение: ΔН = Q.U. Наибольшей энергией обладают элементы с большим значением ЭДС, малой массой и высокой степенью превращения реагентов.
Сохраняемостью называют продолжительность срока хранения элемента, в течение которого его характеристики остаются в заданных параметрах. С ростом температуры хранения и эксплуатации элемента, его сохраняемость уменьшается.
Состав гальванического элемента: восстановителями (анодами) в портативных гальванических элементах, как правило, служат цинк Zn, литий Li, магний Mg; окислителями (катодами) – оксиды марганца MnO2, меди CuO, серебра Ag2O, серы SO2, а также соли CuCl2, PbCl2, FeS и кислород О2.
Самым массовым в мире остается производство марганец–цинковых элементов Mn–Zn, широко применяемых для питания радиоаппаратуры, аппаратов связи, магнитофонов, карманных фонариков и т.п. Конструкция такого гальванического элемента представлена на рисунке
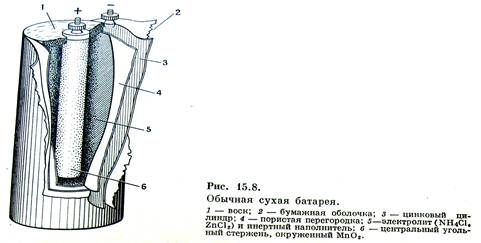
Токообразующими реакциями в этом элементе являются:
- на аноде (–): Zn – 2ē → Zn2+ (на практике происходит постепенное растворение цинковой оболочки корпуса элемента);
- на катоде (+): 2MnO2 + 2NH4+ + 2ē → Mn2O3 + 2NH3 + H2O.
В электролитическом пространстве также идут процессы:
- у анода Zn2+ + 2NH3 →(Zn(NH3)2)2+;
- у катода Mn2O3 + H2O → (Mn2O2(OH)2) или 2(MnOOH).
В молекулярном виде химическую сторону работы гальванического элемента можно представить суммарной реакцией:
Zn + 2MnO2 + 2NH4Cl → (Zn(NH3)2)Cl2 + 2(MnOOH).
Схема гальванического элемента:
(–) Zn|Zn(NH3)2)2+||(MnOOH)|MnO2 (С) (+).
ЭДС такой системы составляет Е= 1,25 ÷ 1,50В.
Гальванические элементы с подобным составом реагентов в щелочном электролите (КОН) имеют лучшие выходные характеристики, но они неприменимы в портативных устройствах в силу экологической опасности. Еще более выгодными характеристиками обладают серебряно-цинковые элементы Ag-Zn, но они чрезвычайно дороги, а значит, экономически неэффективны. В настоящее время известно более 40 различных типов портативных гальванических элементов, называемых в быту «сухими батарейками».
2. Электрические аккумуляторы
Электрические аккумуляторы (вторичные ХИТ)— перезаряжаемые гальванические элементы, которые с помощью внешнего источника тока (зарядного устройства) можно перезарядить.
Аккумуляторы – это устройства, в которых под воздействием внешнего источника тока в системе накапливается (аккумулируется) химическая энергия (процесс зарядки аккумулятора), а затем при работе устройства (разрядка) химическая энергия снова превращается в электрическую. Таким образом, при зарядке аккумулятор работает как электролизер, а при разрядке – как гальванический элемент.
В упрощенном виде аккумулятор представляет собой два электрода (анод и катод) и ионный проводник между ними – электролит. На аноде как при разряде, так и при заряде протекают ре6акции окисления, а на катоде – реакции восстановления.
До последнего времени по-прежнему наиболее распространенными в России, да и в Приднестровье, остаются кислотные свинцовые и щелочные никель-кадмиевые и никель-железные аккумуляторы.
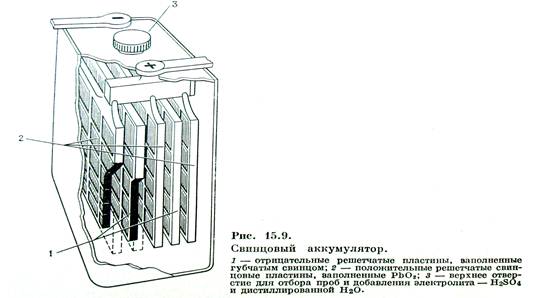
Электроды в нем представляют собой свинцовые решетки, из которых одна заполняется в порах порошком оксида свинца IV – PbO2. Электроды соединены с электролитом через пористый сепаратор. Всеь аккумулятор помещается в бак из эбонита или полипропилена.
При работе такого устройства в нем происходят следующие электродные процессы:
А).Разрядка или работа аккумулятора как источника электрической энергии.
На аноде: (–) Pb – 2ē → Pb2+;
на катоде: (+) PbO2 + 4H+ + 2ē → Pb2+ + 2H2O.
Образующиеся на электродах катионы свинца взаимодействуют с анионами электролита с выделением белого осадка сульфата свинца
Pb2+ + SO42– = ↓PbSO4.
Суммарная токообразующая реакция процесса разрядки аккумулятора:
Pb + PbO2 + 2H2SO4 = 2PbSO4↓ + 2H2O,
а схема работающего аккумулятора как гальванического элемента имеет вид (–) Pb|PbSO4||PbO2 (+).
Напряжение на клеммах работающего аккумулятора достигает величины 2,0÷2,5В. В процессе эксплуатации устройства электролит расходуется, а в системе накапливается осадок. Когда концентрация активных ионов водорода (Н+) становится критической для реакции на катоде, аккумулятор прекращает свою работу.
Б).Зарядка или восстановление химического потенциала аккумулятора для последующего его преобразования в электрическую энергию. Для этого аккумулятор подсоединяют к внешнему источнику тока таким образом, что к клемме «анод» подается отрицательный полюс, а к клемме «катод» - положительный. В этом случае на электродах под действием внешнего напряжения возникают обратные процессы, восстанавливающие их до первоначального состояния.
Металлический свинец восстанавливает поверхность электрода (–): PbSO4 + 2ē → Pb + SO42;
Образующийся оксид свинца IV заполняет поры свинцовой решетки (+): PbSO4 + 2H2O – 2ē → ↓PbO2 + 4H+ + SO42.
Суммарная восстановительная реакция: 2PbSO4 + 2H2O = Pb + PbO2 +2H2SO4.
Определить момент окончания процесса зарядки аккумулятора можно по появлению пузырьков газа над его клеммами («кипение»). Это связано с возникновением побочных процессов восстановления катионов водорода и окисления воды с ростом напряжения при восстановлении электролита:
2Н+ + 2ē → Н2↑; 2Н2О – 4ē → О2↑ + 2Н2↑.
Коэффициент полезного действия аккумулятора достигает 80% и рабочее напряжение длительное время сохраняет свое значение.
ЭДС аккумулятора может быть рассчитана по уравнению:
RT α4(H+)·α2(SO42–)
EЭ = EЭ0 + –––– ℓn –––––––––––––– (твердые фазы в Сравн. не
2F α2(H2O) учитываются).
Надо заметить, что в аккумуляторе нельзя использовать концентрированную серную кислоту (ω(H2SO4) > 30%), т.к. при этом уменьшается ее электрическая проводимость и увеличивается растворимость металлического свинца. Свинцовые аккумуляторы широко используются в автомобильном транспорте всех типов, на телефонных и электрических станциях. Однако из-за высокой токсичности свинца и его продуктов, свинцовые аккумуляторы требуют герметичной упаковки и полной автоматизации процессов их эксплуатации.
А) В щелочных аккумуляторах положительный электрод изготавливается из никелевой решетки, пропитанной гелеобразным гидрооксидом никеля II Ni(OH)2; а отрицательный – из кадмия или железа. Ионным проводником служит 20%-ый раствор гидрооксида калия КОН. Суммарные токообразующие и генерирующие реакции в таких аккумуляторах имеют вид:
разряд
2NiOOH + Cd + 2H2O ◄======►2Ni(OH)2 + Cd(OH)2; ЕЭ0 = 1,45В.
заряд
разряд
2NiOOH + Fe + 2H2O ◄======►2Ni(OH)2 + Fe(OH)2; ЕЭ0 = 1,48В.
заряд
К достоинствам этих аккумуляторов относят большой срок их службы (до 10 лет) и высокую механическую прочность, а к недостаткам – невысокие КПД и рабочее напряжение. Щелочные аккумуляторы используются для питания электрокар, погрузчиков, рудничных электровозов, аппаратуры связи и электронной аппаратуры, радиоприемников. Вспомним также, что кадмий является высокотоксичным металлом, что требует соблюдения правил безопасности при утилизации отработанных устройств.
В последние годы активно разрабатываются аккумуляторы с литиевым отрицательным электродом, неводным электролитом и положительным электродом, состоящим из оксидов V2O3; NiO; CoO; MnO2. Они используются в электронной слаботоковой аппаратуре.
3. Топливные элементы
Топливные элементы (электрохимические генераторы)— устройства, подобные гальваническому элементу, но отличающееся от него тем, что вещества для электрохимической реакции подаются в него извне, а продукты реакций удаляются из него, что позволяет ему функционировать непрерывно.
Следует заметить, что деление элементов на гальванические и аккумуляторы до некоторой степени условное, так как некоторые гальванические элементы, например щелочные батарейки, поддаются подзарядке, но эффективность этого процесса крайне низка.
По типу используемого электролита химические источники тока делятся на кислотные (например свинцово-кислотный аккумулятор, свинцово-плавиковый элемент), щелочные (например ртутно-кадмиевый элемент, никель-цинковый аккумулятор) и солевые (например, марганцево - магниевый элемент, цинк - хлорный аккумулятор).
А) Принцип действия
Если окислитель и восстановитель хранятся вне гальванического элемента и в процессе работы непрерывно подаются к инертным электродам (графитовым стержням, не участвующим в токообразующих реакциях, а являющихся лишь переносчиками электронов), то такой генератор может работать длительное время с постоянным значением вырабатываемого напряжения. В топливных элементах химическая энергия восстановителя (топлива) и окислителя, непрерывно и раздельно подаваемых к электродам, непосредственно превращается в электрическую энергию. Удельная энергия топливного элемента (количество вырабатываемого электричества на 1 моль количества химического вещества) значительно выше, чем у гальванического элемента.
В качестве топлива (восстановителя) в элементах используются жидкие или газообразные водород Н2, метанол СН3ОН, метан СН4, а в качестве окислителя – кислород О2 из воздуха. Электролитом служит раствор кислоты или щелочи. Устройство топливного элемента схематично представлено на рисунке:
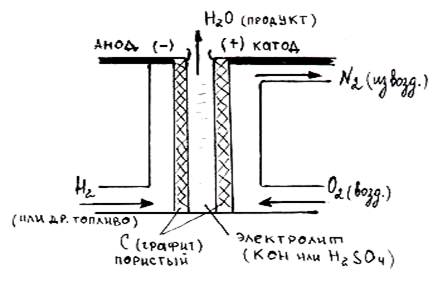
Рисунок: Схема устройства работающего топливного элемента.
Если электролитом в топливном элементе является кислота, то в системе будут проходить следующие окислительные и восстановительные процессы:
на аноде (–): Н2 – 2ē → 2Н+;
на катоде (+): О2 + 4Н+ + 4ē → 2Н2О, следовательно,
суммарная токообразующая реакция 2Н2 + О2 = 2Н2О.
Схема работающего кислородно-водородного кислотного топливного элемента имеет вид: (–) (C)Н2|2H+||2H2O|O2(C) (+).
Если же электролитом в элементе является щелочь, то процессы несколько изменяются:
на аноде (–): 2Н2 + 4ОН– – 4ē → 4Н2О;
на катоде (+): О2 + 2Н2О + 4ē → 4ОН–, но суммарная токообразующая реакция остается прежней 2Н2 + О2 = 2Н2О.
Схема работающего кислородно-водородного щелочного топливного элемента имеет вид: (–) (С)Н2|2H2O||4OH–|O2(C) (+).
В результате протекания указанных реакций в топливном кислородно-водородном элементе генерируется постоянный ток 1,23÷1,50В.
Для уменьшения электрического сопротивления в системе применяются реагенты с высокой электрической проводимостью, либо жидкие электролиты меняются на твердые или расплавы.
В отличие от гальванических, топливные элементы не работают без вспомогательных устройств, обеспечивающих бесперебойный подвод реагентов и отвод продуктов электролиза. Для увеличения напряжения U и силы тока I в генераторе топливные элементы соединяют в батареи. В результате получается сложная система, включающая дополнительные устройства подвода и отвода реакционной смеси, поддержания и регулирования температуры, преобразователи тока и напряжения. Ее называют электрохимической энергоустановкой (ЭХЭ).ЭХЭ имеют КПД в 1,5-2,0 раза выше по сравнению с тепловыми машинами, при этом являются экологически безупречными. Именно поэтому (Н2-О2) – ЭХЭ применяют на космических кораблях, да еще и учитывая тот факт, что продукт токообразующей реакции – Н2О – служит источником питьевой воды для космонавтов. В России работают ЭХЭ и электростанции мощностью от 40кВт до 11мВт, в которых используется природное топливо (залежи природного газа и отходы нефтепереработки).
Б) Принцип разделения потоков топлива и горючего
Обычно в низкотемпературных топливных элементах используются: водород со стороны анода и кислород на стороне катода (водородный элемент) или метанол и кислород воздуха. В отличие от топливных элементов, одноразовые гальванические элементы содержат твердые реагенты, и когда электрохимическая реакция прекращается, должны быть заменены, электрически перезаряжены, чтобы запустить обратную химическую реакцию, или, теоретически, в них можно заменить электроды. В топливном элементе реагенты втекают, продукты реакции вытекают, и реакция может протекать так долго, как поступают в нее реагенты и сохраняется работоспособность самого элемента.
В) Пример водородно-кислородного топливного элемента
с протоннообменной мембраной (или «с полимерным электролитом»). Протонно-проводящая полимерная мембрана разделяет два электрода — анод и катод. Каждый электрод обычно представляет собой угольную пластину (матрицу) с нанесенным катализатором — платиной, или сплавом платиноидов и др. композиции.
На катализаторе анода молекулярный водород диссоциирует и теряет электроны. Протоны проводятся через мембрану к катоду, но электроны отдаются во внешнюю цепь, так как мембрана не пропускает электроны.
На катализаторе катода, молекула кислорода соединяется с электроном (который подводится из внешних коммуникаций) и пришедшим протоном, и образует воду, которая является единственным продуктом реакции (в виде пара и/или жидкости).
Топливные элементы не могут хранить электрическую энергию, как гальванические или аккумуляторные батареи, но для некоторых применений, таких как работающие изолированно от электрической системы электростанции, использующие непостоянные источники энергии (солнце, ветер), они совместно с электролизерами и емкостями для хранения топлива (напр. водорода), образуют устройство для хранения энергии. Общий КПД такой установки (преобразование электрической энергии в водород, и обратно в электрическую энергию) 30-40 %.
Мембрана обеспечивает проводимость протонов, но не электронов. Она может быть полимерной (Нафион, полиацетилен и др.) или керамической (оксидной и др.).
Типы топливных элементов
Метанольный топливный элемент в Mercedes Benz Necar 2
Твердооксидный топливный элемент (англ. Solid-oxide fuel cells — SOFC);
Топливный элемент с протонообменной мембраной (англ. Proton-exchange membrane fuel cell — PEMFC);
Обратимый топливный элемент (англ. Reversible Fuel Cell);
Прямой метанольный топливный элемент (англ. Direct-methanol fuel cell — DMFC);
Расплавной карбонатный топливный элемент (англ. Molten-carbonate fuel cells — MCFC);
Фосфорнокислый топливный элемент (англ. Phosphoric-acid fuel cells — PAFC);
Щелочной топливный элемент (англ. Alkaline fuel cells — AFC).
Г) История исследований в России
В СССР первые публикации о топливных элементах появились в 1941 году.
Первые исследования начались в 60-х годах. РКК «Энергия» (с 1966 года) разрабатывала PAFC элементы для советской лунной программы. С 1987 года по 2005 «Энергия» произвела около 100 топливных элементов, которые наработали суммарно около 80000 часов.
Во время работ над программой «Буран», исследовались щелочные AFC элементы. На «Буране» были установлены 10 кВт. топливные элементы.
В 70-80 годы «Квант» совместно с рижским автобусным заводом «РАФ» разрабатывали щелочные элементы для автобусов. Прототип автобуса на топливных элементах был изготовлен в 1982 году.
В 1989 году «Институт высокотемпературной электрохимии» (Екатеринбург) произвёл первую SOFC установку мощностью 1 кВт.
В 1999 году АвтоВАЗ начал работы с топливными элементами. К 2003 году на базе автомобиля ВАЗ-2131 было создано несколько опытных экземпляров. В моторном отсеке автомобиля располагались батареи топливных элементов, а баки со сжатым водородом в багажном отделении, то есть была применена классическая схема расположения силового агрегата и топливных баков-баллонов. Разработками водородного автомобиля руководил к.т. н. Мирзоев Г. К.
В 2003 году было подписано Генеральное соглашение о сотрудничестве между Российской академией наук и компанией "Норильский никель" в области водородной энергетики и топливных элементов. Это привело к учреждению в 2005 году Национальной инновационной компании «Новые энергетические проекты», которая в 2006 году произвела резервную энергетическую установку на основе ТЭ с твердым полимерным электролитом мощностью 1 кВт.
Над созданием образцов электростанций на топливных элементах работают Газпром и федеральные ядерные центры РФ. Твердооксидные топливные элементы, разработка которых сейчас активно ведется, появятся, видимо, в 2010—2015 годах.
Д) Применение топливных элементов
Стационарные приложения:производство электрической энергии (на электрических станциях), аварийные источники энергии, автономное электроснабжение,
Транспорт: автомобильные топливные элементы Honda, см Honda FCX, электромобили, автотранспорт, морской транспорт, железнодорожный транспорт, горная и шахтная техника, вспомогательный транспорт (складские погрузчики, аэродромная техника и т.д.)
Бортовое питание: авиация, космос, подводные лодки, морской транспорт,
Мобильные устройства: портативная электроника, питание сотовых телефонов, зарядные устройства для армии.
Преимущества водородных топливных элементов
Топливные элементы обладают рядом ценных качеств.
Это: высокий КПД, экологичность, компактные размеры
Топливные элементы легче и занимают меньший размер, чем традиционные источники питания. Топливные элементы производят меньше шума, меньше нагреваются, более эффективны с точки зрения потребления топлива. Это становится особенно актуальным в военных приложениях. Например, солдат армии США носит 22 различных типа аккумуляторных батарей. Средняя мощность батареи 20 ватт. Применение топливных элементов позволит сократить затраты на логистику, снизить вес, повысить время действия приборов и оборудования.
Е) Проблемы топливных элементов
Большинство элементов при работе выделяют то или иное количество тепла. Это требует создания сложных технических устройств для утилизации тепла (паровые турбины и пр.), а также организации потоков топлива и окислителя, систем управления отбираемой мощностью, долговечности мембран, отравления катализаторов некоторыми побочными продуктами окисления топлива и других задач. Но при этом же высокая температура процесса позволяет производить тепловую энергию, что существенно увеличивает КПД энергетической установки.
Также существует проблема получения водорода и хранения водорода. Во-первых, он должен быть достаточно чистый, чтобы не произошло быстрого отравления катализатора, во-вторых, достаточно дешёвый, чтобы его стоимость была рентабельна для конечного потребителя.
Существует множество способов производства водорода, но в настоящее время около 50% водорода ,производимого во всём мире, получают из природного газа. Все остальные способы пока дорогостоящи. . Существует мнение, что с ростом цен на энергоносители стоимость водорода также растёт, т.к. он является вторичным энергоносителем. Но себестоимость энергии, производимой из возобновляемых источников, постоянно снижается (см. Ветроэнергетика, Производство водорода). Например, средняя цена электроэнергии в США выросла в 2007 г. до $0,09 за кВт., тогда как себестоимость электроэнергии, произведённой из ветра, составляет $0,04- $0,07 (см. статью Ветроэнергетика, или AWEA). В Японии киловатт электроэнергии стоит около $0,2, что сопоставимо со стоимостью электроэнергии, произведённой фотоэлектрическими элементами. Т.е. с ростом цен на энергоносители производство водорода электролизом воды становится более конкурентоспособным.
К сожалению, в водороде, произведённом из природного газа, будет присутствовать СО, отравляющий катализатор. Поэтому для уменьшения отравления катализатора необходимо повысить температуру топливного элемента. Уже при температуре 160°С в топливе может присутствовать 1%СО.
Цена некоторых водородных топливных элементов пока остаётся высокой. Но в будущем цена будет снижаться при организации массового производства топливных элементов.
Внедрению топливных элементов на транспорте мешает отсутствие водородной инфраструктуры и более высокая себестоимость энергии. Возникает проблема "курицы и яйца" - зачем производить водородные автомобили, если нет инфраструктуры? Зачем строить водородную инфраструктуру, если нет водородного транспорта?
Появились и новые накопители энергии – электрохимические конденсаторы. Они состоят из двух электродов с высокоразвитой поверхностью и проводника II рода между ними.
Виды химических источников тока
Тип Катод Электролит Анод Напряжение, В
Марганцево-цинковый элемент MnO2 KOH Zn 1.56
Марганцево-оловянный элемент MnO2 KOH Sn 1.65
Марганцево-магниевый элемент MnO2 MgBr Mg 2.00
Свинцово-цинковый элемент PbO2 H2SO4 Zn 2.55
Свинцово-кадмиевый элемент PbO2 H2SO4 Cd 2.42
Свинцово-хлорный элемент PbO2 HClO4 Pb 1.92
Ртутно-цинковый элемент HgO2 KOH Zn 1.36
Ртутно-кадмиевый элемент HgO2 KOH Cd 1.92
Окисно-ртутно-оловянный
Элемент HgO2 KOH Sn 1.30
Хром-цинковый элемент K2Cr2O7 H2SO4 Zn 1.8—1.9
Аккумуляторы
Лантан-фторидный аккумулятор
Литий-ионный аккумулятор
Литий-полимерный аккумулятор
Марганцево-оловянный элемент
Никель-цинковый аккумулятор
Никель-кадмиевый аккумулятор
Никель-металл-гидридный аккумулятор
Свинцово-кислотный аккумулятор
Свинцово-оловянный аккумулятор
Серебряно-цинковый аккумулятор
Серебряно-кадмиевый аккумулятор
железо-никелевый аккумулятор
железо-воздушный аккумулятор
цинк-воздушный аккумулятор
цинк-хлорный аккумулятор
натрий-серный аккумулятор
литий-хлорный аккумулятор
свинцово-водородный аккумулятор
Цинк-бромный аккумулятор
Натрий-Никель-Хлоридный аккумулятор
Литий-железо-сульфидный аккумулятор
Литий-фторный аккумулятор
Топливные элементы
Прямой метанольный топливный элемент
Твердооксидный топливный элемент
Щелочной топливный элемент
IV. Эксплуатация элементов и батарей
Напряжение, отдаваемое батареей, нужно измерять вольтметром, обязательно подключив к батарее нагрузку с сопротивлением того же порядка, что и будущая реальная нагрузка, например для батареи фонаря это может быть лампочка от того же фонаря. Снижение напряжения меньше, чем 1 Вольт на элемент, как правило, нужно считать признаком разряда батареи. Разряжаются элементы по-разному, например, солевые снижают напряжение постепенно, а литиевые — «держат напряжение» весь срок эксплуатации, а потом почти сразу «садятся».
Смешивать в одной батарее элементы разных типов, разной степени разряженности, разных производителей и даже разных партий одного и того же производителя не рекомендуется. (Даже если питаемый батареей прибор будет действовать, элементы в батарее будут разряжаться по-разному, что в конце концов приведёт к протеканию одного из элементов и порче прибора и/или остальных элементов). Если же одинаковых элементов нет, то подобное смешивание можно допустить, но только на короткое время и под постоянным контролем состояния элементов. Однако применение подобной «смеси» в приборах с кратковременным высоким или малым длительным расходом энергии (например, в фотоаппаратах или часах) очень нежелательно.
По мере исчерпания химической энергии напряжение и ток падают, элемент перестаёт действовать. Некоторые типы элементов допускают обратимость химической реакции: их можно подзаряжать.
Литиевые элементы заряжать категорически нельзя! Металлический литий очень химически активен, в элементах применяется легковоспламеняемый электролит. Возможен взрыв.
Щелочные (алкалиновые) элементы подзаряжаются довольно хорошо, однако производители элементов, как правило, помещают на корпусе предупредительную надпись «не перезаряжать, не нагревать», иногда даже помещают в корпусе элемента (или батареи) диод, препятствующий перезаряду.
Специально нагревать выше, чем «чуть тёплая» действительно бессмысленно, а вот, например, элементы типа AA (щелочные, солевые — хуже), если они не до конца разряжены и не имеют повреждений корпуса (протечек), можно заряжать током 20—50 mA.
Если элемент при этом нагревается, ток заряда нужно уменьшить. Если появляются протечки электролита или посторонние запахи, элемент лучше выбросить. Заряд нужно проводить в проветриваемом неогнеопасном помещении под постоянным присмотром. Время заряда — несколько часов. Щелочные элементы можно подзаряжать раз десять, после этого они приходят в негодность (при подключении нагрузки разряжаются за несколько минут).
В безвыходном положении элемент можно попробовать смять (камнем, молотком). Наверняка после этого его придётся выбросить, однако после такой процедуры элемент вполне может проработать ещё около десяти-двадцати процентов номинального времени работы.
Далее в работе я опишу самые распространённые гальванические элементы и аккумуляторы.
V. Регенерация гальванических элементов и батарей
Идея восстановления разряженных гальванических элементов подобно аккумуляторным батареям не нова. Восстанавливают элементы с помощью специальных зарядных устройств. Практически установлено, что лучше других поддаются регенерации наиболее распространенные стаканчиковые марганцево-цинковые элементы и батареи, такие, как 3336Л (КБС-Л-0,5), 3336Х (КБС-Х-0,7), 373, 336. Хуже восстанавливаются галетные марганцево-цинковые батареи "Крона ВЦ", БАСГ и другие.
Наилучший способ регенерации химических источников питания - пропускание через них асимметричного переменного тока, имеющего положительную постоянную составляющую. Простейшим источником асимметричного тока является однополупериодный выпрямитель на диоде, шунтированном резистором. Выпрямитель подключают к вторичной низковольтной (5-10 в) обмотке понижающего трансформатора, питающегося от сети переменного тока. Однако такое зарядное устройство имеет невысокий к. п. д.- около 10% и, кроме этого, заряжаемая батарея при Случайном отключении напряжения, питающего трансформатор, может разряжаться.
Лучших результатов можно достигнуть, если применять зарядное устройство, выполненное по схеме, представленной на рис. 1. В этом устройстве вторичная обмотка II питает два отдельных выпрямителя на диодах Д1 и Д2, к выходам которых подключены две заряжаемые батареи Б1 и Б2.
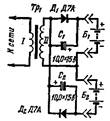
рис. 1
VI. Особенности некоторых видов гальванических элементов и их краткие характеристики
Висмутисто - магниевый элемент
Анодом служит магний, катодом — оксид висмута, а электролитом — водный раствор бромида магния. Обладает очень высокой энергоемкостью, и повышенным напряжением (1,97—2,1 Вольт).
Параметры
Теоретическая энергоемкость:
Удельная энергоемкость: около 103—160 Вт·ч/кг.
Удельная энергоплотность: около 205—248 Вт·ч/дм3.
ЭДС: 2,1 Вольта.
Рабочая температура: -20 +55 С°.
Диоксисульфатно - ртутный элемент
Диоксисульфатно-ртутный элемент - это первичный химический источник тока, в котором анодом является цинк, анодом - смесь окиси ртути и сульфата ртути с графитом (5%), а электролитом - водный раствор сульфата цинка. Отличается высокой мощностью и энергоплотностью.
Характеристики
Теоретическая энергоемкость:
Удельная энергоемкость:110-140 Вт/час/кг.
Удельная энергоплотность: 623-645 Вт/час/дм3.
ЭДС:1,358Вольта.
Рабочая температура: -14 + 60°С.
Утилизация
Этот элемент утилизируется согласно общим правилам утилизации оборудования, препаратов, сплавов и соединений содержащих ртуть.
Литий ионный аккумулятор (Li-ion)
Тип электрического аккумулятора, широко распространённый в современной бытовой электронной технике. В настоящее время это самый популярный тип аккумуляторов в таких устройствах как сотовые телефоны, ноутбуки, цифровые фотоаппараты.
Более совершенная конструкция литий-ионного аккумулятора называется литий-полимерным аккумулятором.
Первый литий-ионный аккумулятор разработала корпорация Sony в 1991 году.
Характеристики
Энергетическая плотность: 110 ... 160 Вт*ч/кг
Внутреннее сопротивление: 150 ... 250 мОм (для батареи 7,2 В)
Число циклов заряд/разряд до потери ёмкости на 80%: 500-1000
Время быстрого заряда: 2-4 часа
Допустимый перезаряд: очень низкий
Саморазряд при комнатной температуре: 10% в месяц
Напряжение в элементе: 3,6 В
Ток нагрузки относительно ёмкости:
- пиковый: больше 2С
- наиболее приемлемый: до 1С
Диапазон рабочих температур: -20 - +60 °С
Устройство
В начале в качестве отрицательных пластин применялся кокс (продукт переработки угля), в дальнейшем применяется графит. В качестве положительных пластин применяют сплавы лития с кобальтом или марганцем. Литий-кобальтовые пластины служат дольше, а литий-марганцевые значительно безопасней и обычно имеют встроенные термопредохранитель и термодатчик.
При заряде литий-ионных аккумуляторов протекают следующие реакции:
на положительных пластинах: LiCoO2 → Li1-xCoO2 + xLi+ + xe-
на отрицательных пластинах: С + xLi+ + xe- → CLix
При разряде протекают обратные реакции.
Преимущество
Высокая энергетическая плотность.
Низкий саморазряд.
Отсутствует эффект памяти.
Простота обслуживания.
Недостатки
Li-ion аккумуляторы могут быть опасны при разрушении корпуса аккумулятора, и при неаккуратном обращении могут иметь более короткий жизненный цикл в сравнении с другими типами аккумуляторов. Глубокий разряд полностью выводит из строя литий-ионный