Роль нарушений механизмов онтогенеза в патологии человека
Государственное образовательное учреждение
Высшего профессионального образования
«Орловский государственный университет»
Факультет естественных наук
Кафедра биологии
КУРСОВАЯ РАБОТА
на тему: «Роль нарушений механизмов онтогенеза
в патологии человека»
Студентки:
4 курса
Проверила:
Орел – 2011г.
Содержание
Периоды развития человека
Критические периоды в онтогенезе человека
Классификация врожденных пороков развития
Типы врожденных пороков развития
Заболевания, внутриутробная смерть плода
Литература
Периоды развития человека
онтогенез плод эмбриогенез врожденный порок
Развитие человека – это сложный биологический процесс, представляющий собой совокупность закономерных, взаимосвязанных, характеризующихся определенной временной последовательностью структурных, физиологических и метаболических изменений от зачатков, имеющих простое строение, до сложных органов. Такой процесс развития человека принято обозначать как онтогенез.
Термин «Онтогенез» введён Э. Геккелем (1866) при формулировании им биогенетического закона. Онтогенез разделяют на три периода: зародышевый (эмбриональный, или пренатальный) и послезародышевый (постэмбриональный, или постнатальный) и период развития взрослого организма (неотальный).
Онтогенез включает рост, т. е. увеличение массы тела, его размеров, дифференцировку. В основе онтогенеза лежит сложный процесс реализации на разных стадиях развития организма наследственной информации, заложенной в каждой из его клеток. Обусловленная наследственностью программа онтогенеза осуществляется под влиянием многих факторов (условия внешней среды, межклеточные и межтканевые взаимодействия, гуморально-гормональные и нервные регуляции и т.д.) и выражается во взаимосвязанных процессах размножения клеток, их роста и дифференцировки. Все связанные с изменением наследственности, новые в эволюционном отношении признаки возникают в онтогенезе, но лишь те из них, которые способствуют лучшему приспособлению организма к условиям существования, сохраняются в процессе естественного отбора и передаются последующим поколениям, т. е. закрепляются в эволюции.
Критические периоды в онтогенезе человека
С конца XIX в. существует представление о наличии в онтогенетическом развитии периодов наибольшей чувствительности к повреждающему действию разнообразных факторов. Эти периоды получили название критические, а повреждающие факторы (включают лекарственные средства, наркотики и многие другие вещества) — тератогенные.
Некоторые ученые полагают, что наиболее чувствительными к самым разнообразным внешним воздействиям являются периоды развития, характеризующиеся активным клеточным делением или интенсивно идущими процессами дифференциации. П. Г. Светлов, в середине XX столетия внесший большой вклад в разработку проблемы, считал, что критические периоды совпадают с моментом детерминации, который определяет конец одной и начало другой, новой цепи процессов дифференциации, т.е. с моментом переключения направления развития. По его мнению, в это время имеет место снижение регуляционной способности. Критические периоды не рассматривают как наиболее чувствительные к факторам среды вообще, т.е. независимо от механизма их действия. Вместе с тем установлено, что в некоторые моменты развития зародыши чувствительны к ряду внешних факторов, причем реакция их на разные воздействия бывает однотипной.
Критические периоды различных органов и областей тела не совпадают, друг с другом по времени. Причиной нарушения развития зачатка является большая чувствительность его в данный момент к действию патогенного фактора, чем у других органов. При этом действие разных факторов может вызвать одну и ту же аномалию. Это свидетельствует о неспецифическом ответе зачатка на повреждающие воздействия. В то же время некоторая специфичность тератогенных факторов выражается в том, что, будучи различными, они оказывают максимальное повреждающее действие не на одних и тех же стадиях развития.
П.Г.Светлов установил два критических периода в развитии плацентарных млекопитающих. Первый из них совпадает с процессом имплантации зародыша, второй — с формированием плаценты. Имплантация приходится на первую фазу гаструляции, у человека — на конец 1-й — начало 2-й недели. Второй критический период продолжается с 3-й по 8-ю неделю. В это время идут процессы нейруляции и начальные этапы органогенеза.
Однако этими двумя периодами не исчерпывается проблема критических периодов. В процессе закладки каждого органа также существуют особо чувствительные периоды, когда воздействие неблагоприятных факторов среды может вызвать, то или иное отклонение в его развитии (то есть аномалию). В критические периоды зародыш или плод становится высоко реактивным и лабильным по отношению к действию внешних факторов. Аномалии развития возникают при этом в силу того, что борьба организма с разрушительными процессами (то есть, регуляторная функция органов и систем плода) в эти периоды может быть ослаблена. Непосредственной причиной аномалии может послужить либо остановка развития той или иной системы организма в критический период, либо нарушение координации в скорости компенсаторных ответных реакций систем развивающегося плода. Чем на более ранней стадии своего развития находится эмбрион, тем его ответная реакция на действие патогенного фактора более отличается от реакции систем взрослого организма.
В онтогенезе человека к критическим периодам относят:
1. оплодотворение;
2. имплантацию (7-8-е сутки эмбриогенеза);
3. развитие осевого комплекса зачатков органов и плацентацию (3-8-я недели);
4. развитие головного мозга (15-20-я недели);
5. формирование основных систем организма, в том числе половой (20-24-я недели);
6. рождение;
7. период до 1 года;
8. половое созревание (11-16 лет).
К наиболее частым факторам, нарушающим нормальный эмбриогенез, принадлежат: перезревание женской половой клетки, нарушения обмена вещества у матери, гипоксия, содержание в крови матери токсических веществ (например, лекарственных препаратов, наркотических веществ, никотина, алкоголя и др.), инфекция, особенно вирусная. Для развития теплокровных животных и человека большое значение имеет температура тела. Длительное перегревание организма матери приводит к аномалиям развития плода. Рентгеновское облучение опасно в связи с возможными мутациями, так как клетки эмбриональных зачатков особенно чувствительны к радиации.
Гибель эмбрионов в различные периоды онтогенеза неравномерна среди зародышей мужского и женского полов: чем ближе к началу беременности, тем больше среди погибших зародышей мужского пола. Это связано с тем, что в эмбриогенезе возникает больше зародышей мужского пола, чем женского. Так, соотношение количества эмбрионов мужского и женского полов в 1-й месяц беременности составляет 600:100, а на 5-ом месяце – 140:100. Если считать, что в среднем на 1000 беременностей погибает 300 плодов, то величина внутриутробной смертности представляется следующими показателями: в 1-й лунный месяц погибает 112 эмбрионов, во 2-й – 72, в 3-й – 43, а затем показатели снижаются до единичных. То есть, на первые два месяца беременности приходится около 2/3 всех случаев гибели эмбрионов.
Точное число аномально развивающихся беременностей на стадии зиготы неизвестно, поскольку на этой стадии беременность сложно диагностировать. Приблизительно подсчитано, что из числа беременностей, заканчивающихся спонтанными абортами, половина сопровождается хромосомными дефектами зародыша. Подобные аборты расцениваются как “естественное средство” элиминации зародышей с генетическими дефектами и уменьшения числа врожденных уродств. По современным прогнозам, за счет спонтанного аборта генетически неполноценных зародышей число новорожденных с врожденными генетическими дефектами снижается с 12% до 2-3%. Используя методы фертилизации “in vitro” и разрабатывая современные биологические технологии, мы приближаемся к возможности анализировать состояние ДНК зародышей, предупреждать и корригировать врожденную патологию. Расшифровка генома человека, о которой было сообщено 26 июня 2000 г., практически завершена и в большой степени будет этому способствовать.
Патологические процессы, протекающие в организме матери в течение первых 7-и суток после оплодотворения, могут привести к эктопической (внематочной) беременности. Последняя составляет 0.8-2.4 случая на 100 доношенных беременностей (около 6% стационарной гинекологической патологии). В 98-99% случаев зародыш прикрепляется в маточной трубе. Яичниковая, шеечная и абдоминальная формы беременности встречаются редко. Летальность при эктопической беременности составляет около 7% всех смертей беременных женщин. Наличие эктопической беременности в анамнезе является частой причиной вторичного бесплодия. Действие разнохарактерных патологических факторов в раннем эмбриогенезе человека может вызвать прилежание плаценты и пузырный занос. При продолжающемся влиянии неблагоприятных факторов в патологическое формирование вовлекаются многие органы зародыша, в первую очередь – ЦНС, сердце и др. Только с 63 дня беременности опасность развития аномалий эмбриогенеза начинает уменьшаться. Все представленные выше факты накладывают большие обязательства на будущих родителей в плане предупреждения действия на организм беременной женщины вредных факторов среды и эмоционального стресса, особенно в период, когда зародыш находится в ранней фазе развития, и женщина не знает о своей беременности.
Таким образом, гибель зародыша возможна с самых ранних стадий развития, в результате спонтанных абортов (до 30% зародышей) и внематочной (эктопической) беременности.
После оплодотворения наиболее чувствительным периодом к действию тератогенов является период с 3-й по 8-ю недели развития. Именно в раннем эмбриогенезе человека закладывается большая часть аномалий и уродств развития. Чем раньше возникает повреждение, тем грубее бывают пороки развития. Развивающийся организм можно уподобить большому вееру. Достаточно небольших нарушений у его основания, чтобы вызвать большие изменения во всем веере. При действии тератогенных факторов в фетальном периоде возникают малые морфологические изменения, задержка роста и дифференцировки, недостаточность питания плода и другие функциональные нарушения. Статистика утверждает, что у 2.5% новорожденных регистрируются резко выраженные аномалии развития. Около 10% причин смерти детей после рождения обусловлено врожденной патологией.
У каждого органа есть свой критический период, во время которого его развитие может быть нарушено. Чувствительность различных органов к повреждающим воздействиям зависит от стадии эмбриогенеза к повреждающим факторам.
Факторы, оказывающие повреждающее воздействие, не всегда представляют собой чужеродные для организма вещества или воздействия. Это могут быть и закономерные действия среды, обеспечивающие обычное нормальное развитие, но в других концентрациях, с другой силой, в другое время. К ним относят кислород, питание, температуру, соседние клетки, гормоны, индукторы, давление, растяжение, электрический ток и проникающее излучение.
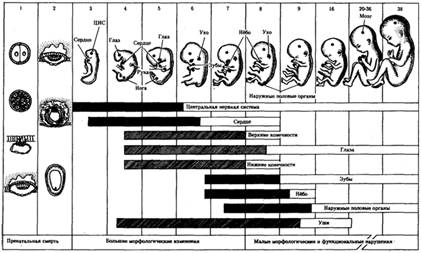
Рис.1.Чувствительность развивающегося зародыша человека
заштрихованным отрезком обозначен период наиболее высокой чувствительности;
незаштрихованным — период меньшей чувствительности;
1—38—недели внутриутробного развития
Классификация врожденных пороков развития
Врожденными пороками развития называют такие структурные нарушения, которые возникают до рождения (в пренатальном онтогенезе), выявляются сразу или через некоторое время после рождения и вызывают нарушение функции органа. Врожденные пороки развития являются причиной приблизительно 20% смертей в неонатальном периоде, а также занимают значительное место в практике акушерства и гинекологии, медицинской генетике детской хирургии и ортопедии, патологической анатомии. В связи с этим знания по вопросам профилактики, этиологии, патогенеза, лечения и прогнозирования врожденных пороков развития имеют большое значение.
Знакомство с закономерностями и механизмами нормального морфогенеза в процессе эмбрионального развития позволяет понять, какого рода нарушения могут привести к возникновению пороков. Кроме того, пороки развития представляют собой как бы природные эксперименты, обнаруживающие скрытые от глаз процессы. Примером могут служить такие врожденные пороки развития, которые напоминают некоторые черты строения, свойственные другим видам взрослых позвоночных животных или их зародышам. Они позволяют осознать теснейшую эволюционно-биологическую связь человека с животными и использовать ее для иллюстрации закономерностей макроэволюции, а также для формирования естественно исторического взгляда на возникновение и развитие человека.
Существует несколько различных критериев, на основе которых классифицируют врожденные пороки развития. Основные из них: причина, стадия, на которой проявляется воздействие, последовательность их возникновения в организме, распространенность и локализация.
В зависимости от причины все врожденные пороки развития делят на:
Ø наследственные
Ø экзогенные (средовые)
Ø мультифакториальные
Наследственными называют пороки, вызванные изменением генов или хромосом в гаметах родителей, в результате чего зигота с самого возникновения несет генную, хромосомную или геномную мутацию. Генетические факторы начинают проявляться в процессе онтогенеза последовательно, путем нарушения биохимических, субклеточных, клеточных, тканевых, органных и организменных процессов. Время проявления нарушений в онтогенезе может зависеть от времени вступления в активное состояние соответствующего мутированного гена, группы генов или хромосом. Последствия генетических нарушений зависят также от масштаба и времени проявления нарушений.
Экзогенными называют пороки, возникшие под влиянием тератогенных факторов (лекарственные препараты, пищевые добавки, вирусы, промышленные яды, алкоголь, табачный дым и др.), т.е. факторов внешней среды, которые, действуя во время эмбриогенеза, нарушают развитие тканей и органов.
Историческими вехами являются работы Ц. Стоккарта в начале XX в., впервые показавшего тератогенное действие алкоголя, и работы офтальмолога Н. Грегга, открывшего тератогенное действие вируса краснухи (1941). Очень страшное событие имело место в 1959—1961 гг., когда после применения беременными талидомида в ряде стран Запада родились несколько десятков тысяч детей с тяжелыми врожденными пороками.
Поскольку средовые экзогенные факторы в конечном итоге оказывают влияние на биохимические, субклеточные и клеточные процессы, механизмы возникновения врожденных пороков развития при их действии такие же, как при генетических причинах. В результате фенотипическое проявление экзогенных и генетических пороков бывает весьма сходным, что обозначается термином фенокопия. Для выявления истинных причин возникновения пороков в каждом конкретном случае следует привлекать множество различных подходов и критериев.
Мультифакториальными называют пороки, которые развиваются под влиянием как экзогенных, так и генетических факторов. Вероятно, скорее всего, бывает так, что экзогенные факторы нарушают наследственный аппарат в клетках развивающегося организма, а это приводит по цепочке ген — фермент — признак к фенокопиям. Кроме того, к этой группе относят все пороки развития, в отношении которых четко не выявлены генетические или средовые причины.
В зависимости от стадии, на которой проявляются генетические или экзогенные воздействия, все нарушения, происходящие в пренатальном онтогенезе, подразделяют на гаметопатии, бластопатии, эмбриопатии и фетопатии. Если нарушения развития на стадии зиготы (гаметопатия) или бластулы (бластопатия) очень грубые, то дальнейшее развитие, видимо, не идет и зародыш погибает. Эмбриопатии (нарушения, возникшие в период от 15 суток до 8 недель эмбрионального развития) как раз составляют основу врожденных пороков (врожденные пороки сердца, центральной нервной системы, органов пищеварения, пороки развития почек, врожденные пороки лица). Фетопатии (нарушения, возникшие после 10 недель эмбрионального развития) представляют собой такие патологические состояния, для которых, как правило, характерны не грубые морфологические нарушения, а отклонения общего типа: в виде снижения массы, задержки интеллектуального развития, различных функциональных нарушений. Очевидно, что наибольшее клиническое значение имеют эмбриопатии и фетопатии.
В зависимости от последовательности возникновения различают первичные и вторичные врожденные пороки. Первичные пороки обусловлены непосредственным действием тератогенного фактора, вторичные — являются осложнением первичных и всегда патогенетически с ними связаны. Выделение первичных пороков из комплекса нарушений, обнаруженных у пациента, имеет большое значение для медико-генетического прогноза, поскольку риск определяется по основному пороку.
По распространенности в организме первичные пороки подразделяют на изолированные, или одиночные, системные, т.е. в пределах одной системы, и множественные, т.е. в органах двух систем и более. Комплекс пороков, вызванный одной ошибкой морфогенеза, называют аномаладом.
По клеточным механизмам, которые преимущественно нарушены при том или ином врожденном пороке развития, можно выделить пороки, возникшие в результате нарушения размножения клеток, миграции клеток или органов, сортировки клеток, дифференцировки, а также гибели клеток. Нарушение перечисленных клеточных механизмов может привести к слишком малым или, наоборот, слишком большим размерам органов или их частей, к недостаточному или, напротив, очень сильному рассасыванию тканей в органах, к изменению положения отдельных клеток, тканей или органов относительно других органов и тканей, к нарушениям дифференцировки, так называемым дисплазиям.
По филогенетической значимости можно все врожденные пороки развития разделить на филогенетически обусловленные и не связанные филогенезом, т.е. нефилогенетические.
Филогенетически обусловленными называют такие пороки, которые по виду напоминают органы животных из типа Хордовые и подтипа Позвоночные. Если они напоминают органы предковых групп или их зародышей, то такие пороки называют анцестральными (предковыми) или атавистическими. Примерами могут служить несращение дужек позвонков, шейные и поясничные ребра, несращение твердого нёба, персистирование висцеральных дуг и др. Если пороки напоминают органы родственных современных или древних, но боковых ветвей животных, то их называют аллогенными. Филогенетически обусловленные пороки показывают генетическую связь человека с другими позвоночными, а также помогают понять механизмы возникновения пороков в ходе эмбрионального развития.
Нефилогенетическими являются такие врожденные пороки, которые не имеют аналогов у нормальных предковых или современных позвоночных животных. К таким порокам можно отнести, например, двойниковые уродства и эмбриональные опухоли, которые появляются в результате нарушения эмбриогенеза, не отражая филогенетических закономерностей.
Установление причины врожденных пороков имеет большое прогностическое значение для носителя этих пороков и профилактическое — в отношении последующего потомства. В настоящее время медицинские генетики и патологоанатомы существенно продвинулись в области так называемого синдромологического анализа. Синдромологический анализ — это обобщенный анализ фенотипа больных с целью выявления устойчивых сочетаний признаков. Овладение им помогает в установлении причины возникновения пороков и основных патогенетических механизмов.
Типы врожденных пороков развития
Принято выделять 4 типа врожденных пороков развития:
1. Мальформация - морфологический дефект органа, части органа, или большого участка тела в результате внутреннего нарушения процесса развития (генетические факторы)
2. Дизрупция - морфологический дефект органа, части органа или большого участка тела в результате внешнего препятствия или какого-либо воздействия на изначально нормальный процесс развития (тератогенные факторы и нарушение имплантации).
3. Деформация - нарушение формы, вида или положения части тела, обусловленные механическими воздействиями.
4. Дисплазия - нарушенная организация клеток в ткани и ее морфологический результат (процесс и следствие дисгистогенеза).
К врожденным порокам развития относят также следующие нарушения эмбрионального морфогенеза:
· Агенезия - полное врожденное отсутствие органа.
· Аплазия - врожденное отсутствие органа с сохранением его сосудистой ножки.
· Гипоплазия - недоразвитие органа с дефицитом его массы или размера более чем на 2 сегмента, отличающееся от средних для данного возраста показателей. При этом простая гипоплазия, в отличие от диспластической, не сопровождается нарушением структуры органа.
· Гипертрофия (гиперплазия) - врожденное увеличение массы и размеров органа за счет увеличения количества (гиперплазия) или объема (гипертрофия) клеток.
· Макросомия (гигантизм) - увеличение длины тела (или отдельных органов).
· Гетеротопия - присутствие клеток или тканей одного органа в тех зонах или даже в другом органе, где их быть не должно (островки хряща из бронхиальной стенки в легких).
· Гетероплазия - нарушение дифференцировки клеток в пределах ткани. Например, обнаружение клеток плоского эпителия пищевода в дивертикуле Меккеля.
· Эктопия - расположение органа в необычном для него месте (например, расположение сердца вне грудной клетки).
· Удвоение или увеличение в числе органа или его частей: полидактилия - увеличение числа пальцев, полиспления - наличие нескольких селезенок и т.д.
· Атрезия - отсутствие естественного канала или отверстия (атрезия пищевода, сильвиевого водопровода, ануса).
· Стеноз - сужение канала или отверстия.
· Неразделение (слияние) - органов или однояйцовых близнецов. Название пороков этой группы начинаются с приставки "syn" или "sym": синдактилия, симфалагизм.
· Персистирование - сохранение в органе эмбриональных структур.
· Дисхрония - нарушение темпов развития органа или его структур.
Заболевания, внутриутробная смерть плода
Гидроцефалия – водянка головного мозга - это избыточное накопление цереброспинальной жидкости, которая омывает головной и спинной мозг, в желудочках мозга. Количество жидкости бывает различным, иногда достигает 2-3 литров. Под влиянием накапливающейся жидкости головка увеличивается, швы расходятся, мозг подвергается атрофии от давления жидкости. Гидроцефалия может быть результатом порока развития или вызвано инфекцией (сифилисом, менингитом).
Анэнцефалия - отсутствие у плода свода черепа и большей части головного мозга, лицевая часть черепа достаточно развита; маленькая голова расположена непосредственно на плечевом поясе. Анэнцефалы рождаются мертвыми или умирают вскоре после рождения.
Мозговая грыжа – выпячивание мозга в области большого родничка, затылка или переносицы. Плод может рождаться живым, но обычно умирает в период новорожденности.
Волчья пасть – расщепление верхней губы, верхней челюсти и твердого неба. Расщепление вызывают хромосомные дефекты и аномалии развития.
Заячья губа – расщепление верхней (челюсти) губы. Эти аномалии не препятствуют правильному развитию ребенка. Они устраняются путем пластических операций.
Многопалость – больше чем обычно, число пальцев на руках и ногах. Добавочные пальчики иногда бывают плохо развиты.
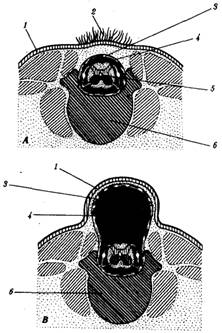
Различные варианты расщелины позвоночника как бы соответствуют очень древнему примитивному строению его у низших позвоночных. Скрытая расщелина позвоночника (spina bifida occulta) — это дефект в виде аплазии спинных дужек и остистых отростков (рис.2, А). Дужки позвонков при нормальном развитии образуются из мигрирующих клеток склеротомов под индуцирующим влиянием со стороны хорды, спинного мозга и спинномозговых узлов. При описываемом пороке происходит остановка их развития, что, вероятно, может быть связано с нарушением необходимых индуцирующих воздействий.
Скрытые формы расщелины первого крестцового позвонка встречаются среди людей с частотой около 10%, а первого шейного — с частотой около 3%. Как правило, спинной мозг и спинномозговые нервы не изменены и не имеется никаких серьезных нарушений. Кожа над дефектом также не изменена, но иногда порок можно заподозрить по небольшой ямочке или пучку волос над ним. Чаще всего дефект выявляется как рентгенологическая находка. О возможной наследственной природе порока свидетельствуют такие данные: скрытые формы расщелины дужек позвонков встречаются у 14,3% матерей, у 6,1 % отцов и у 26,8% сибсов пробандов с различными формами несращения нервной трубки и позвонков.
Более грубым пороком являются кистозная расщелина позвоночника (spina bifida cystia) и полный рахисхиз. Кистозная расщелина характеризуется наличием грыжевого мешка (рис.2, В, Г), а полный рахисхиз — дефектом мозговых оболочек, мягких покровов и лежащим открыто в виде пластинки или желоба спинным мозгом (рис.2, Б). В последнем случае нервные валики не соединяются в трубку либо из-за ослабления индуцирующего влияния подлежащей хорды, либо из-за действия тератогенных факторов на нейроэпителиальные клетки.
|
|
Рис.2. Различные варианты расщелины позвоночника. А — скрытая расщелина; Б —полный рахисхиз; В, Г — кистозная расщелина:
1—кожа, 2—пучок волос, 3—твердая мозговая оболочка, 4— субарахноидальное пространство, 5—спинной мозг, 6—тело позвонка, 7—открытая нервная пластинка, 8—спинной чувствительный узел
Пороки развития звукопроводящей системы среднего уха могут быть причиной врожденного нарушения слуха наряду с нарушениями других отделов слухового анализатора. Врожденная фиксация стремечка приводит к врожденной проводниковой глухоте при нормальном развитии уха в остальном. Дефекты молоточка и наковальни часто сочетаются с синдромом первой дуги. Механизмами возникновения подобных пороков развития могут быть нарушения рассасывания (гибели) молодой соединительной ткани в барабанной полости и остановка развития всей области первой висцеральной дуги. Большинство видов врожденной глухоты обусловлены генетически и носят наследственный характер.
Атрезия наружного слухового прохода возникает из-за ослабления процесса канализации (рассасывания пробки наружного слухового прохода) в области первого жаберного кармана. Этот врожденный порок также часто сочетается с синдромом первой дуги.
Пороки развития пищеварительной системы выражаются в недоразвитии (гипогенезия) или полном отсутствии развития (агенезия) участков кишечной трубки или ее производных, в отсутствии естественного отверстия, сужении канала, персистировании эмбриональных структур, незавершенном повороте и гетерогонии различных тканей в стенку желудочно-кишечного тракта.
Атрезии и стенозы встречаются с частотой примерно 0,8 на 1000 новорожденных. Существует несколько гипотез, объясняющих механизм их возникновения. По одной из них, это персистирование физиологической атрезии, заключающееся во временной закупорке просвета кишечной трубки на 6-й неделе развития в связи с нарушением реканализации. По другой — это сосудистая недостаточность. В эксперименте на собаках путем перевязки у плодов верхней брыжеечной артерии удалось получить некоторые формы атрезии и стеноз. Есть гипотеза внутриутробного воспалительного процесса. Этиология этих пороков гетерогенна. Среди изолированных пороков, по-видимому, большинство мультифакториальны, а среди тех, что являются компонентами множественных врожденных пороков, значительная часть — результат хромосомных и генных мутаций.
Одним из распространенных врожденных пороков средней кишки является незаращение проксимального отрезка внутрибрюшной части желточного протока и выпячивание стенки подвздошной кишки длиной от 1 до 15 см на расстоянии 10—25 см у детей и 40—80 см у взрослых от подвздошно-слепокишечной заслонки. Этот порок получил название дивертикула Меккеля (по имени исследователя). Он обнаруживается примерно у 2% населения (из них в 80% случаев у мужчин). В половине случаев он диагностируется случайно, а в остальных случаях — в связи с воспалительными процессами, непроходимостью и кровотечениями кишечника. В 10% случаев дивертикул Меккеля сочетается с другими врожденными пороками. Некоторые варианты пороков эмбриональных структур желточного протока показаны на рис.3.
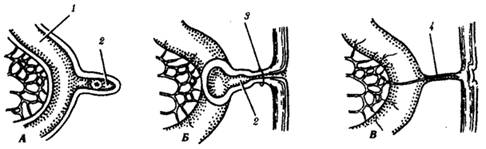
Рис. 3. Различные варианты остатков желточного протока.
А—дивертикул Меккеля; Б—пупочно-подвздошный свищ (персистирование желточного протока); В—фиброзный шнур, соединяющий подвздошную кишку с пупком:
1—подвздошная кишка, 2—дивертикул Меккеля, 3—пупочно-подвздошный свищ, 4— фиброзный шнур
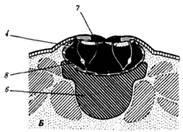
Из многочисленных вариантов врожденных пороков прямой кишки и анального отверстия отметим персистирование клоаки (рис.4), возникающее в результате нарушения разделения клоаки на мочеполовой синус и прямую кишку. Этот порок представляет собой недоразвитие мочеполовой перегородки и отражает эволюционно более древнее состояние органа.
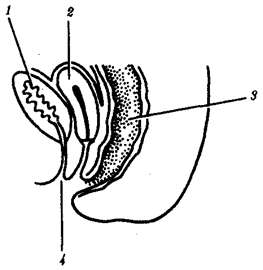
Рис. 4.Персистирование клоаки:
1—мочевой пузырь, 2—матка, прямая кишка, 4—клоака
Врожденные пороки сердечно-сосудистой системы насчитывают десятки разновидностей. Частота встречаемости — 10 на 1000 новорожденных. Пороки сердечно-сосудистой системы бывают изолированными и в сочетании с пороками других систем, т.е. множественными пороками. Изолированные пороки чаще мультифакториальные, но известны также доминантные и рецессивные формы. Среди пороков, входящих в группу множественных, поражение сердечно-сосудистой системы часто сопровождается хромосомными и генными синдромами. Пороки сердечно-сосудистой системы в основном представляют собой либо недоразвитие каких-либо структур в эмбриогенезе, либо персистирование этих эмбриональных структур, в то время как они должны видоизменяться и принять дефинитивный вид. Иногда встречаются грубые нарушения топографии сердца и сосудов. Цитологическими механизмами, как и в случаях других пороков развития, служат, видимо, нарушения индукционных взаимодействий, размножения, миграции, адгезии или избирательной гибели клеток.
Примеры некоторых врожденных пороков сердца и крупных артерий: Эктопия сердца — расположение сердца вне грудной полости. Различают шейную, абдоминальную и экстрастернальную эктопию. Шейную эктопию объясняют задержкой перемещения сердца с места формирования его зачатка в шейной области в переднее средостение. Этот порок приводит к гибели сразу после рождения. Он отражает онтофилогенетическую зависимость.
Правосторонняя дуга аорты развивается из эмбриональной правой дуги при редукции левой, или двойные дуги аорты, представленные двумя стволами, из которых один впереди трахеи, а другой позади пищевода. При изолированных пороках такого типа клинические проявления зависят от степени сдавления пищевода и трахеи. Оба связаны с нарушениями дифференцировки эмбриональных артериальных дуг.
Открытый артериальный (боталлов) проток (персистирование артериального протока) встречается с частотой около 1 на 1000 новорожденных.
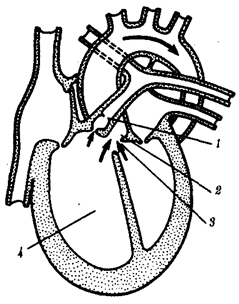
Рис.5. Фронтальный срез сердца с тетрадой Фалло:
1—стеноз легочного ствола. 2—транспозиция аорты, 3—дефект межжелудочковой перегородки, 4—гипертрофия правого желудочка; стрелками показано направление движения крови
Тетрада Фалло — стеноз легочного ствола, высокий дефект межжелудочковой перегородки, правосмещение устья аорты и приобретенная гипертрофия правого желудочка. Порок возникает в результате праводеленности артериального конуса и неслияния всех компонентов, образующих межжелудочковую перегородку. Частота — 0,7 на 1000 новорожденных, прогноз неблагоприятный (рис.5).
Сросшиеся двойни – срастание, вернее неполное расщепление, близнецов – может возникнуть моноамниотических двойнях. Срастание плодов может быть в области грудной клетки, живота, ягодиц. В результате неполного расщепления зародышевого зачатка возникают уродства, характеризующиеся удвоениями разных отделов тела (две головы при одном туловище, два туловища при одной голове и т.д.). При рождении сросшихся двоен обычно возникают непреодолимые трудности, требующие применения оперативной помощи.
Встречаются пороки развития глаз (циклоп), конечностей (отсутствие конечностей – фокомелии, сросшиеся нижние конечности – сирены), половых органов, ССС и др.
Литература
1. Ярыгина В.Н., Васильева В.И., Волков И.Н., Синельщикова В.В. Биология. 5-е изд., испр. и доп. - М.: Высшая школа, 2003;
2. Патологическая анатомия болезней плода и ребенка. /Под ред. Ивановской Т.Е., Леоновой Л.В. - М., Медицина. - 1989.
3. Бандажевский Ю.И. Иммунная регуляция онтогенеза. - Гомель. - 1994.
4. Хлыстова З.С. Становление системы иммуногенеза плода человека. - Москва. - Медицина. - 1987.