Получение уксусной кислоты
1. Литературный обзор
1.1 Свойства и применение ацетальдегида
Ацетальдегид (этаналь, уксусный альдегид) СНзСНО представляет собой бесцветную легкокипящую жидкость с резким удушливым запахом, с температурой кипения 20,2°С, температурой замерзания -123,5 °С и плотностью 783 кг/м3. Критическая температура ацетальдегида 188 °С, температура самовоспламенения 156°С. С воздухом ацетальдегид образует взрывчатые смеси с пределами воспламеняемости при 400°С 3,97 и 57,0% об. Смеси с кислородом воспламеняются при более низкой температуре - около 140 °С. Токсичен, пары ацетальдегида вызывают раздражении слизистых оболочек удушье, головную боль, ПДК составляет 5 мг/м3. Относится к 3-му классу опасности.
Ацетальдегид смешивается во всех отношениях с водой, этанолом, диэтиловым эфиром и другими органическими растворителями, с некоторыми образует азеотропные смеси.(1, с. 299 ).
Ацетальдегид - это один из важнейших многотоннажных продуктов переработки ацетилена и этилена. Он применяется в широких масштабах в промышленности органического синтеза. Важнейшие направления использования ацетальдегида:
o окисление в уксусную кислоту и уксусный ангидрид;
o получение циангидрина с последующей переработкой его в акрилонитрил, эфиры акриловой кислоты, молочную кислоту;
o альдольная конденсация и переработка альдоля в бутандиол-1,3 и бутадиен-1,3, н-бутанол, кротоновый альдегид;
o конденсация с аммиаком с образованием гомологов пиридина и винилпиридинов;
o конденсация с формальдегидом до пентаэритрита.
В настоящее время на производство уксусной кислоты и ее ангидрида, этилацетата и 2-этилгексанола расходуется в мире 95%, а в нашей стране 75% всего производимого ацетальдегида. (1, с. 300)
Помимо этого ацетальдегид или его триммер паральдегид применяют в производстве ацетатов целлюлозы, пероксиуксусной кислоты, этилацетата, глиоксаля, 2-этилгексанола, алкиламинов, алкилпиридинов, хлораля; как восстановитель применяется в производстве зеркал.(2, с.224)
1.2 Методы получения ацетальдегида
Известен ряд методов получения ацетальдегида. Рассмотрим эти методы.
1.2.1 Получение ацетальдегида гидратацией ацетилена на ртутных катализаторах
Реакция гидратации ацетилена на ртутных катализаторах была открыта М.Г. Кучеровым в 1881 г. и использовалась в промышленности с целью получения ацетальдегида более 60 лет:
![]()
Реакция сильно экзотермична. До 300 °С она практически необратима, но с дальнейшим ростом температуры равновесие смещается в сторону разложения ацетальдегида. Она протекает в нужном направлении с приемлемой скоростью в присутствии катализаторного раствора (10-20%-ная H2SO4, содержащая 0,5-0,6% HgO в виде HgSO4). Реакция протекает через промежуточное образование комплекса ацетилена с Hg2+. Дальнейшее его разложение приводит к образованию ацетальдегида(3, с.440):
Скорость реакции увеличивается с повышением концентрации H2SO4 и температуры процесса, однако при этом возрастает и выход побочных продуктов, прежде всего за счет кротоновой конденсации с образованием кротонового альдегида: и альдольной конденсации с образованием смол (в том числе и с последующей полимеризацией кротонового альдегида).

![]()
С целью сокращения образования побочных продуктов в реакционную зону подается избыток ацетилена, с которым получающийся ацетальдегид уносится из зоны реакции. Это приводит и к увеличению производительности установки. Вместе с тем подача в избытке ацетилена приводит к уменьшению выхода ацетальдегида за один проход через катализаторный раствор и увеличению рециркуляционных потоков. Конверсия ацетилена в ацетальдегид за один проход составляет 30-50 %.
Ацетальдегид является сильным восстановителем. В данном случае в его присутствии Hg2+ вначале восстанавливается до Hg+, а затем до металлической ртути:
![]()
в результате образуется ртутный шлам. Восстановителями также могут выступать H2S, РН3 и др. Этот процесс является крайне нежелательным, поскольку металлическая ртуть имеет высокое давление насыщенных паров, которые уносятся с реакционными газами, дезактивируя катализатор и загрязняя окружающую среду. Для предотвращения восстановления ртути в катализаторный раствор добавляют соли трехвалентного железа (в избытке по сравнению с солями ртути). Этим обеспечивается протекание реакции
Fe3+ + Hg+![]() Fe2+ + Hg2+
Fe2+ + Hg2+
поддерживающей ртуть в максимальной степени окисления.
Соль железа добавляют в избытке по отношению к ртути (~4%: в расчете на Fe2O3), поэтому катализаторный раствор работает достаточно длительное время. Однако в нем постепенно накапливаются соли двухвалентного железа, и раствор направляют на регенерацию, состоящую в окислении азотной кислотой. Несмотря на все эти мероприятия, ртуть все же теряется в виде шлама вместе с продуктами осмоления. Ее расход составляет 1-1,5 кг на 1 т ацетальдегида.(4, с. 195)
В промышленности процесс проводят при температуре 75-100 °С, пропуская ацетилен через водный катализаторный раствор. При 50 % конверсии ацетилена выход альдегида составляет 92-93% от прореагировавшего ацетилена. Основную реакцию осуществляют в полой футерованной колонне, заполненной катализаторным раствором и имеющей расширение в верхней части (заполненной насадкой).(3, с. 442)
Большим недостатком процесса синтеза ацетальдегида по Кучерову является необходимость применения дорогостоящей и весьма токсичной металлической ртути и ее соединений. Металлическая ртуть летуча; несмотря на высокую температуру кипения (357°С), она испаряется уже при комнатной температуре. При повышенной температуре в условиях процесса гидратации ртуть проникает почти во все аппараты установки и в получаемые продукты. Следствием этого являются значительные потери ртути и возможность профессиональных заболеваний у обслуживающего персонала.(5, с. 489)
Вместе с тем этот способ обладает многими преимуществами, которые могут быть успешно реализованы в других технологиях. В частности, этот процесс является одностадийным, обладает хорошей селективностью, может обеспечить одновременное получение двух целевых продуктов (ацетальдегид и кротоновый альдегид). Кроме того, реактор обеспечивает не только проведение собственно реакции, но и отделение продуктов от катализаторного раствора. Эффективное применение рециркуляции как по воде, так и ацетилену обеспечивает не только полное использование сырья, но и служит для подавления побочных реакций, повышая выход целевого продукта. Все это делает процесс достаточно привлекательным, однако высокотоксичная каталитическая система делает его бесперспективным.(3, с. 446)
1.2.2 Получение ацетальдегида гидратацией ацетилена в паровой фазе
Для этого процесса в качестве катализатора предлагались различные оксиды металлов и соли, в том числе фосфаты, вольфраматы, ванадаты, молибдаты, хроматы. Наибольшую активность и стабильность показал кадмийкальцийфосфатный катализатор, разработанный Ю.А.Гориным и С. М. Момозоном, состава CdHPO4•Ca3(PO4)2, обладающий кислотными свойствами. Этот катализатор активен при 350-400 °С, регенерируется воздухом и водяным паром при 400-450°С (3, с. 446), не токсичен, однако быстро теряет активность и требует регенерации через каждые 100 часов работы.
Гидратация ацетилена в паровой фазе представляет гетерогенно-каталитическую экзотермическую реакцию, протекающую по уравнению:
С2Н2 + Н2О = СНзСНО ΔН = –162,8 кДж
Реакция гидратации протекает через образование промежуточного комплекса ацетилена с ионом кадмия, который затем разлагается с образованием ацетальдегида:
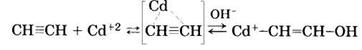
Одновременно с основной реакцией гидратации протекают побочные реакции дезактивации катализатора за счет его восстановления:
![]()
кротоновой конденсации:
![]()
и реакции последующего смолообразования.
При парофазной гидратации удаление ацетальдегида по мере его образования невозможно, а накопление его в реакционной зоне увеличивает вероятность побочных реакций, особенно кротоновой конденсации. Для подавления побочных реакций необходимо устранение местных перегревов, при которых развивается реакция кротоновой конденсации, имеющая более высокую энергию активации, применение избытка водяного пара, способствующего выводу ацетальдегида из сферы реакции, и проведение процесса при невысокой степени конверсии ацетилена.
Поэтому, процесс парофазной гидратации ацетилена проводят при объемном отношении водяного пара к ацетилену (7- 10): 1 и степени конверсии не выше 0,5. Образующийся ацетальдегид сорбируется из реакционной смеси водой. В этих условиях выход ацетальдегида чистотой до 99,5% мас. достигает 90%. В качестве побочных продуктов образуется 0,5-1,0% кротонового альдегида, 0,5-1,0% уксусной кислоты и 0,3% ацетона.(1, с. 302)
Активность катализатора снижается вследствие образования смолистых продуктов и зауглероживания. Поэтому к концу цикла (через 70-100 час) температуру увеличивают до 400-410°С, после чего катализатор подвергают регенерации.
Непрореагировавший ацетилен возвращается на синтез, 15- 20% ацетилена отводят для очистки от инертных газов. Продукты, выходящие из реактора, конденсируют, отгоняют от воды и подвергают ректификации. В итоге получается 99,5%-ный ацетальдегид и 85%-ный кротоновый альдегид в виде азеотропа с водой.
Вместе с тем этот процесс не нашел широкого распространения из-за небольшого срока службы катализатора без регенерации, его низкой механической прочности, токсичности (из-за наличия кадмия). С точки зрения принципов создания безотходных производств в нем плохо используется тепло реакции.(3, с. 446)
1.2.3 Получение ацетальдегида из ацетилена через бутилвиниловый эфир
Производство ацетальдегида из ацетилена этим методомпредставляет двухстадийный процесс винилирования н-бутанола ацетиленом с образованием винилбутилового эфира (ВБЭ):
С2Н2 + С4Н9ОН ![]() СН2=СН–О–С4Н9
СН2=СН–О–С4Н9
и последующего гидролиза ВБЭ:
СН2=СН–О–С4Н9 + Н2О ![]() СН3СНО + С4Н9ОН
СН3СНО + С4Н9ОН
Таким образом, в этом процессе бутанол находится в рецикле и добавляется только для пополнения производственных потерь, а на получение ацетальдегида расходуется только ацетилен.
Реакция винилирования протекает в присутствии гидроксида калия при температуре 400-440°С. Конверсия ацетилена составляет 0,6-0,8 при расходном коэффициенте по ацетилену 0,39-0,5 т/т ВБЭ. Реакционная смесь, содержащая 75- 80% ВБЭ, около 20% непрореагировавшего бутанола, воду и легкую фракцию, перед гидролизом разделяется методами ректификации или экстракции. На гидролиз направляется фракция, содержащая 99,5% винилбутилового эфира.
Реакция гидролиза ВБЭ протекает в парожидкостной среде при температуре, близкой к температуре кипения смеси «ВБЭ-вода», в присутствии катионнообменного катализатора КУ-2ФПП, который обеспечивает степень конверсии ВБЭ, близкую к единице. В результате гидролиза образуется система «ацетальдегид-вода-бутанол», из которой ректификацией выделяется целевой продукт - ацетальдегид, а бутанол возвращается в процесс.(1, с.304)
1.2.4 Получение ацетальдегида окислительным дегидрированием этилового спирта
При окислительном дегидрировании этилового спирта протекают последовательно две реакции:
CH3 – CH2–OH ![]() CH3–CHO + H2 ΔН=15 ккал
CH3–CHO + H2 ΔН=15 ккал
H2 + 0,5O2 ![]() H2O ΔН= –58 ккал
H2O ΔН= –58 ккал
Для уменьшения теплового эффекта процесса вводят меньше воздуха. Например, спирт можно смешивать с воздухом в отношении 1 : 1,1, что соответствует расходу кислорода 44% от теоретического. При пропускании такой смеси над серебряным катализатором при 450-550°С очень интенсивно протекает дегидрирование этилового спирта и выходящий из контактного аппарата газ содержит 10% водорода.(5, с.491)
1.2.5 Получение ацетальдегида дегидрированием этилового спирта
При каталитическом дегидрировании этилового спирта образуется уксусный альдегид:
CH3 – CH2–OH ![]() CH3–CHO + H2
CH3–CHO + H2
При получении ацетальдегида этим методом применяют медные или медно-цинковые катализаторы. Медь для данного процесса является высокоактивным катализатором, но она быстро теряет активность. Хорошим стойким катализатором является медь с добавками 5% оксида кобальта и 2% оксида хрома, нанесенная на асбест. В присутствии этого катализатора процесс можно проводить при сравнительно низких температурах (275-300° С). Степень превращения спирта в этих условиях составляет 33-50% за один проход через катализатор.
Достоинством процесса дегидрирования спирта по сравнению с процессом окислительного дегидрирования является относительно малое образование побочных продуктов и высокое содержание ацетальдегида в контактных газах. Контактные газы процесса дегидрирования в основном состоят из паров ацетальдегида и водорода (примерно 1 : 1), в то время как контактные газы окисления спирта разбавлены азотом, вводимым с воздухом. Поэтому выделение ацетальдегида из контактных газов дегидрирования спирта легче и сопряжено с меньшими потерями альдегида. Кроме того, при дегидрировании этилового спирта образуется ценный побочный продукт– этилацетат (9-10% от количества ацетальдегида).(5, с. 492)
1.2.6 Получение ацетальдегида окислением этилена
Образование ацетальдегида при взаимодействии этилена с водным раствором хлористого палладия наблюдал Филлипс ещё в 1894 г. Образующийся в безводной среде комплекс этилена с хлористым палладием был описан Карашем в 1938 г. При взаимодействии палладиевого комплекса с водой происходит окисление активированного олефина с образованием ацетальдегида, выделением палладия и хлорида водорода. (6, с.302)
Непрерывный процесс получения ацетальдегида, в котором восстановление до металлического Pd совмещается с непрерывным его окислением кислородом воздуха, был предложен в 1959 г. Я. К. Сыркиным, И.И. Моисеевыми, М.Н. Варгафтиком. Этот процесс может протекать в одну стадию (в одном аппарате происходит как окисление этилена, так и выделяющегося палладия) или в две стадии: окисление (карбонилирование) олефина через стадию образования активного комплекса и восстановление Pd протекает в одном аппарате, а окисление металлического Pd - в другом:
CH2=CH2 +PdCl2 + H2O![]() CH3CHO + Pd + 2HCl
CH3CHO + Pd + 2HCl
Pd + 2HCl + 0,5O2 ![]() PdCl2 + H2O
PdCl2 + H2O
В первом (одностадийном) варианте условия процесса и соотношение реагентов должны быть такими, чтобы скорости окисления этилена и Pd были одинаковыми (или последняя выше). Вместе с тем скорость второй реакции значительно ниже, чем первой, поэтому активность катализатора в таком варианте процесса быстро падает.
Для повышения скорости окисления Pd были предложены промоторы (это главное достижение в промышленной реализации данного процесса) – соли меди или железа в среде хлороводородной кислоты, играющие роль переносчиков кислорода, окисляя палладий, медь или железо, восстанавливаются по реакциям:
Pd + 2HCl + 0,5O2![]() PdCl2 + H2O
PdCl2 + H2O
Cu2Cl2 + 2HCl + 0,5O2![]() 2CuCl2 + H2O
2CuCl2 + H2O
или Pd + 2FeCl3 ![]() PdCl2 + 2FeCl2
PdCl2 + 2FeCl2
2FeCl2 + 2HCl + 0,5O2 ![]() 2FeCl3 + H2O
2FeCl3 + H2O
Соли Cu2Cl2 и FeCl2 легко окисляются кислородом воздуха, при этом металл переходит в свое исходное высшее валентное состояние. Следовательно, совмещение этих реакций создает предпосылки для осуществления в промышленном масштабе получения ацетальдегида прямым окислением этилена молекулярным кислородом.(3, с. 455)
При этом, если процесс осуществляется в одном аппарате, то во избежание разбавления непрореагировавшего этилена окисление необходимо проводить чистым кислородом. Избыток же этилена вводится как с целью быстрого вывода ацетальдегида из зоны реакции, так и для создания соотношения компонентов за пределами взрывоопасных концентраций. В случае двухстадийного процесса (когда реакции получения ацетальдегида и окисления Pd проходят в одном аппарате, а окисление Сu2С12 или FeCl2 – в другом) можно использовать кислород воздуха, так как подача этилена и воздуха разделена.
Суммарная реакция образования ацетальдегида сопровождается выделением значительного количества тепла:
СН2 = СН2 + 0,5О2![]() СН3СНО, ΔН = –221,5 кДж/моль
СН3СНО, ΔН = –221,5 кДж/моль
Скорость отдельных реакций и, соответственно, скорость образования побочных продуктов зависит от условий проведения процесса. На скорость суммарной реакции, селективность процесса и выход ацетальдегида существенно влияет состав катализаторного раствора (содержание PdCl2, CuCl2 и FeCl2), кислотность среды, давление, температура, соотношение этилена и окисляющего агента.
Соотношение между общим суммарным содержанием металлов окислительно-восстановительной системы (Сu, Fe или смеси) и Pd должно быть не меньше 15:1. На практике используется соотношение (25 :1)-(50:1). Такой избыток меди или железа обусловливается высокой стоимостью Pd.
Конверсия олефина зависит также от мольного соотношения в катализаторе меди (железа) и галогена; оно поддерживается в узком диапазоне (1:1,4-1:1,8). Поэтому добавляемый в ходе процесса галоген в виде хлорида или этилхлорида должен дозироваться достаточно точно, так как при соотношении меньшем, чем 1:1, снижается конверсия этилена, а при соотношении 1;2 и выше реакция замедляется. В этом случае добавляют ацетат меди (3, с. 457).
Процесс следует проводить в кислой (рН=0,8-3,0) или нейтральной среде (рН= 6,0-7,5), так как при повышении рН из катализаторного раствора будет выпадать хлорид меди (I), что приводит к снижению выхода ацетальдегида и забивки отверстий газораспределительного устройства. Растворимость хлорида Сu(I) можно повысить добавлением в катализаторный раствор муравьиной, уксусной, а лучше - трихлоруксусной кислоты. Однако их следует добавлять в незначительном количестве (особенно уксусную кислоту), так как карбоновые кислоты образуют с Сu малоактивные соли. Кроме того, уксусная кислота растворяет продукты синтеза, что приводит к образованию побочных хлорированных продуктов.
Растворимость солей в воде ограничена, поэтому образуются разбавленные растворы катализатора, что приводит к его низкой удельной производительности. В связи с этим выгоднее работать с катализатором, находящимся в виде суспензии в воде или в разбавленной уксусной кислоте (шламовый катализатор). Применение шламового катализатора позволяет сочетать высокую концентрацию катализатора с хорошим отводом тепла; образовывать стабильную пену, что в свою очередь приводит к хорошему диспергированию газа.
В качестве сырья можно использовать как концентрированный этилен, так и этан-этиленовую фракцию. Наличие малых количеств водорода, оксида и диоксида углерода, предельных углеводородов не мешает протеканию процесса. Содержание непредельных углеводородов и серы должно быть незначительным (ацетилена <0,005 %, высших олефинов <0,03 %, серы <0,001 %) во избежание образования побочных продуктов.
Превращение этилена в ацетальдегид при 20 °С протекает с низкой скоростью. Реакция проходит сравнительно интенсивно при 100-130°С.
Для поддержания реакционной массы в жидком состоянии при такой температуре требуется повышенное давление (0,3-1,1 МПа), которое способствует и ускорению процесса за счет улучшения растворимости газов. Для повышения растворимости олефина и кислорода в водных растворах рекомендуется применять реакционные устройства, в которых осуществляется турбулизация жидкости и обеспечивается максимальная поверхность контакта фаз.(3, с. 458)
Для полного окисления олефинов в соответствующие альдегиды или кетоны мольное соотношение олефины:кислород должно составлять 2 :1. С целью безопасности работают обычно с недостатком кислорода (соотношение олефин:кислород от 2,5:1 до 4:1).
Во избежание побочных реакций (конденсации и хлорирования) предусматривается непрерывный отвод ацетальдегида из зоны реакции по мере его образования.
Выход ацетальдегида в зависимости от условий проведения реакций и состава катализатора колеблется в пределах 84-98%. При этом в качестве побочных продуктов образуются уксусная и муравьиная кислоты, хлорсодержащие вещества (метилхлорид, этилхлорид, хлорацетальдегид), кротоновый альдегид, диоксид углерода и др.
Процесс прямого окисления этилена в ацетальдегид может осуществляться как с использованием жидкого катализаторного раствора (гомогенно-каталитический процесс), так и на твердом катализаторе (гетерогенно-каталитический процесс). При гомогенном процессе хорошие результаты получаются при использовании водного раствора, содержащего 0,3-0,5% PdCl2, 12-33% СuС12•Н2О, 2-3% Сu(СН3СОО)2•Н2О. В небольших количествах иногда добавляется уксусная кислота.
Гетерогенный процесс может проводиться на катализаторе, представляющем смесь хлоридов Pd и Сu на носителе (оксид алюминия, силикагель, пемза, активированный уголь), например может использоваться катализатор следующего состава: 2% PdCl2 и 10% СuС12, нанесенные на активированный уголь. Гетерогенно-каталитический процесс может осуществляться как на катализаторе с неподвижным слоем (в трубчатом аппарате и в колонном аппарате с катализатором на полках), так и на катализаторе в псевдоожиженном состоянии. Гетерогенно-каталитический процесс сопряжен с трудностями, связанными с отводом теплоты реакции, но они могут быть устранены. В частности, одним из вариантов может быть отвод тепла за счет испарения впрыскиваемого между слоями катализатора водного конденсата. Однако это дает дополнительное количество загрязненной воды, требующей очистки. Поэтому лучше отводить тепло в обычном трубчатом аппарате, выполняющем одновременно роль котла-утилизатора.(3, с. 459)
Таким образом, в одностадийном способе процесс проводится при температуре 90-100°С и давлении 1 МПа, а в двухстадийном - окисление этилена проводится при температуре 100-120°С и давлении 0,8-1,3 МПа. Конверсия этилена в одностадийном способе за один проход составляет 30-50% (остальное возвращается в реактор в виде рецикла), выход ацетальдегида на пропущенный этилен в двухстадийном способе составляет 95 % (дополнительно образуется 1,0-1,5% уксусной кислоты и 1,0-1,3% хлорпроизводных).
Основное различие двух вариантов процесса состоит в том, что конверсия этилена за один проход при двухстадийном способе составляет около 100 % и, следовательно, не требуется его рециркуляция. В двухстадийном варианте может использоваться менее чистый этилен, чем в одностадийном. В первом случае требования по технике безопасности менее жесткие, однако двухстадийный способ требует больших капитальных затрат.(3, с. 460)
1.2.7 Новое в области синтеза ацетальдегида
Изложенные выше методы давно уже применяются на практике. Тем не менее, наука и технология не стоят на месте, постоянно происходит совершенствование старых методов и открытие новых. В данном разделе будет рассмотрено то, что появилось за последние годы в области синтеза уксусного альдегида.
Разработано и предложено достаточно большое количество альтернативных методов синтеза ацетальдегида. Так описан метод получения ацетальдегида взаимодействием водорода и кетена в присутствии катализатора, содержащего металл, выбранный из IX и X группы периодической системы.
CH2=C=O + H2 ![]() CH3CHO
CH3CHO
Процесс проводится при температуре 50-200°С. Рассмотрены способы выделения ацетальдегида из реакционной смеси (7).
Исследована возможность получения ацетальдегида окислением н-бутанола кислородсодержащим газом в присутствии гетерогенного катализатора, в качестве которого используется гранулированный ортофосфат железа с размерами гранул 1-2 мм:
СН3 – СН2 – СН2 – СН2 – ОН + О2![]() 2СН3СНО + Н2О
2СН3СНО + Н2О
Процесс проводится при температуре 380-420°С, время контакта 0,8-1 с. Так при температуре 400°С и времени контакта 0,87 с, пропуская смесь 20% н-бутана, 20% кислорода и 60% кислорода селективность процесса достигала 63%.(8)
Рассмотрен процесс превращения этиленгликоля в ацетальдегид. Предложены возможные варианты механизма этого процесса (9).
СН2 – ОН ![]() СН3СНО + Н2О
СН3СНО + Н2О
СН2 – ОН
Предложен метод получения ацетальдегида селективным гидрированием уксусной кислоты на катализаторе α-Fe2O3, нанесённом на основу SBN-15.
СН3СООН + Н2 ![]() СН3СНО + Н2О
СН3СНО + Н2О
Получена серия катализаторов, содержащих 20-60% α-Fe2O3. Рассмотрен механизм процесса, изучены активность и селективность образцов катализатора (10).
В области совершенствования уже используемых методов синтеза ацетальдегида следует упомянуть следующее.
При окислении этанола в ацетальдегид в качестве катализатора были предложены СаО и γ-Al2O3. Было рассмотрено влияние концентрации кислорода на выход ацетальдегида(11). Для этого метода были также предложены катализаторы на основе родия (12).
На основе анализа факторов, влияющих на каталитическое окисление этилена кислородом в растворе PdCl2 и CuCl2, была разработана математическая модель технологического процесса производства ацетальдегида. Это позволило оптимизировать рабочие параметры и увеличить на 127% степень загрузки завода по производству ацетальдегида по сравнению с проектной мощностью(13).
Одним из перспективных методов синтеза ацетальдегида рассматривается гидролиз винилбутилового эфира. Предложен способ с непрерывным совмещённым реакционно-ректификационным процессом получения ацетальдегида гидролизом винилбутилового эфира. То есть в ректификационной колонне одновременно происходит синтез и отделение ацетальдегида. При температуре 72-85°С, соотношении эфир : вода 1:3 (моль) выход ацетальдегида составил 99% (14).
Выводы. Из рассмотренных методов получения ацетальдегида наиболее удобен метод окисления этилена в водном растворе хлорида палладия. Процесс проходит с высоким выходом ацетальдегида (до 98%). Этилен является относительно дешёвым и доступным сырьём. В процессе производства не используются ядовитые вещества, такие как ртуть при гидратации ацетилена. Аппаратное оформление процесса достаточно простое и требует относительно небольших капитальных затрат. Себестоимость ацетальдегида, произведённого из этилена почти вдвое ниже себестоимости продукта, получаемого гидратацией ацетилена. Поэтому в качестве метода получения и выбран именно этот метод.
1.3 Анализ основной реакции
Процесс окисления ацетальдегида в ацетилен протекает согласно следующему уравнению химической реакции:
СН2 = СН2 + 0,5О2![]() СН3СНО
СН3СНО
1.3.1Физические свойства реагентов и продуктов реакции
В следующей таблице приведены основные физические свойства реагентов и продуктов реакции(15):
| Вещество | Фазовое состояние | Плотность, кг/м3 | Ткип /Тпл, °С | Примечание |
| Ацетальдегид | жидкость | 773 | 20,8 / -123,5 | Токсичен, ПДК составляет 5 мг/м3. Неограниченно растворим в воде. |
| Этилен | газ | 1,26 | -103,7/-169,15 | |
| Кислород | газ | 1,43 | -182,98/-218,7 |
1.3.2 Электронная структура реагентов и продуктов реакции
1.3.2.1.Электронная структура этилена
Главным структурным элементом, определяющим реакционную способность этилена, как и всех олефинов, является двойная связь, представляющая собой сочетание σ- и π-связей ( sp2 -гибридизация).
При образовании двойных связей в молекулах ненасыщенных соединений встречают с гибридизацию одной s- и двух р-орбиталей углерода с образованием трех эквивалентных гибридных орбиталей, называемую sp2-орбиталями. Каждая из них имеет цилиндрическую симметрию относительно одной из трех осей, расположенных в плоскости под углом 120°, В реальной молекуле этилена угол Н-С-Н равен 116,7°(16, с.30).
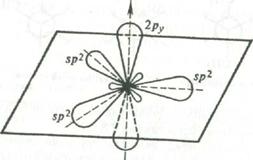
Рис. 1 Схема образования sp2-гибридного состояния электронной оболочки атома углерода
Ось четвертой атомной р-орбитали, не затронутой гибридизацией, расположена под прямым углом к плоскости, в которой лежат три оси sp2-гибридных орбиталей.
Перекрывание трех гибридизованных орбиталей с орбиталями других атомов дает σ-связи. Перекрывание двух негибридизованных p-орбиталей между собой дает так называемую π-связь.
π-Связь менее прочна, чем σ-связь, так как p-электронные орбитали с параллельными осями перекрываются значительно меньше, чем при образовании теми же p-электронами или s-электронами σ -связи (перекрывание по оси орбиталей). Общая прочность (σ + π)-связей в этилене составляет 607,1 кДж/моль, в то время как для σ -связи между двумя углеродными атомами в этане она составляет 350,0 кДж/моль. Разница 257,1 кДж/моль является приблизительной мерой прочности π -связи.
Таким образом, двойная связь представляет собой сочетание σ- и π-связей. Последняя обладает максимальной прочностью, когда молекула имеет пленарную (плоскостную) конфигурацию. Для поворота в молекуле этилена одной группы СН2 относительно другой группы СН2 вокруг оси С - С необходимо приложить энергию, достаточную, чтобы разорвать π-связь и вернуть два электрона на отдельные p-орбитали. Энергия молекулярных столкновений при обычной температуре для этого недостаточна и потому вокруг двойной связи нет свободного вращения(16, с. 31).

Рис.2 Схематическое изображение строения молекулы этилена
Длина олефиновой связи (σ + π-связь) между двумя ненасыщенными углеродами в алкенах меньше, чем длина простой σ-связи в насыщенных углеводородах (0,154 нм), и составляет 0,134 нм. Это понятно: чем больше концентрируется электронное облако между ядрами, тем более сильно они стягиваются.
При сравнении структурных и энергетических параметров молекул алканов и алкенов видно, что двойная связь значительно короче и прочнее ординарной связи. Однако энергия двойной связи меньше, чем энергия двух ординарных, на 92,1 кДж/моль. Поэтому двойная связь легко переходит в две ординарные σ-связи путем присоединения по месту двойной связи двух атомов или атомных групп.
В реакциях присоединения двойная связь обычно выступает как донор электронов. Поэтому для олефинов характерна реакция электрофильного присоединения. (16, с.79)
1.3.2.2Электронная структура ацетальдегида
Большинство реакций ацетальдегида обусловлено присутствием активной карбонильной группы. Двойная связь карбонильной группы сходна по физической природе с двойной связью между двумя углеродными атомами (σ-связь + π-связь). Однако в то время как Ес=с < 2Ес-с, энергия связи С=О (749,4 кДж/моль) больше, чем энергия двух простых С-О-связей (2• 358 кДж/моль). С другой стороны, кислород является более электроотрицательным элементом, чем углерод, и потому электронная плотность вблизи атома кислорода больше, чем вблизи атома углерода. Дипольный момент карбонильной группы - около 9•10-30 Кл/м (2,7 D). Благодаря такой поляризации углеродный атом карбонильной группы обладает электрофильными свойствами и способен реагировать с нуклеофильными реагентами. Соответственно атом кислорода является нуклеофильным. В реакциях присоединения молекулы всегда направляется к углеродному атому карбонильной группы, в то время как ее положительно поляризованная часть направляется к кислородному атому. (16, с. 166)
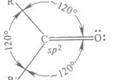
Рис. 3 Схематическое изображение строения молекулы ацетальдегида
1.3.2.3Электронная структура кислорода
Кислород О имеет электронную конфигурацию невозбужденного атома
![]()
Is-2s22p4:
В молекуле О2 на 8 связывающих электронов приходится 4 разрыхляющих, поэтому порядок связи в ней равен двум. Учитывая парамагнетизм и порядок связи, строение молекулы О2 можно передать следующими структурными формулами:
![]()
Тремя точками обозначены связи, обусловленные двумя πсв- и одним πразр-электроном, что отвечает порядку связи 0,5. Во второй формуле непарные точки означают πразр-электроны. При возбуждении молекула О2 становится диамагнитной. Этому состоянию отвечает структурная формула :О=О:
Вследствие кратности связи межатомное расстояние в О2 (1,207 А ) меньше длины одинарной связи 0—0(1,48 А). По этой же причине молекула О2 весьма устойчива, ее энергия диссоциации равна 494 кдж/моль, в то время как энергия одинарной связи О—О всего 210 кдж/моль. Диссоциация молекул О2 на атомы становится заметной лишь при 2000°С. Диссоциация молекулы О2, на атомы (фотолиз О2) имеет место также при поглощении ультрафиолетового излучения с длиной волны 190 нм (1900 А).(17, с. 337)
1.3.2.4Электронная структура катализатора PdCl2
В процессе окисления этилена в ацетальдегид как правило применяется катализатор PdCl2, в качестве промотера применяется CuCl2, либо FeCl3.
Структурной единицей соединений Pd (II) является квадрат. Кристаллы PdCl2 (рис. 4) имеют цепное строение с квадратной структурной единицей PdCl4 (17, с. 649):
![]()
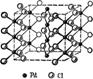
Рис. 4. Структура PdCl2
1.3.3 Химические свойства реагентов и продуктов реакции
1.3.3.1 Химические свойства этилена
1. Гидрирование. Алкены непосредственно молекулярный водород не присоединяют. Эту реакцию можно осуществить только в присутствии гетерогенных (Pd, Pt, Ni) или гомогенных (например, хлортристрифенилфосфин родия RhCl(Ph3P)3) катализаторов. Наиболее часто проводят каталитическое гидрирование на гетерогенных катализаторах:
СН2=СН2 + Н2 ![]() СН3 – СН3; ΔН = – 137.3 кДж/моль.
СН3 – СН3; ΔН = – 137.3 кДж/моль.
2. Галогенирование. Олефины легко присоединяют галогены:
СН2=СН2 + Вг2 ![]() СН2Вг – СН2Вг.
СН2Вг – СН2Вг.
Скорость реакции зависит от природы галогена и строения олефина. Фтор реагирует с воспламенением, иод - медленно на солнечном свету.(16, с.79)
Присоединение происходит по ионному электрофильному механизму. Молекула галогена атакует двойную связь, захватывая электроны и образуя так называемый π-комплекс. Затем отделяется отрицательный ион галогена. К возникающему карбениевому или бромониевому катиону (присо