Разработка блока определяющего длительность стимулирующего импульса для аппарата электроанальгезии
В практике современного здравоохранения широко используются медицинские системы электростимуляции органов и тканей. Технические устройства генерируют различные электрические токи, которые, взаимодействуя с функциональными системами организма, оказывают на него лечебное воздействие или дают информацию, используемую для постановки диагноза и в ходе дальнейшего лечения.
Лечебные эффекты, возникающие при воздействие электричества на организм человека, были замечены достаточно давно. Еще римские ученый Скриониус Ларгус ( 49 г. н. э. ) прикладывал к телу больных электрическую рыбу «торпедо» для лечения головных болей и подагры. Работы Л. Гальвани, опубликованные в 1791 г. и связанные с проблемой «живого электричества», изобретение А. Вольта первых химических источников тока, по существу, положили начало по изучению действия электрического тока на живые организмы. Однако первые ощутимые практические результаты применения электрического тока в медицине появились лишь в начале 20 века, когда прогресс в развитии науки и техники позволил создать аппараты, способные генерировать электрические токи необходимых характеристик и появились высокочувствительные измерительные приборы, которые могли быть использованы биоэлектрической активности, а уровень развития биологических наук в этот период времени позволил обоснованно применять эти средства в медицине. В настоящее время методы электрического воздействия применяются практически во всех областях медицины, как с лечебной, так и диагностической целью. В соответствии с медицинской терминологией воздействие электрического тока на органы и ткани стали чаще всего называть электрической стимуляцией, подчеркивая при этом то обстоятельство, что электрический ток в биологических тканях вызывает усиление функциональной активности систем, органов и тканей. Наиболее выражен этот эффект в возбудимых тканях: нервной и мышечной.
Электрическая стимуляция успешно сочетается с традиционной лекарственной терапией, а в ряде случаев позволяет добиться лечебного эффекта там, где другие методы лечения не дают положительного результата. Методы электростимуляции, применяемые в клинической медицине, зависят от конкретного объекта воздействия. Их можно разделить по функциональному признаку в соответствии с использованием в медицине:
1. Электрокардиостимуляция ( ЭКС );
2. ЭС желудочно-кишечного тракта;
3. ЭС дыхания;
4. ЭС нерва каротидного синуса;
5. ЭС депрессорных нервов;
6. Диагностическая ЭС;
7. Противоболевая ЭС;
8. Центральная электроанальгезия;
9. Электроостеостимуляция;
10. Дефибриляция;
11. ЭС выделительных органов;
12. ЭС органов слуха и зрения;
13. ЭС опорно-двигательного аппарата;
14. Общая электроанастеия.
В данной работе более подробно рассматривается один из видов электростимуляции – электроанальгезия, основной задачей которой является ослабление или устранение болевого синдрома, который возникает в послеоперационный период, при наличии хронических заболеваний и т.д.
Лечение хронических болевых синдромов по-прежнему остается одной из важнейших задач и сложнейшей проблемой медицины. Боль представляет собой многоплановый феномен, который, сигнализирует об опасности повреждения, выполняет в организме информационные и защитные функции, вместе с тем хроническая боль, истощая силы организма, снижая сопротивляемость, способствуя развитию осложнений, становится механизмом патогенеза и основой для возникновения различных патологических нарушений. Хронические болевые синдромы являются одной из наиболее частых причин нетрудоспособности человека.
1. Медико-техническое обоснование
1.1 Физиологическое обоснование применения электрического воздействия при лечении болевых синдромов
Лечение хронических болевых синдромов по-прежнему остается одной из важнейших задач и сложнейшей проблемой медицины. Боль представляет собой многоплановый феномен, который, сигнализируя об опасности повреждения, выполняет в организме информационные и защитные функции, вместе с тем хроническая боль, истощая силы организма, снижая сопротивляемость, способствуя развитию осложнений, становится механизмом патогенеза и основой для возникновения различных патологических нарушений. Хронические болевые синдромы являются одной из наиболее частых причин нетрудоспособности человека. В СССР около 20 миллионов" людей, то есть практически каждый пятый трудоспособный член общества, ежегодно страдали от боли. Толькоиз-за хронической боли, связанной с заболеваниями опорно-двигательного аппарата, от 10 до 30% взрослого населения надолго выбывают из сферы производства.
Защитная функция боли может быть наиболее полно проанализирована с позиций теории функциональных систем П. К. Анохина, согласно которой любая функциональная система имеет однотипную структуру, ядром которой является системообразующий фактор — полезный приспособительный результат. При отклонении жизненно важной функции от необходимого уровня включается специальный рецепторный аппарат, широко представленный в организме. Рецепторы являются первым звеном формирования так называемой обратной афферентации — физиологической обратной связи, играющей сигнальную роль в регуляции функций и в получении информации о результатах действий, совершенных функциональной системой. Обратная афферентация является основой, которая определяет целенаправленную деятельность каждой функциональной системы.
Для удержания полезного результата на заданном уровне каждая функциональная система имеет различные исполнительные механизмы, которые реализуются посредством поведенческой, вегетативной, гуморальной регуляции. Эффекторный аппарат функциональных систем является, в определенной степени, универсальным, т. к. одни и те же исполнительные механизмы могут быть включены для выполнения различных функций организма. Системообразующий фактор каждой функциональной системы обусловлен определенной биологической потребностью организма. Если считать боль своеобразной отрицательной потребностью организма, то можно вести речь, по крайней мере, о двух приспособительных результатах, которые могут быть положены в основу построения концепции функциональной системы с участием боли: целостность покровных оболочек организма, т. е. защита от повреждающих воздействий со стороны внешней среды, и необходимый уровень окислительных процессов в тканях организма, т. е. защита от воздействия веществ, которые нарушают химические тканевые процессы, поддерживающие нормальную жизнедеятельность. Сформированная на такой основе функциональная система с системообразующим фактором — болью показана на рис.1.1. Под действием болевой импульсации, возникающей в рецепторном аппарате и передаваемой по каналу обратной афферентации, в организме возникает ряд специфических и неспецифических реакций, направленных на устранение причин возникновения боли и восстановление гомеостаза.
Данные реакции можно разделить на несколько характерных групп:
— двигательные реакции, связанные с рефлекторной мышечной активностью, например, реакции «отдергивания»;
— эмоционально-поведенческие, связанные, например, со щажением больного органа, и социально-поведенческие, обуславливающие процесс лечения;
— вегетативные, вызывающие, например, расширение сосудов, усиление деятельности сердечно-сосудистой и дыхательной систем;
— гематологические, связанные с ускорением свертываемости крови, лейкоцитозом;
— гуморальные, определяемые повышением активности гормонов;
— метаболические, вызывающие изменения обмена веществ.
Таким образом, данная функциональная система, охватывающая практически все основные физиологические процессы, целенаправленно защищает организм как от последствий болевого раздражения, так и от возможных его повторений. Оценка указанных реакций организма на боль позволяет найти физиологические корреляты болевого раздражения, которые имеют информационную значимость при исследовании боли и методов обезболивания.
Раздражители, вызывающие ощущение боли, могут быть различными по своей природе: механическими, химическими, электрическими, термическими. Кроме того, у человека боль может вызываться эмоциональными и психическими факторами. Болевое ощущение в нормальных физиологических условиях формируется в результате раздражения сложной афферентной системы, включающей рецепторный аппарат, афферентные волокна, передающие ноцицептивную информацию, спинальные зоны переключения, восходящие пути в структуры ЦНС.
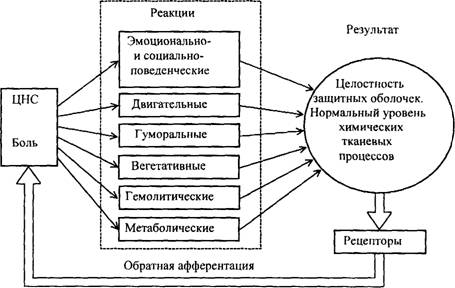
Рисунок.1.1 - Функциональная система организма с участием боли.
В настоящее время существует несколько теорий рецепции и восприятия боли. Наиболее традиционными являются теории специфичности Фрея и теории неспецифического паттерна Гольдшейдера, предложенные в конце прошлого столетия. Согласно первой основную роль в рецепции боли играют неинкапсулированные свободные нервные окончания, возбуждающиеся при повреждающих воздействиях. Вторая теория придает основное значение при формировании боли пространственно-временному соотношению афферентных сигналов в нервных проводниках различного типа. Ни одна из этих теорий до настоящего времени не отвергнута, более того, они продолжают подкрепляться соответствующими экспериментальными и клиническими данными, а поэтому имеют право на существование.
К рецепторам боли — ноцицепторам — относят низкопороговые и высокопорогосые соматические рецепторы и терминали, передающие импульсацию по А-дельта и С-волокнам (по классификации Гассера), которые по механизму реагирования можно разделить на механорецепторы и хеморецепторы. Обработка ноцицептивных сигналов на уровне спинного мозга изучалась в работах Р. Мелзака и П. Уолла, явившихся по сути дела попыткой создать теорию боли, в которой, с одной стороны, учитывалась физиологическая специализация, а с другой — осуществлялся анализ различных по интенсивности импульсных потоков. Теория «воротного контроля» боли Р. Мелзака и П. Уолла предполагает, что нейронный механизм задних рогов спинного мозга (спинальные зоны переключения) осуществляет модуляцию потока импульсации, идущей от периферических волокон в ЦНС. Степень уменьшения или увеличения передачи импульсации определяется соотношением активности волокон, несущих ноцицептивную и сенсорную импульсацию, а также влиянием тормозной нисходящей системы из высших структур мозга. Согласно модели «воротного контроля» боли (рис.1.2), афферентные волокна проводят импульсацию в желатинозную субстанцию и в передаточные Т-клетки. Модулирующее влияние, оказываемое со стороны желатинозной субстанции на передачу импульсации через Т-клетки, усиливается при возбуждении толстых волокон и уменьшается при возбуждении тонких. Однако «воротная» теория боли не смогла в полной мере объяснить явлений, возникающих при развитии болевых синдромов и их лечении. Недостаток теории по мнению ряда авторов состоит в том, что в ней торможение проведения болевой импульсации объясняется, главным образом, пресинаптическими механизмами на спинальном уровне, а центральному влиянию отводится второстепенная роль.
Открытие в середине 70-х годов эндогенной системы контроля болевой чувствительности, а также выделение эндогенных веществ, выполняющих функции нейромодуляторов болевой импульсации — опиоидных пептидов (эндорфинов и энкефалинов), позволили раскрыть более тонкие механизмы формирования болевой чувствительности у человека. В различных органах и тканях, в первую очередь в ЦНС, в структурах спинного мозга, в кишечнике, печени, предсердиях и др. были обнаружены так называемые опиатные рецепторы, с которыми взаимодействуют эндорфины и энкефалины. Существуют, по крайней мере, два вида данных рецепторов: мю-рецепторы, чувствительные к морфинам, активность которых предопределяет болевую чувствительность, и дельтарецепторы, посредством которых регулируется эмоциональное поведение.
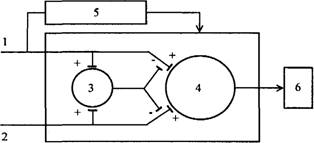
Рисунок.1.2 - Модель «воротного» контроля боли:
1 — волокна большого диаметра, 2 — волокна малого диаметра, 3 — желатинозная субстанция, 4 — Т-клетки, 5 — система центрального контроля, 6 — система действия
В свете современных представлений формирование болевого ощущения у человека происходит в результате взаимодействия двух антагонистически функционирующих систем организма — ноцицептивной и антиноцицептивной. Ноцицептивная система (НС) восходит от ноцицепторов к глубоким структурам мозга. НС содержит в своем составе нейрохимический аппарат генерации специфических и неспецифических медиаторов болевой передачи — нейротрансмиттеров (НТ), который, располагаясь по ходу путей, проводящих ноцицепцию, преимущественно сосредотачивается в переключающих структурах. Типичными НТ являются: ацетилхолин, норадреналин, серотин. В тех же зонах представлены рецепторы антиноцицептивной системы (АНС), тормозящей передачу болевой импульсации за счет генерации нейромодуляторов (НМ) (рис.1.3.). Экспериментальные и клинические работы последних лет показали, что болевые ощущения у человека обусловлены изменением динамического соотношения между уровнями НМ и НТ. АНС и НС в процессе продукции НМ и НТ оказываются взаимосвязанными, т. к. активация одной из систем приводит не только к усилению ее функционирования, но и вызывает торможение другой системы. При воздействии ноцицептивного раздражителя происходит торможение структур АНС и затем с незначительной задержкой — активация НС. При хронических болевых синдромах АНС истощена, что характеризуется низким уровнем НМ. Активация НС в рамках данных представлений может произойти без воздействий, угрожающих повреждением, например, вследствие угнетения активности АНС. Так, введение блокаторов НМ ведет к развитию гипералгезии, т. е. к уменьшению болевого порога и возникновению спонтанных болевых ощущений. Активация АНС, вызывающая срабатывание эндогенных механизмов антиноцицепции и приводящая к снижению болевой чувствительности, происходит при различных видах воздействия на организм. Этими механизмами могут быть объяснены анальгетические феномены, возникающие при акупунктуре, вибрационной и звуковой стимуляции, при чрескожной электронейростимуляции и стимуляции спинномозговых проводящих путей.
Все вышесказанное позволяет утверждать, что в ответ на болевое раздражение в организме возникает системная реакция, направленная на устранение раздражения и характеризующаяся возбуждением основных физиологических систем. Передача болевого раздражения от ноцицепторов к структурам ЦНС, ответственным за восприятие боли, происходит под контролем двух эндогенных систем организма — НС и АНС, взаимосвязанных при своем функционировании. Модуляция афферентных потоков болевой импульсации возможна путем влияния на активность данных систем. Возбуждение сенсорных структур, связанных с областью болевого раздражения, возникающее при противоболевой электронейростимуляции, активирует АНС и вызывает соответственное изменение уровней НМ и НТ, приводящее к повышению болевого порога. Данные механизмы могут быть использованы для объяснения процессов регуляции боли при электронейростимуляции сенсорных структур в ходе периферической электроанальгезии.
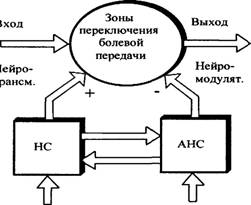
Рисунок 1.3 - Регуляция болевой чувствительности с участием АНС и НС
1.2 Биотехническая система электроанальгезии. Теоретическое обоснование структуры и механизмов воздействия
Создание новых эффективных аппаратных методов и технических средств для периферической электроанальгезии представляет собой проблему, решение которой требует комплексного подхода и всестороннего учета ее технических, физиологических и клинических аспектов. Создание новой медицинской техники и аппаратных методов лечения должно опираться, с одной стороны, на возможности современных технологий, а с другой, — на глубокое понимание явлений, происходящих при взаимодействии технических средств и живого организма. Изучение такого взаимодействия невозможно без использования системного подхода, в соответствии с которым технические и биологические звенья должны рассматриваться взаимосвязанно в рамках единой биотехнической системы (БТС). Биотехнический системный подход становится в настоящее время методологической основой для создания эффективных аппаратных методов и технических средств, пригодных для использования в медицине. Сформулированные в общей теории БТС принципы взаимного согласования параметров биологических и технических компонентов системы, целевой функции, управления и регулирования по биотехническому контуру обратной связи, позволяют определить пути создания такой аппаратуры и разработки эффективных методов лечебного воздействия.
Для решения проблемы создания эффективных аппаратных методов и технических средств периферической электроанальгезии ее следует рассмотреть с этих же позиций и разработать БТС нового типа — биотехническую систему электроанальгезии (БТС ЭА), объединяющую в своем составе биологические и технические звенья, участвующие в процессе обезболивания под влиянием электростимуляции.
Работа БТС ЭА строится на основе взаимодействия системы контроля болевой чувствительности организма человека, являющейся физиологической частью БТС, и технического компонента системы, в задачи которого должны входить не только формирование лечебного воздействия, но и оценка состояния физиологических показателей и диагностических признаков для управления параметрами воздействия. При развитии болевого синдрома система контроля болевой чувствительности возбуждается потоком ноцицептивной импульсации из очага боли. Лечебное воздействие в виде стимулирующего электротока, создаваемого блоком воздействия, будет формировать поток сенсорной афферентации, поступающий на управляемый вход системы контроля болевой чувствительности. Блок воздействия включает в себя канал согласования, содержащий возбуждаемые афференты, участки пассивной передачи тока воздействия, стимулирующие электроды, а также устройство формирования электрического воздействия. Формирование управляющих сигналов, задающих параметры и режимы стимуляции, осуществляется на основе оценки физиологических показателей и определения диагностического признака. Реализация целевой функции БТС, заключающаяся в минимизации отклонения диагностического признака от нормы, осуществляется различными способами в зависимости от функциональных особенностей использования аппаратуры.
Диагностическим признаком в БТС ЭА служит степень выраженности у пациента болевого синдрома, которая проявляется в виде болевых ощущений, а также в виде характерного сдвига физиологических показателей, косвенно связанных с интенсивностью боли.
При возникновении у пациента болевых ощущений управление параметрами электронейростимуляции осуществляется врачом на основе клинического обследования состояния больного, причем включение стимулов и установка выбранного режима воздействия может происходить автоматически по программе, составленной с учетом индивидуальных особенностей проявления болевого синдрома. В определенных случаях, например, при лечении хронических болей, управление параметрами стимулов может осуществляться самим пациентом по инструкции врача. В случаях, когда контакт с пациентом в ходе лечения затруднен или вообще невозможен, например, во время проведения хирургических вмешательств, единственным наблюдаемым проявлением болевого синдрома является изменение физиологических показателей, отражающих состояние пациента. Для диагностики состояния в этом случае в БТС ЭА необходимо ввести блоки измерения физиологических параметров и оценки показателей, дающие врачу информацию об эффективности электроанальгезии. В соответствии с вышеизложенным структурно-функциональная схема БТС ЭА приобретает вид, показанный на рис.1.4. Для БТС ЭА эндогенная регулировка болевой чувствительности осуществляется со стороны двух систем организма: АНС и НС, связанных с зонами переключения болевой чувствительности, находящимися на пути ноцицептивной импульсации от периферии к структурам ЦНС, воспринимающим боль.
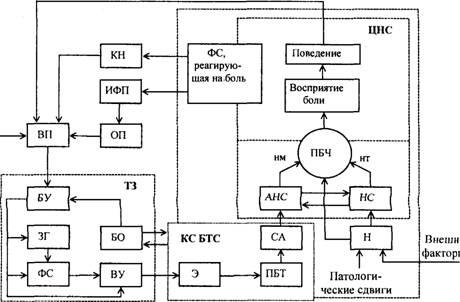
Рисунок 1.4 - Структурная схема БТС ЭА:
ПБЧ — переключение болевой чувствительности; Н — ноцицепторы; ФС — физиологические системы; КС — канал согласования БТС; Э — электроды; ПБТ — пассивная биологическая ткань; СА — сенсорные афференты; ТЗ — технические звенья; ЗГ — задающий генератор; ФС — формирователь стимула; ВУ — выходной усилитель; БУ, БО — блоки управления и оценки; КН — клиническое наблюдение; ИФП — измерение физиологических показателей; ОП — оценка показателей; ВП — выработка показаний
Биотехнический контур управления образуется с помощью устройства генерации и формирования стимулирующего тока, воздействующего через электроды и участки тканей, передающие стимул на соответствующие сенсорные структуры. Ядром биологического звена БТС ЭА является зона управления болевой чувствительностью, происходящие процессы в которой за счет электрического воздействия определяют эффективность обезболивания, достигаемого в результате функционирования биотехнического контура управления. Технические звенья, входящие в состав биотехнического контура управления в соответствии с функциональным назначением в БТС ЭА — возбуждением сенсорных афферентов — должны содержать каскады задающего генератора, формирователя стимулов, выходного усилителя тока, а также блок управления параметрами выходного тока стимула. Задающий генератор определяет частоту следования стимулов и синхронизирует работу устройства, в формирователе происходит задание формы стимула и его временных параметров (длительности, фронта, среза, заполнения и т.п.). Выходной усилитель задает необходимую амплитуду тока стимулов и определяет условия согласования с электродами и биологической тканью. Динамическое согласование параметров стимулирующего тока и биологической ткани может быть достигнуто введением блока оценки условий стимуляции, осуществляющего обратную связь канала согласования БТС и блока управления параметрами выходного тока. Блоки измерения физиологических параметров и оценки показателей входят в информационное звено БТС. В качестве измеряемых параметров для оценки выраженности болевого синдрома и степени электроанальгезии могут быть выбраны:
параметры сердечно-сосудистой системы, являющейся надежным индикатором изменения состояния организма — сердечный ритм, гемодинамические показатели, а также показатели внешнего дыхания.
Структурное построение технических звеньев БТС ЭА в определенной степени зависит от области медицинского применения. Аппаратура для индивидуального пользования по инструкции врача должна иметь минимум возможных вариаций ручных регулировок параметров стимула и повышенную безопасность в работе. Для клинического использования блок управления может включать программное устройство долговременного задания параметров. Информационные звенья целесообразно включать в состав БТС в случаях интраоперационного обезболивания, когда контакт с больным отсутствует. Таким образом, предложенная структура БТС ЭА является функционально полной для описания различных вариантов обезболивания путем периферической электронейростимуляции сенсорных структур.
Основным вопросом, определяющим эффективность функционирования БТС ЭА, является выработка критериев формирования стимулирующего воздействия на основе анализа процессов, происходящих в зоне регуляции болевой чувствительности биологического звена под действием управляющего воздействия. Данные критерии определяют алгоритм функционирования БТС, направленный на реализацию ее целевой функции. Анализ структуры БТС ЭА показывает, что существуют два уровня определения искомых критериев. На уровне канала согласования БТС целесообразно определить критерии выбора стимулирующего воздействия, обеспечивающие наибольшую эффективность возбуждения соматических афферентов, а на уровне зоны регуляции болевой чувствительности — критерии эффективной электроанальгезии.
Критерии канала согласования касаются выбора параметров и режимов стимуляции, формы стимулов, обеспечивающих высокую интенсивность импульсации в возбуждаемых нервных структурах. Критерии зоны регуляции определяются на основе анализа процессов в НС и АНС, определяющих уровень болевой чувствительности в организме. При синтезе сигнала воздействия для БТС ЭА необходим совместный учет критериев обоих уровней, в результате чего создаются условия для эффективной электроанальгезии. С точки зрения теории БТС задание подобных критериев является реализацией принципов адекватности и единства информационной среды.
Определение данным путем характеристик и параметров стимулирующего воздействия позволяет провести синтез структуры технического звена, в частности, электронейростимулятора на основе формирования требований к отдельным его блокам, отвечающим конкретной технической реализации. Алгоритмы функционирования технического звена целесообразно определить, исходя из закономерностей изменения как параметров канала согласования БТС, так и динамики процессов, происходящих в зоне управления болевой чувствительностью, что необходимо для обеспечения эффективного функционирования БТС в целом.
Ядром БТС электроанальгезии является зона управления болевой чувствительностью, процессы в которой определяют эффективность обезболивания, достигаемого за счет действия биотехнического контура управления. Процессы, происходящие в зоне управления под влиянием противоболевой электронейростимуляции, зависят от изменения уровней НМ и НТ в структурах АНС и НС и интенсивностей ноцицепции и стимуляции. Это позволяет описать процесс формирования болевой чувствительности в зоне управления методом камерного моделирования, позволяющим рассматривать процессы управления в биосистемах в терминах «вход-выход-состояние».
Под камерой обычно понимается некоторый легко формализуемый элемент биосистемы, с которым связано перемещение или преобразование отдельного ее компонента, имеющего количественную характеристику. Каждая камера биосистемы характеризуется одной переменной состояния, а биосистема в целом — вектором состояния.
В камерных моделях открытых биосистем в качестве входных и выходных переменных используются темпы изменения количества вещества или энергии на входе и выходе биосистемы, а в качестве переменных состояния — их уровни, регулирующие эти темпы. Такие представления отвечают закономерностям важнейших процессов в биосистемах, описываемых с помощью обыкновенных дифференциальных уравнений, определяющих диффузионный и конвективный транспорт вещества, ферментативные реакции, воздействие активных веществ на органы и ткани, нейрогуморальные процессы.
Камерная модель, в отличие от существующих качественных методов описания процессов формирования болевой чувствительности, позволяет установить зависимость между темпами поступления входных переменных, в данном случае — ноцицепции и сенсорной афферентации, и уровнями НТ и НМ, определяющими порог болевого восприятия. Это дает возможность использовать данную модель не только для анализа процессов регуляции болевой чувствительности, но и для определения наиболее эффективных параметров и режимов воздействия на АНС с целью подавления болевых синдромов.
Анализ модели позволяет определить требования к формированию стимулирующего воздействия для эффективного подавления боли. В пределах линейности уравнений модели увеличение амплитуды тока стимула ведет к повышению болевого порога. Эта зависимость хорошо подтверждается клинически, однако в случае чрескожной стимуляции возникновение электрокожных тепловых эффектов, сопровождающихся болевыми ощущениями под электродами, ограничивает увеличение тока. Достижение обезболивания при ограниченных амплитудах тока стимула возможно путем увеличения значения порога болевого раздражения, которое зависит от выбранной формы стимулирующего тока.
Исследование возбудимости нервных волокон различного диаметра, ответственных за проведение различных видов чувствительности показывает, что дифференциация порогов сенсорного и болевого раздражения возрастает с укорочением длительности стимула и увеличением крутизны его фронта. Таким образом, для повышения эффективности противоболевого воздействия необходимо выбирать стимулы с коротким фронтом, длительность которого не превышает единиц процентов от длительности стимула. Уменьшение длительности прямоугольного стимула ограничено величиной времени релаксации тока в тканях, окружающих возбудимую структуру, т. к. при дальнейшем укорочении стимула возрастает величина энергии, рассеиваемой в тканях.
При чрескожной электростимуляции требование уменьшения энергии, рассеиваемой в тканях, усиливается, т. к. из-за падения амплитуды стимула при его передаче к возбудимому звену приходится значительно увеличивать ток, проходящий в ткани. Возникающие при этом чрескожные эффекты в значительной степени зависят от соотношения составляющих, образующих частотный спектр стимула. Сравнение различных форм стимула для чрескожной электронейростимуляции опорно-двигательного аппарата, а также электростимуляции мышц показывает, что уменьшение чрескожных эффектов в зоне расположения электродов при больших токах стимула достигается путем увеличения частоты основных спектральных компонент стимула, а также использования синусоидальных стимулирующих токов с частотой порядка 3...5 кГц. Причем уменьшение частоты сопровождается усилением болезненности под электродами, а значительное увеличение частоты приводит к резкому падению эффективности стимуляции.
Исследование чрескожных эффектов действия тока показывает, что минимальные пороги болевых ощущений наблюдаются и области «низких» частот порядка десятков-сотен герц. Здесь же достш ают максимума термические эффекты, обусловленные потерями стимулирующего тока в тканях. С повышением частоты спектральных компонент стимулов увеличивается шунтирующее действие проводимости межэлектродного промежутка, что обуславливает падение напряжения стимулов на возбудимой структуре. Так, если для модели чрескожного импеданса воспользоваться трехзвенной электрической эквивалентной схемой, то зависимость напряжения стимулов от частоты тока примет вид, показанный на рис. 1.5.

Рис. 1.5 - Частотные зависимости при синусоидальном стимуле:а — модуль напряжения стимула; б — экспериментальные пороги возбуждения;
в — пороги, рассчитанные для модели.
Здесь же показаны зависимости для порогов возбуждения М-ответов срединного нерва для случая чрескожной регистрации при воздействии стимулом, имеющим квазимонохроматический спектр, а также рассчитанная по модели канала воздействия для условий эксперимента.
Сопоставление зависимостей показывает, что для рассматриваемых условий стимуляции в области «верхних» частот, где происходит падение напряжения стимула, порог возбуждения, начиная с частот 10...15 кГц, удваивается и быстро растет. В области «средних» частот, там, где напряжение уменьшается не более, чем в 2 раза, пороги возбуждения оказываются минимальными.
Таким образом, рассмотрение зависимостей чрескожных эффектов действия тока и характеристик возбудимости нервного волокна от частотных компонент воздействующего тока, с точки зрения критерия минимального порогового воздействия и уменьшения ноцицептивных эффектов под электродами, показывает существование области «средних» адекватных частот стимулирующего тока.
2. Схемотехническое обоснование
2.1 Синтез структурной схемы
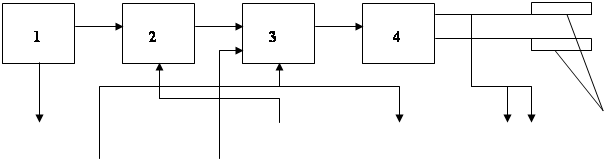
Формирование адекватной длительности стимулов, при которой достигается минимизация пороговой энергии стимуляции и поддерживание этих условий в процессе длительного воздействия, требует контроля величины времени релаксации тока в зоне расположения электродов и введение управления в формирователь длительности стимулов. Структурная схема, реализующая данный принцип управления длительностью стимула, показана на рис. 2.1. Задающий генератор 1 определяет частоту следования стимулов, длительность которых задается в управляемом формирователе 2, связанном через коммутатор 3 и усилитель 4 с электродами 5, расположенными на участке биологической ткани. Сигнал тактового генератора 6, синхронизированный с импульсами стимуляции, переводит устройство в режим управления. В этом режиме на электроды 5 подается сигнал с формирователя измерительного импульса 7, представляющий собой импульс с прямоугольной огибающей. Возникающее на электродах под действием измерительного импульса экспоненциально возрастающее напряжение поступает на измеритель переходного процесса 8, который формирует временной интервал, соответствующий времени нарастании входного напряжения, т.е. контролируемой величине времени релаксации тока. Для сохранения измеренного значения на весь период управления служит запоминающее устройство 9, сбрасываемое в начале каждого такта управления сигналом тактового генератора 6. Выход запоминающего устройства 9 через устройство управления 10 связан с управляющим входом формирователя длительности стимула 2. Таким образом, длительность стимулов в режиме стимуляции устанавливается в соответствии с измеренным значением времени релаксации тока в тканях в предыдущем периоде управления. Период управления выбирается достаточно большим по сравнению с длительностью измерительного импульса и периода стимуляции. Для отслеживания изменений релаксационных свойств ткани в процессе стимуляции достаточно выбрать период управления равным 2…4 с, а длительность измерительного импульса 1,5…2,0 мс. Достоинством данной схемы является использование одной пары электродов для стимуляции и контроля параметров, что упрощает построение технического звена БТС.
|