рДНК-биотехнология. Способы биотрансформации клеток
Генетическая инженерия - конструирование in vitro функционально активных генетических структур (рекомбинантных ДНК), или иначе - создание искусственных генетических программ (Баев А. А.). По Э. С. Пирузян генетическая инженерия - система экспериментальных приемов, позволяющих конструировать лабораторным путем (в пробирке) искусственные генетические структуры в виде так называемых рекомбинантных или гибридных молекул ДНК.
Речь идет о направленном, по заранее заданной программе конструировании молекулярных генетических систем вне организма с последующим введением их в живой организм. При этом рекомбинантные ДНК становятся составной частью генетического аппарата рецепиентного организма и сообщают ему новые уникальные генетические, биохимические, а затем и физиологические свойства.
Цель прикладной генетической инженерии заключается в конструировании таких рекомбинантных молекул ДНК, которые при внедрении в генетический аппарат придавали бы организму свойства, полезные для человека.
Технология рекомбинантных ДНК использует следующие методы:
- специфическое расщепление ДНК рестрицирующими нуклеазами, ускоряющее выделение и манипуляции с отдельными генами;
- быстрое секвенирование всех нуклеотидов очищенном фрагменте ДНК, что позволяет определить границы гена и аминокислотную последовательность, кодируемую им;
- конструирование рекомбинантной ДНК;
- гибридизация нуклеиновых кислот, позволяющая выявлять специфические последовательности РНК или ДНК с большей точностью и чувствительностью, основанную на их способности связывать комплементарные последовательности нуклеиновых кислот;
- клонирование ДНК: амплификация in vitro с помощью цепной полимеразной реакции или введение фрагмента ДНК в бактериальную клетку, которая после такой трансформации воспроизводит этот фрагмент в миллионах копий;
- введение рекомбинантной ДНК в клетки или организмы.
История генетической инженерии
Генная инженерия появилась благодаря работам многих исследователей в разных отраслях биохимии и молекулярной генетики. На протяжении многих лет главным классом макромолекул считали белки. Существовало даже предположение, что гены имеют белковую природу. Лишь в 1944 году Эйвери, Мак Леод и Мак Карти показали, что носителем наследственной информации является ДНК. С этого времени начинается интенсивное изучение нуклеиновых кислот. Спустя десятилетие, в 1953 году Дж. Уотсон и Ф. Крик создали двуспиральную модель ДНК. Именно этот год принято считать годом рождения молекулярной биологии.
На рубеже 50 - 60-х годов были выяснены свойства генетического кода, а к концу 60-х годов его универсальность была подтверждена экспериментально. Шло интенсивное развитие молекулярной генетики, объектами которой стали E. coli, ее вирусы и плазмиды. Были разработаны методы выделения высокоочищенных препаратов неповрежденных молекул ДНК, плазмид и вирусов. ДНК вирусов и плазмид вводили в клетки в биологически активной форме, обеспечивая ее репликацию и экспрессию соответствующих генов. В 70-х годах был открыт ряд ферментов, катализирующих реакции превращения ДНК. Особая роль в развитии методов генной инженерии принадлежит рестриктазам и ДНК-лигазам.
Историю развития генетической инженерии можно условно разделить на три этапа. Первый этап связан с доказательством принципиальной возможности получения рекомбинантных молекул ДНК in vitro. Эти работы касаются получения гибридов между различными плазмидами. Была доказана возможность создания рекомбинантных молекул с использованием исходных молекул ДНК из различных видов и штаммов бактерий, их жизнеспособность, стабильность и функционирование.
Второй этап связан с началом работ по получению рекомбинантных молекул ДНК между хромосомными генами прокариот и различными плазмидами, доказательством их стабильности и жизнеспособности.
Третий этап - начало работ по включению в векторные молекулы ДНК (ДНК, используемые для переноса генов и способные встраиваться в генетический аппарат клетки-рецепиента) генов эукариот, главным образом, животных.
Формально датой рождения генетической инженерии следует считать 1972 год, когда в Стенфордском университете П. Берг, С. Коэн, Х. Бойер с сотрудниками создали первую рекомбинантную ДНК, содержавшую фрагменты ДНК вируса SV40, бактериофага и E. coli.
1 Основные группы ферментов генетической инженерии
Генетическая инженерия - потомок молекулярной генетики, но своим рождением обязана успехам генетической энзимологии и химии нуклеиновых кислот, так как инструментами молекулярного манипулирования являются ферменты. Если с клетками и клеточными органеллами мы подчас можем работать микроманипуляторами, то никакие, даже самые мелкие микрохирургические инструменты не помогут при работе с макромолекулами ДНК и РНК. Что же делать? В роли "скальпеля", "ножниц" и "ниток для сшивания" выступают ферменты.
Только они могут найти определенные последовательности нуклеотидов, "разрезать" там молекулу или, наоборот, "заштопать" дырку в цепи ДНК. Эти ферменты издавна работают в клетке, выполняя работы по репликации (удвоению) ДНК при делении клетки, репарации повреждений (восстановлению целостности молекулы), в процессах считывания и переноса генетической информации из клетки в клетку или в пределах клетки. Задача генного инженера - подобрать фермент, который выполнил бы поставленные задачи, то есть смог бы работать с определенным участком нуклеиновой кислоты.
Следует отметить, что ферменты, применяемые в генной инженерии, лишены видовой специфичности, поэтому экспериментатор может сочетать в единое целое фрагменты ДНК любого происхождения в избранной им последовательности. Это позволяет генной инженерии преодолевать установленные природой видовые барьеры и осуществлять межвидовое скрещивание.
Ферменты, применяемые при конструировании рекомбинантных ДНК, можно разделить на несколько групп:
- ферменты, с помощью которых получают фрагменты ДНК (рестриктазы);
- ферменты, синтезирующие ДНК на матрице ДНК (полимеразы) или РНК (обратные транскриптазы);
- ферменты, соединяющие фрагменты ДНК (лигазы);
- ферменты, позволяющие осуществить изменение структуры концов фрагментов ДНК.
1.1 Рестриктазы
Общепринято термины "рестриктаза", "эндонуклеаза рестрикции" и "сайт специфическая эндодезоксирибонуклеаза" считать синонимами.
Все рестрикционные эндонуклеазы бактерий узнают специфические, довольно короткие последовательности ДНК и связываются с ними. Этот процесс сопровождается разрезанием молекулы ДНК либо в самом сайте узнавания, либо в каком-то другом, что определяется типом фермента. Наряду с рестрикционной активностью бактериальный штамм обладает способностью метилировать ДНК; для этого процесса характерна такая же специфичность в отношении последовательностей ДНК, как и для рестрикции. Метилаза добавляет метильные группы к адениновым или цитозиновым остаткам в том же сайте, в котором связывается рестрикционный фермент. В результате метилирования сайт становится устойчивым к рестрикции. Следовательно, метилирование защищает ДНК от разрезания.
Различают 3 основных класса рестриктаз: 1, 2 и 3.
Все рестриктазы узнают на двуспиральной ДНК строго определенные последовательности, но рестриктазы 1-го класса осуществляют разрывы в произвольных точках молекулы ДНК, а рестриктазы 2-го и 3-го классов узнают и расщепляют ДНК в строго определенных точках внутри сайтов узнавания или на фиксированном от них расстоянии.
Ферменты типов 1 и 3 имеют сложную субъединичную структуру и обладают двумя типами активностей - модифицирующей (метилирующей) и АТФ-зависимой эндонуклеазной.
Ферменты второго класса состоят из 2 отдельных белков: рестрицирующей эндонуклеазы и модифицирующей метилазы, поэтому в генной инженерии используются исключительно ферменты 2-го класса. Они нуждаются в ионах магния в качестве кофакторов.
В настоящее время выделено более 500 рестриктаз класса 2, однако среди ферментов, выделенных из различных микроорганизмов, встречаются такие, которые узнают на ДНК одни и те же последовательности. Такие пары или группы называют изошизомерами. Различают истинную изошизомерию, когда ферменты узнают одну и ту же последовательность нуклеотидов и разрывают ДНК в одних и тех же точках, и ложную, когда ферменты, узнавая один и тот же сайт на ДНК, производят разрывы в разных точках в пределах того же сайта.
Большинство рестриктаз класса 2 узнают последовательности, содержащие от 4 до 6 нуклеотидных пар, поэтому рестриктазы делят на мелко- и крупнощепящие. Мелкощепящие рестриктазы узнают тетрануклеотид и вносят в молекулы гораздо больше разрывов, чем крупнощепящие, узнающие последовательность из шести нуклеотидных пар. Это связано с тем, что вероятность встречаемости определенной последовательности из четырех нуклеотидов гораздо выше, чем последовательности из шести нуклеотидов. Например, в ДНК бактериофага Т7, состоящей из 40000 пар оснований, отсутствует последовательность, узнаваемая рестриктазой R1 из E. coli.
К мелкощепящим относятся рестриктазы Hpa II и Alu (из Arthrobacter luteus), к крупнощепящим - Eco R I (из Escherichia coli) и Hind III. Если предположить, что участки узнавания рестриктаз распределены вдоль цепи ДНК случайно, то мишень для ферментов, узнающих последовательность (сайт) из четырех нуклеотидов, должна встречаться в среднем 1 раз через каждые 256 пар оснований, а для ферментов, узнающих шесть нуклеотидов, - через 4096 пар оснований. Если сайт рестрикции окажется внутри гена, то обработка ДНК-рестриктазой приведет к его инактивации. Вероятность такого события очень велика при обработке мелкощепящими рестриктазами и незначительна при применении крупнощепящих эндонуклеаз. Поэтому с целью получения неповрежденного гена расщепление проводят поочередно несколькими крупнощепящими рестриктазами, либо применяют прием "недорестрикции", т.е. рестрикцию проводят в таких условиях, когда происходит расщепление лишь в одном сайте.
1.1.1 Механизм действия рестриктаз
В качестве мишеней (мест узнавания) часто выступают палиндромы из 4-6 пар оснований - сайты рестрикции. Точки узнавания рестриктазами симметричны относительно поворота на 180оС, то есть последовательность нуклеотидов слева направо в одной нити такая же, как справа налево в другой. Симметрия подразумевает, что те из них, которые должны быть метилированы, встречаются на обеих цепях ДНК. В результате сайт-мишень может быть полностью метилирован (обе цепи модифицированы), полуметилирован (только одна цепь метилирована) или не метилирован.
Полностью метилированный сайт не подвержен ни рестрикции, ни модификации. Полуметилированный сайт не узнается ферментом рестрикции, но может быть превращен с помощью метилазы в полностью метилированный. У бактерий метилирование, как правило, связано с сохранением имеющегося состояния модификации. Репликация полностью метилированной ДНК ведет к образованию полуметилированной ДНК. Вероятно узнавание полуметилированных сайтов представляет собой обычный этап функционирования метилазы in vivo.
Неметилированный сайт-мишень пред¬ставляет собой субстрат либо для рестрикции, либо для модификации in vitro. В клетке немодифицированная ДНК с большей вероятностью рестрицируется. Реакция разрезания осуществляется в две ступени. Сначала разрезается одна цепь ДНК, а затем рядом разрезается другая. В областях, прилегающих с каждой стооны к сайту разрезания, может иметь место экзонуклеотическая деградация. Происходит эффективный гидролиз АТФ, роль которого еще не выяснена.
Каким образом фермент узнает один сайт, а разрезает другой, достаточно удаленный? Важно отметить, что белок никогда не отделяется от молекулы ДНК, с которой он первоначально связался. Если фермент инкубировать со смесью модифицированной и немодифицированной ДНК, он предпочтительно разрезает немодифицированную ДНК. Следовательно, узнавая сайт связывания, белок не отделяется от неметилированной ДНК для того, чтобы найти сайт разрезания.
Существуют две альтернативные модели, объясняющие взаимосвязь между сайтами узнавания и разрезания: в соответствии с одной из них движется фермент, согласно другой модели, перемещается ДНК. Если движется фермент, то его перемещение вдоль ДНК будет продолжаться до тех пор, пока он не сделает выбор сайта разрезания. Если же движется ДНК, то фермент остается прикрепленным в сайте узнавания, а ДНК протаскивается через второй сайт связывания на ферменте, и это продолжается до тех пор, пока фермент не достигает области разрезания (пока не охарактеризованной). Получены электронно-микроскопические данные, свидетельствующие, что фермент вызывает образование петли в ДНК и остается, по-видимому, связанным с сайтом узнавания после разрезания; эти данные подтверждают вторую модель.
1.1.2 Построение рестрикционных карт
Ферменты рестрикции стали эффективным инструментом исследования. Они позволяют превращать молекулы ДНК очень большого размера в набор фрагментов длиной от нескольких сотен до нескольких тысяч оснований. С помощью метода электрофореза в агарозном геле (см. раздел 1) фрагменты ДНК, различающиеся по размеру, можно легко разделить, а затем исследовать каждый фрагмент отдельно.
Короткие фрагменты мигрируют намного быстрее, чем длинные. При сравнительно высокой концентрации агарозы большие фрагменты вообще не могут проникнуть в гель. В процессе миграции рестрикционные фрагменты не деградируют, их можно элюировать (вымывать) в виде биологически активных двуцепочечных молекул. При окрашивании гелей красителями, связывающимися с ДНК, выявляется набор полос, каждая из которых отвечает рестрикционному фрагменту, молекулярную массу которого можно определить, проведя калибровку с помощью ДНК с известными молекулярными массами.
Сравнение размеров фрагментов ДНК, полученных после обработки определенного участка генома набором рестрицирующих нуклеаз позволяет построить рестрикционную карту, на которой указано положение каждого сайта рестрикции относительно других участков.
Молекулу ДНК длиной 5000 пар нуклеотидов (п. н.). обрабатывают отдельно рестриктазами А и В. Фрагменты разделяют электрофорезом. Фермент А разрезал ДНК на 4 фрагмента размером 2100, 1400, 1000 и 500 п. н. Обработка рестриктазой В дала 3 фрагмента: 2500, 1300 и 1200 п. н. (рис. 37). Для определения расположения сайтов рестрикции этих ферментов на следующем этапе применяют процедуру двойного расщепления – обрабатывают ДНК двумя эндонуклеазами. Обработка изучаемого фрагмента одновременно двумя рестриктазами дала 6 фрагментов: 1900, 1000, 800, 600, 500, 200 п. н.
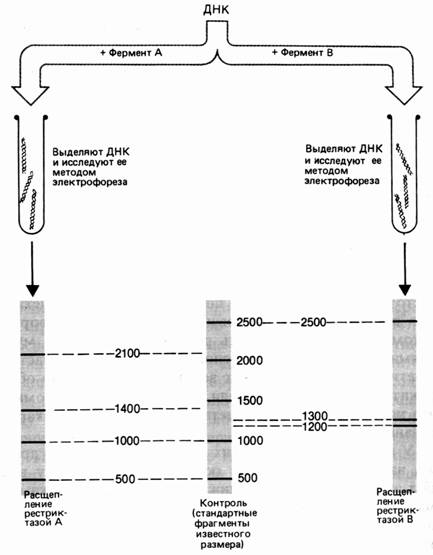
Рис. 1. Результаты электрофореза после обработки фрагмента ДНК разными рестриктазами
Наиболее полный вариант – элюировать каждый фрагмент, образующийся в результате расщепления одной рестриктазой, а затем обработать его второй. Смесь фрагментов, полученных после такой обработки, также анализируют с помощью электрофореза. В нашем примере были получены следующие результаты:
Обработка каждого из 4-х А-фрагментов рестриктазой В
2100 - 1900 и 200,
1400 - 800 и 600,
1000 - 1000 (изменений нет)
500 - 500 (изменений нет)
Обработка каждого из 3-х В-фрагментов рестриктазой А
2500 - 1900 и 600
1300 - 800 и 500
1200 - 1000 и 200
Анализ полученных результатов показывает, что каждый из ферментов, полученный при расщеплении А-фрагментов рестриктазой В можно обнаружить в образцах, полученных при расщеплении В-фрагментов рестриктазой А. Ключом к рестрикционному картированию являются перекрывающиеся фрагменты. Такими в рассматриваемом примере являются В-фрагмент 2100 и А-фрагмент 2500. При обработке другой рестриктазой они дают фрагмент 1900.
Из данных о расщеплении этих фрагментов мы предполагаем, что с одной стороны на расстоянии 200 п. н. от фрагмента 1900 находится следующий А-сайт, а с другого конца, на расстоянии 600 п. н. – следующий В-сайт (рис. 38). При обработке двумя эндонуклеазами фрагмент 200 п. н. образуется 1 раз, при обработке рестриктазой А из В-фрагмента 1200, т. е. фрагмент 1200 лежит слева. Остается определить, как продолжается карта вправо. Очевидно, это А-фрагмент 1400, так как он рассечен рестриктазой В на фрагменты 600 и 800. Вправо от фрагмента 2500 следует отложить, очевидно, фрагмент 1300. Тогда логично наличие А-фрагмента 500 и деления В-фрагмента 1300 рестриктазой А на 800 и 500.
При построении рестрикционных карт обычно используют несколько рестриктаз, поэтому приходится анализировать сложные соотношения между фрагментами, полученными при действии разных ферментов. Для упрощения процедуры картирования можно применять неполное расщепление. В определенных условиях рестриктаза узнает и расщепляет не все сайты в молекуле ДНК. Например, при частичном расщеплении ДНК ферментом А могут образовываться фрагменты 3100 п. н., 1400 п. н. и 500 п. н. Сопоставив их с данными полного расщепления (2100, 1400, 1000 и 500), можно сразу поставить рядом 2100 и 1000 (фрагмент 3100). А получив фрагмент 3500 – расположить рядом 2100 п. н. и 1400 п. н.
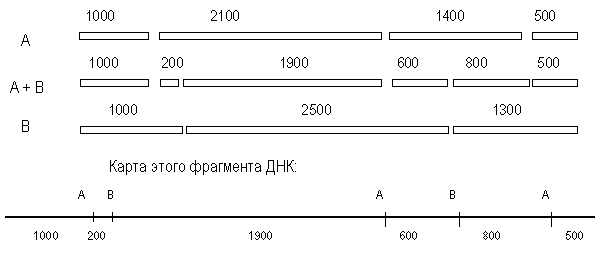
Рис. 2. Анализ фрагментов рестрикции и карта фрагмента ДНК
Другой прием – введение радиоактивной концевой метки. Концевые фрагменты определяются в этом случае по включению метки. Можно также сопоставить фрагменты путем гибридизации нуклеиновых кислот. Перекрывающиеся фрагменты (в данном случае 2100 и 2500) будут гибридизоваться.
Первая карта была получена для вируса SV40 (обезьяний вирус, вызывающий злокачественную трансформацию), содержащего 5423 пары оснований. Использовали рестриктазу Hind-II, расщепляющую кольцевую ДНК вируса на 11 фрагментов. Порядок их расположения в ДНК был установлен путем исследования наборов фрагментов, образующихся по мере того, как расщепление доходит до конца. Первый разрыв превращал кольцевую молекулу в линейную, которая затем расщеплялась на все меньшие и меньшие фрагменты. Исследовали вначале наборы перекрывающихся фрагментов, а затем продукты полного расщепления. Таким образом была получена рестрикционная карта кольцевой вирусной ДНК, на которую были нанесены сайты расщепления рестриктазой. Повторив подобные эксперименты с другой рестриктазой можно получить более подробную карту, где отмечено много сайтов рестрикции.
Располагая такой информацией, можно идентифицировать на ДНК биологически важные участки. Поскольку рестрикционная карта отражает расположение определенной последовательности нуклеотидов в данном участке, сравнение таких карт для двух или более родственных генов позволяет оценить гомологию между ними. Анализируя рестрикционные карты, можно сравнивать определенные участки ДНК разных видов животных без определения их нуклеотидной последовательности. Таким образом, например, было установлено, что хромосомные участки, кодирующие цепи гемоглобина у человека, орангутанга и шимпанзе сохранились в практически неизменном виде в течение последних 5 - 10 млн. лет (с тех пор как виды дивергировали).
Метод рестрикционного картирования позволяет увидеть крупные генетические изменения, такие как делеции или инсерции. При этом происходит уменьшение или увеличение рестрикционных фрагментов, а также исчезновение или возникновение сайтов рестрикции.
Один из приемов картирования – фингерпринт («метод отпечатков пальцев» или DNA-fingerprint). Он подразумевает использование неупорядоченных и неполных наборов фрагментов, которые являются характеристикой генома, хотя описывает его не полностью.
1.2 Обратная транскриптаза
Обратная транскриптаза используется для транскрипции м-РНК в комплементарную цепь ДНК. При изучении ретровирусов, геном которых представлен молекулами одноцепочечной РНК, было обнаружено, что в процессе внутриклеточного развития ретровирус проходит стадию интеграции своего генома в виде двухцепочечной ДНК в хромосомы клетки-хозяина. В 1964 г. Темин выдвинул гипотезу о существовании вирусспецифичного фермента, способного синтезировать на РНК-матрице комплементарную ДНК. Усилия, направленные на выделение такого фермента, увенчались успехом, и в 1970 г. Темин с Мизутани, а также независимо от них Балтимор открыли искомый фермент в препарате внеклеточных вирионов вируса саркомы Рауса. Данная РНК-зависимая ДНК-полимераза получила название обратная транскриптаза, или ревертаза.
Наиболее детально изучена ревертаза ретровирусов птиц. Каждый вирион содержит около 50 молекул этого фермента. Обратная транскриптаза состоит из двух субъединиц — a (65 кДа) и b (95 кДа), присутствующих в эквимолярном количестве. Обратная транскриптаза обладает, по крайней мере, тремя ферментативными активностями:
1) ДНК-полимеразной, использующей в качестве матрицы как РНК, так и ДНК;
2) активностью РНКазы Н, гидролизующей РНК в составе гибрида РНК—ДНК, но не одно- или двухцепочечную РНК;
3) ДНК-эндонуклеазной активностью.
Первые две активности необходимы для синтеза вирусной ДНК, а эндонуклеаза, по-видимому, важна для интеграции вирусной ДНК в геном клетки-хозяина. Очищенная обратная транскриптаза синтезирует ДНК как на РНК-, так и на ДНК-матрицах. Чтобы начать синтез, ревертазе, как и другим полимеразам, необходим короткий двухцепочечный участок (праймер). Праймером может служить одноцепочечный сегмент как РНК, так и ДНК, которые в процессе реакции оказываются ковалентно связанными с новосинтезированной цепью ДНК.
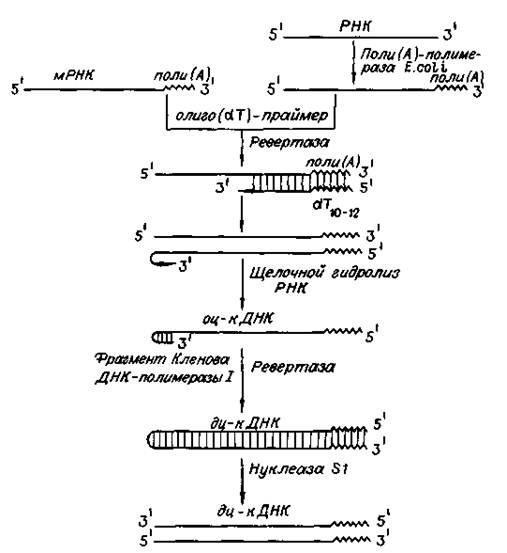
Рис. 3. Схема синтеза двухцепочечных ДНК-копий молекул РНК
Обратную транскриптазу преимущественно используют для транскрипции матричной РНК в комплементарную ДНК (кДНК). Реакцию обратной транскрипции проводят в специально подобранных условиях с использованием сильных ингибиторов РНКазной активности. При этом удается получать полноразмерные ДНК-копии целевых молекул РНК. В качестве праймера при обратной транскрипции поли (А)-содержащих мРНК используют олигo (dT), а для молекул РНК, не имеющих З'-поли (А) концов, — химически синтезированные олигонуклеотиды, комплементарные З'-концу изучаемой РНК. После синтеза на мРНК комплементарной цепи ДНК и разрушения РНК (обычно применяют обработку щелочью) осуществляют синтез второй цепи ДНК. При этом используют способность ревертазы образовывать на 3'-концах одноцепочечных кДНК самокомплементарные шпильки, которые могут выполнять функции праймера.
Матрицей служит первая цепь кДНК. Данная реакция может катализироваться как ревертазой, так и ДНК-полимеразой I E. coli. Показано, что сочетание этих двух ферментов позволяет повысить выход полноценных двухцепочечных молекул кДНК. По окончании синтеза первая и вторая цепи кДНК остаются ковалентно связанными петлей шпильки, служившей праймером при синтезе второй цепи. Эту петлю расщепляют эндонуклеазой S1, специфически разрушающей одноцепочечные участки нуклеиновых кислот. Образующиеся при этом концы не всегда оказываются тупыми, и для повышения эффективности последующего клонирования их репарируют до тупых с помощью фрагмента Кленова ДНК-полимеразы I E. coli. Полученную двухцепочечную кДНК можно затем встраивать в клонирующие векторы, размножать в составе гибридных молекул ДНК и использовать для дальнейших исследований.
1.3 Лигазы
В 1961 г. Мезельсон и Вейгл на примере фага l показали, что рекомбинация включает разрыв и последующее воссоединение молекул ДНК. Это положило начало поискам фермента, участвующего в сшивании фрагментов ДНК. В 1967 году такой фермент был найден и получил название ДНК-лигаза. Он катализирует синтез фосфодиэфирной связи в 2-х цепочечной молекуле нуклеиновой кислоты.
Иными словами, ДНК-лигазы сшивают рядом расположенные нуклеотиды, образуя связь между остатками сахаров. ДНК-лигазы абсолютно необходимы в процессах репарации ДНК, в процессах репликации - при удвоении цепи ДНК.
Существует 2 типа ДНК-лигаз, отличающихся по потребностям в кофакторах и способу действия. ДНК-лигаза E. coli в качестве кофактора использует дифосфопиридиннуклеотид, а лигаза фага Т4 - АТФ в присутствии Mg2+. Лигаза фага Т4 более универсальна, так как помимо лигирования липких концов способна катализировать реакцию воссоединения двухцепочечных фрагментов ДНК с тупыми концами. Она используется чаще.
2 Введение нового гена в клетку
Ввести рекомбинантный ген в клетку можно 2 способами: используя вектора или путем прямого введения.
Требования к векторной ДНК, ее состав
Вектор - молекула ДНК или РНК, состоящая из двух компонентов: векторной части (носителя) и клонируемого чужеродного гена. Задача вектора – донести выбранную ДНК в клетку-рецепиент, встроить ее в геном, позволить идентификацию трансформированных клеток, обеспечить стабильную экспрессию введенного гена.
Таким образом, вектор должен быть небольшим, способным поддерживаться в клетке-хозяине (реплицироваться), многократно копироваться (ампфлицироваться), экспрессировать соответствующий ген (содержать соответствующие регуляторные последовательности), должен иметь маркерный ген, позволяющий различать гибридные клетки для эффективной селекции их; должен быть способен передаваться в клетку соответствующего организма.
Регуляторные последовательности, отвечающие за стабильную экспрессию гена, будут рассмотрены позднее.
Можно выделить 2 группы маркерных генов, позволяющие отличить трансформированные клетки:
1. Селективные гены, отвечающие за устойчивость к антибиотикам (канамицину, тетрациклину, неомицину и др.), гербицидам (у растений). Это могут быть гены ауксотрофности по какому-либо субстрату и т.д. Основной принцип работы такого маркера – способность трансформированных клеток расти на селективной питательной среде, с добавкой определенных веществ, ингибирующих рост и деление нетрансформированных, нормальных клеток.
2. Репортерные гены, кодирующие нейтральные для клеток белки, наличие которых в тканях может быть легко тестировано.
Чаще всего в качестве репортерных используются гены β-глюкуронидазы (GUS), зеленого флюоресцентного белка (GFP), люциферазы (LUC), хлорамфениколацетилтрансферазы (CAT). К настоящему времени из этого арсенала наиболее часто используют гены GUS и GFP и, в меньшей степени, LUC и CAT. Используемый в настоящее время как репортерный ген GUS является модифицированным геном из Escherichia coli, кодирующим β-глюкуронидазу с молекулярной массой 68 кД. GUS активен в широком диапазоне условий среды с оптимумом при рН 5-8 и 37°С. Он может гидролизовать обширный спектр природных и синтетических глюкуронидов, что позволяет подбирать соответствующие субстраты для спектрофотометрического или флюориметрического определения активности фермента, а также для гистохимического окрашивания тканей in situ (например, в синий цвет). Фермент достаточно стабилен: он устойчив к нагреванию (время полужизни при 55°С составляет около 2 ч) и к действию детергентов. В процессе замораживания-оттаивания потери активности GUS не происходит. В составе химерных белков, созданных генно-инженерными методами, GUS обычно сохраняет свою функциональную активность. В живых клетках белок GUS также весьма стабилен и активен от нескольких часов до нескольких суток.
GFP (green fluorescent protein - зеленый флюоресцентный белок, или белок зеленой флюоресценции) был обнаружен Shimomura с соавт. в 1962 г. у люминесцирующей медузы Aequorea victoria. Ген GFP был клонирован в 1992 г. Prasher и соавт., и уже через несколько лет началось активное использование этого гена как репортерного в работах с самыми разными про- и эукариотическими организмами. В настоящее время ген GFP применяется в сотнях работ во всем мире, и число их стремительно нарастает. Столь быстрый рост вызван особыми свойствами белка GFP, а именно его способностью флюоресцировать в видимой (зеленой) области спектра при облучении длинноволновым УФ. Эта флюоресценция обусловлена непосредственно белком, для ее проявления не требуется субстратов или кофакторов. Благодаря этому свойству ген GFP является очень перспективным репортерным геном, позволяющим проводить разнообразные прижизненные (недеструктивные) исследования с трансгенными организмами.
Многочисленные производные GFP получили общее название AFP (autofluorescent proteins - автофлюоресцентные белки). Из морской анемоны Discosoma sp. недавно выделен еще один белок DsRed, флуоресцирующий в красном свете. Еще несколько аналогичных флюоресцирующих белков было выделено в самое последнее время учеными Российской академии наук из различных коралловых полипов порядка Anthozoa. Он может быть денатурирован очень высокой температурой, крайними значениями рН или сильными восстановителями типа Na2SO4. При возвращении к физиологическим условиям GFP в значительной степени восстанавливает способность к флюоресценции. В составе химерных белков, созданных генноинженерными методами, GFP обычно сохраняет свою функциональную активность. В живых клетках белок GFP также очень стабилен.
CAT – гены отвечают за синтез хлорамфениколацетилтрансферазы (выделены из Escherihia coli). Этот фермент катализирует реакцию переноса ацетильной группы от ацетил-КоА к хлорамфениколу. Определяется гистохимически, по изменению окраски ткани при добавлении соответствующего субстрата.
LUC – ген кодирует фермент люциферазу (клонирована из бактерий и светлячка). Она вызывает свечение трансформированных клеток. Бактериальный фермент состоит из двух субъединиц. Для определения активности ферментов необходимо специальное оборудование - флуориметр и цифровая видеокамера с амплификатором светового сигнала. Фермент теряет активность при действии детергентов и повышенной температуры. Замена селективных генов на репортерные при отборе трансгенных растений часто весьма желательна, так как возможность потенциального риска для окружающей среды и здоровья человека при использовании репортерных генов практически исключена. Однако область применения репортерных генов шире, чем просто контроль трансгеноза. Другое, и, очевидно, более важное назначение репортерных генов состоит в том, чтобы выявлять (по возможности количественно) временные и пространственные особенности экспрессии данного конкретного гена, будь то собственного или чужеродного. Присоединение репортерного гена к одной лишь промоторной области позволяет исследовать в "чистом виде" ее роль в регуляции экспрессии изучаемого гена на уровне транскрипции.
Замена белок-кодирующей области гена на репортерную при сохранении участка, кодирующего 5'-концевую не транслируемую последовательность мРНК, позволяет оценить роль этой последовательности в процессах транспорта мРНК из ядра в цитоплазму и инициации трансляции.
Одно из самых важных свойств гена - способность к экспрессии. За это свойство отвечают различные генетические элементы, которые мы должны встроить в векторную молекулу, несущую ген.
2.1 Регуляция экспрессии гена у прокариот
Многие бактериальные гены устроены таким образом, что они способны функционировать с существенно разной эффективностью. У E. coli, например, относительное содержание различных белков варьирует в очень широких пределах (от менее чем 0.1% до 2%) в зависимости от их функций; при этом каждый белок в хромосоме E. coli кодируется единственным геном. Такие вариации обусловлены действием системы контроля генной экспрессии, которая осуществляется главным образом на уровне транскрипции ДНК. Таким образом, чаще всего уровень активности гена связан с количеством синтезируемой на нем мРНК, то есть с активностью фермента РНК-полимеразы.
Последовательности ДНК, расположенные перед началом структурного гена и определяющие степень активности РНК-полимеразы, называются регуляторными последовательностями. Одна из таких последовательностей представляет собой участок ДНК, с которым связывается РНК-полимераза. Этот участок называется промотором.
Последовательность оснований промотора определяет частоту инициации синтеза иРНК, причем замена одного основания в этой последовательности может привести к уменьшению частоты инициации в 1000 раз.
Промотор может быть сильным и слабым. Сильный промотор инициирует синтез иРНК часто, слабый - гораздо реже. С другой стороны, промотор может быть регулируемым и нерегулируемым. Например, промотор β-лактамазы нерегулируемый, но сильный. Использование таких промоторов не всегда удобно. Дело в том, что большое количество белка может блокировать рост бактерий. Кроме того, интенсивная транскрипция рекомбинантной ДНК может помешать репликации плазмиды, и она будет утрачена. Поэтому удобнее использовать регулируемые сильные промоторы (индуцибельные), включение которых, а значит и синтез чужеродного белка можно осуществить, когда получена большая бактериальная масса.
Некоторые плазмидные векторы содержат промотор, работа которого регулируется температурочувствительным белковым продуктом гена-репрессора. Белок-репрессор активен при определенных температурах и блокирует действие промотора. Повысив температуру до 42 оС, можно "включить" промотор и быстро получить большое количество требуемого белка.
В качестве индуцибельных промоторов используют также Trp-промотор триптофанового оперона, который регулируется триптофановым голоданием, lac-промотор лактазного оперона, который индуцируется субстратом (лактозой) и другие.
Интенсивность транскрипции определенных структурных генов может зависеть от эффективности ее терминации, в частности, от того, как часто РНК-полимераза прекращает синтез РНК, не дойдя до этих генов. Сравнительно недавно обнаружено, что во многих оперонах Е.coli, контролирующих биосинтез аминокислот, между промотором и первым структурным геном имеется терминирующая последовательность. В определенных условиях происходит образование терминирующего сигнала, ослабляющего интенсивность транскрипции.
Это явление получило название аттенуации, а участок ДНК - аттенуатор (ослабитель). Как и репрессия, аттенуация зависит от присутствия в среде соответствующих аминокислот. Например, избыток триптофана в клетках триптофанзависимых мутантов, дефектных по репрессору, только 1 из 10 молекул РНК-полимеразы, начавших транскрипцию, преодолевает аттенуатор и считывает структуру генов. Удаление триптофана втрое повышает эффективность транскрипции генов. В отличие от репрессии, антенуация зависит не от самой аминокислоты, а от триптофанил - тРНК (аминокилоты, присоединенной к соответствующей тРНК).
На эффективность продуктивности рекомбинантной ДНК в существенной степени влияет количество копий этой ДНК в расчете на клетку. Суммарная активность экспрессируемого гена растет с ростом копийности плазмиды. Таким образом, используя многокопийные плазмиды, можно достичь сверхсинтеза нужных белковых продуктов. Обычно используемые плазмидные векторы (pBR 322 и др.) поддерживаются в клетке в количестве 20-50 копий. Сейчас исследователи имеют в своем распоряжении температурно-чувствительные мутантные плазмиды, способные накопить до одной-двух тысяч копий на клетку, не нарушая ее жизненно-важных функций. Таким образом можно достичь сверхпродукции плазмидных генов бактериальными штаммами-сверхпродуцентами.
Регуляция экспрессии у E. coli происходит также и на уровне трансляции. Последовательность оснований длиной 6-8 нуклеотидов, расположенная непосредственно перед инициирующим кодоном АУГ, определяет эффективность трансляции. Эта последовательность представляет собой участок связывания мРНК с рибосомой. Как правило, он отстоит на 8 нуклеотидов от инициирующего кодона, и его сдвиг в ту или иную сторону может резко снижать эффективность трансляции соответствующей мРНК. Описанный участок называется последовательностью Шайна-Дальгарно, по имени исследователей, впервые его идентифицировавших.
В состав вектора кроме всего прочего должен входить маркерный ген, позволяющий селектировать измененные клетки. Часто в качестве сел