Мембранная энзимология
Мембранная энзимология
Введение
Биомембрана - это не просто некая пассивная структура, ограничивающая водные компартменты. Уже краткое знакомство с типами ферментов, связанных с мембранами, показывает, насколько разнообразны ассоциированные с мембранами каталитические активности.
Трансмембранные ферменты, катализирующие сопряженные реакции на противоположных сторонах мембраны. Типичные ферменты этого класса имеют несколько активных центров. Характерными примерами могут служить окислительно-восстановительные ферменты, например фотосинтетические реакционные центры растений и бактерий или цитохром с-оксидаза митохондрий. Расположенные на противоположных сторонах мембраны активные центры этих ферментов сопряжены друг с другом с помощью потока электронов, генерирующего трансмембранный электрический потенциал. К этому классу ферментов могут быть отнесены также многие рецепторы. Связывание лиганда с доменом, локализованным с наружной стороны клеточной мембраны, приводит к изменениям в цитоплазматическом домене фермента, которые в свою очередь инициируют клеточный ответ. В этом случае через мембрану переносится информация, а не заряды или какие-либо растворенные молекулы. Показано, что некоторые рецепторы являются тирозиновыми протеинкиназами и, следовательно, представляют собой мембранные ферменты, обладающие каталитической активностью. Большинство же мембранных рецепторов сами по себе не катализируют никаких химических реакций и не являются в этом смысле ферментами.
Трансмембранные ферменты, участвующие в транспорте веществ. Многие мембранные белки участвуют в транспорте молекул через бислой. Активный транспорт может быть сопряжен с гидролизом ATP, как в случае Са** - АТРазы саркоплазматического ретикулума. Движущей силой активного транспорта могут быть также ионные градиенты. Например, транспорт лактозы через плазматическую мембрану Е. coli с помощью лактозопермеазы сопряжен с поглощением протонов и зависит от трансмембранного градиента электрохимического потенциала.
Белки, являющиеся компонентами электронтранспортных цепей. Наиболее типичные ферменты этого класса - компоненты дыхательной цепи митохондрий, заканчивающейся, цитохром с-оксидазой; ферменты системы электронного транспорта микросом, включающие цитохром Р450 и цитохром bs; элементы фотосинтетической электронтранспортной цепи в тилакоидах. Локализация компонентов электронтранспортных цепей в мембране приводит к увеличению их локальной концентрации, что позволяет значительно ускорить перенос электронов между молекулами. Основной вопрос состоит в том, являются ли компоненты соответствующих электронтранспортных цепей свободно диффундирующими в плоскости мембраны белками или они находятся в мембране в виде более или менее долгоживущих суперкомплексов.
Ферменты, способные использовать мембраносвязанные субстраты. В этот класс могут входить ферменты, участвующие в метаболизме компонентов мембраны: фосфолипидов, гликолипидов, полиизопреноидных соединений и стероидов, а также ферменты, участвующие в процессинге мембранных и секреторных белков. В большинстве случаев эти ферменты являются интегральными мембранными белками, но иногда представляют собой растворимые белки, лишь временно связанные с мембраной. Примерами белков этого типа являются лидерная пептидаза из Е. coli и фосфолипаза С, связанные с мембраной посредством гликозилфосфа-тидилинозитольиого якоря.
Ферменты, использующие водорастворимые субстраты. Многие мембраносвязанные ферменты используют растворимые субстраты. В некоторых случаях фермент локализуется в такой области мембраны, где велика концентрация субстрата. Например, ацетилхолинэстераза, катализирующая гидролиз ацетилхолина, по-видимому, фиксируется в постсинаптической мембране с помощью ковалентной сшивки с фосфатидилинозитольным гликолипидом. Целый ряд ферментов, участвующих в гидролизе крахмала и белков, прикрепляется к мембранам микроворсинок кишечника с помощью гидрофобных доменов, расположенных в N-концевой части полипептидов. Вероятно, связь этих пищеварительных ферментов с мембраной позволяет создать локально высокую концентрацию растворимых молекул, что способствует их эффективному поглощению клеткой. В качестве примера можно привести два фермента из этой группы: сахараза-изомальтаза и мальтаза-глюкоамилаза.
Ферменты, образующие мембраносвязанный комплекс для облегчения канализации субстрата. Мембраны могут служить своеобразным организующим каркасом, с которым связываются периферические ферменты с образованием мультиферментного комплекса. Имеются косвенные данные о том, что участвующие в реакциях цикла Кребса ферменты матрикса митохондрий связываются с мембраной таким образом, что продукт одного фермента становится субстратом другого, не выходя за пределы мультиферментного комплекса. Такой механизм мог бы облегчить метаболические превращения. Поскольку ферменты в суперкомплексах связаны друг с другом слабыми связями, с определенностью продемонстрировать их существование довольно трудно.
Ферменты, которые совершают челночные перемещения между цитозолем и мембраной и активность которых модулируется связыванием с мембраной. Эта группа мембранных ферментов обнаружена недавно. Они способны связываться либо прямо с поверхностью фосфолипидного бислоя, либо со специфическими белковыми рецепторами. Чаще всего эти ферменты активируются при связывании с мембраной, но иногда наблюдается и их инактивация. Типичными примерами ферментов, активирующихся при связывании, являются пируватоксидаза из Е. cod, протеинкиназа С и некоторые ферменты, участвующие в каскаде свертывания крови.
В первую очередь следует отметить ключевую роль липидного окружения мембранных ферментов в проявлении их активности. Этот фактор может очень сильно усложнить интерпретацию кинетических данных и потребовать значительных экспериментальных усилий в реконструкции очищенных интегральных мембранных ферментов с фосфолипидами, с тем чтобы приблизить условия работы фермента к условиям in vivo или по крайней мере создать для фермента подходящее окружение.
1. Некоторые специфические положения, имеющие отношение к активности мембранных ферментов
Проблема изучения функционирования мембранных ферментов сводится по существу к проблеме гетерогенного катализа. Эти ферменты находятся не в непрерывной гомогенной среде, а локализованы в биомембране, мицелле, везикуле или иной мембранной системе. Мембранные ферменты весьма чувствительны к локальному окружению, которое, вообще говоря, может существенно отличаться от окружения в растворе. Более того, для осуществления каталитической реакции фермент и мембраносвязанный субстрат должны находиться в одной и той же мембране или. везикуле, поэтому при анализе кинетических свойств мембранных ферментов часто возникают проблемы, связанные с их пространственным разделением. Рассмотрим некоторые положения, касающиеся кинетических аспектов работы мембранных ферментов как in situ, так и в модельных системах.
1. Пространственное разделение фермента и субстрата. Фермент и субстрат должны иметь возможность взаимодействовать. Предположим, что мы изучаем очищенный интегральный мембранный фермент в растворе детергента с неполярным липофильным субстратом. И фермент, и субстрат солюбилизированы в детергентных мицеллах, но для того, чтобы мог осуществляться катализ, они должны находиться в одних и тех же мицеллах. При избытке детергента увеличивается вероятность того, что фермент и субстрат будут находиться в разных мицеллах, и лимитирующей стадией в этом случае станет диффузия субстрата в ферментно-детергентные мицеллы. При этом скорость работы фермента зависит от поверхностной концентрации субстрата в мицелле, а не от объемной концентрации. При работе с очень гидрофобными субстратами часто возникает другая проблема. Такие субстраты могут не до конца солюбилизироваться в мицеллах или мембранных везикулах, часть их коагулирует с образованием комков или микроскопических кристаллов, в которые фермент не проникает. Небольшое число ферментов может работать в вывернутых мицеллах, когда содержащие воду структуры диспергированы в органическом растворителе, но это скорее исключение, чем правило.
Иные проблемы при измерении активности мембранных ферментов возникают, когда либо фермент, либо субстрат находится как в мембраносвязанной, так и в растворенной формах. Примерами такого рода служат "поверхностные" ферменты - липазы или факторы свертывания крови. Для анализа кинетики таких систем необходимо знать соотношение между формами фермента в данных экспериментальных условиях и каталитические активности каждой из форм. Во всех этих случаях смысл величин максимальной скорости и константы Михаэлиса может быть совершенно иным, чем для ферментов, активность которых измеряется в гомогенной среде, что сильно осложняет интерпретацию этих параметров.
Гьстерезис и гетерогенность. Мембранные ферменты обладают и другими особенностями, затрудняющими интерпретацию кинетических данных. Эти особенности связаны с солюбилизацией. Каталитическая активность мембранных ферментов часто очень сильно зависит от используемого детергента или фосфолипида. Обычно активность мембранных ферментов измеряют в смеси, содержащей детергент и экзогенно добавленный фосфолипид. Кроме того, ферментный препарат нередко содержит соочищаемые с ним эндогенные липиды. В таких условиях физическое состояние фермента, в частности степень его агрегации, оказывается весьма неопределенным и скорее всего гетерогенным. Часто в одной и той же среде, компоненты которой смешивались в разной последовательности, получают совершенно разные ферментативные активности. Такая зависимость от предыстории препарата являет собой пример гистерезиса и весьма типична для мембранных ферментов. По существу фермент "застревает" в метастабильном состоянии и не может приобрести наиболее стабильную "рабочую конформацию". Например, простое смешивание солюбилизированного мембранного белка с фосфолипидными великулами скорее всего не приведет к встраиванию белка в липосомы. Для достижения успешной реконструкции разработаны специальные процедуры, позволяющие избежать перехода системы в нежелательное метастабильное состояние. В качестве примера фермента, образующего крупные агрегаты, можно привести бактопренолкиназу, очень гидрофобный белок из Staphylococcus aureus. Его активность не зависит от степени агрегации, что встречается далеко не всегда.
Явление гистерезиса сильно зависит от типа фосфолипида, поэтому данные по специфичности липидов в отношении активности отдельных мембранных ферментов часто оказываются весьма ненадежными.
Ферметы в везикулах. Часто в исследованиях используют мембранные ферменты, встроенные в бислой замкнутых везикул. Это могут быть либо ферменты in situ, содержащиеся в изолированных природных мембранах, либо очищенные ферменты, встроенные в липосомы. В таких экспериментах возникают свои проблемы. Наиболее очевидная из них связана с тем, что активный центр фермента может находиться внутри везикулы и, следовательно, быть изолированным от растворимого в воде субстрата. С этим связана проблема так называемой скрытой ферментативной активности, выявляемой только после того, как везикулы по тем или иным причинам станут проницаемыми или разрушатся. Это явление часто используют для определения ориентации мембранного фермента в везикуле. Доля скрытой активности прямо соответствует доле фермента, активный центр которого локализован внутри везикулы. При этом можно использовать только такие субстраты, которые не способны проникать через мембрану.
Проблемы другого рода возникают при измерении активности трансмембранных ферментов, которые катализируют реакции, сопровождающиеся транспортом веществ или зарядов через бислой. Примерами таких ферментов могут служить цитохром с-оксидаза, катализирующая перенос электронов через мембрану и транспорт протонов в противоположном направлении, а также разнообразные АТР-зависимые ионные насосы, например Са2+ - АТРа-зы. При встраивании в везикулы преимущественно в одной ориентации относительно внутренней и наружной сторон везикулы такие ферменты создают трансмембранный градиент концентрации веществ или электрический потенциал. Именно в этом и состоит их физиологическая функция. В везикулах с маленьким внутренним объемом, однако, этот градиент будет создаваться очень быстро, что приведет к фактическому уменьшению числа оборотов фермента, если не будут приняты соответствующие меры. Это уменьшение связано с тем, что химическая работа, совершаемая при переносе молекулы, иона или электрона против существующего градиента, увеличивается с увеличением этого градиента. При градиенте выше определенного уровня фермент вообще перестает работать. Система, в которой происходит такое уменьшение активности, называется "сопряженной", а сама эта активность является мерой того, насколько целостны везикулы и в какой мере предотвращена утечка ионов или молекул в направлении градиента, созданного с помощью фермента. Степень сопряжения можно оценить, измеряя активность фермента в условиях, когда градиенту не дают образовываться. Например, градиент электрического потенциала, создаваемый на мембране везикулы цитохром с-оксидазой, можно разрушить, добавив в среду ионофор, увеличивающий ионную проницаемость бислоя. При этом необходимо, чтобы внутри везикулы была высокая концентрация буфера, поскольку в противном случае утилизация протонов внутри везикулы с образованием воды приведет к быстрому и сильному защелачиванию внутренней среды, что может повлиять на ферментативную активность.
Работа некоторых ионных каналов и ферментов прямо регулируется трансмембранным потенциалом. С помощью флуоресцентных и спиновых меток показано также, что при наличии разности потенциалов может существенно увеличиваться микровязкость бислоя. Это тоже сказывается на активности ферментов. И наконец, утверждается, что трансмембранный потенциал влияет на степень агрегации некоторых мембранных белков, но физиологическая роль этого явления неизвестна. Все эти эффекты наблюдаются только на замкнутых везикулах.
Влияние поверхностного потенциала. Большинство биомембран содержат значительное количество отрицательно заряженных фосфолипидов, а следовательно, несут суммарный отрицательный заряд. С этим отрицательным зарядом, распределенным по поверхности мембраны, связан поверхностный электрический потенциал. Он вызывает уменьшение концентрации отрицательно заряженных ионов в прилегающем к мембране слое по сравнению со средней объемной концентрацией и увеличение локальной концентрации положительно заряженных ионов вблизи поверхности мембраны. Поверхностный потенциал, изменяя локальную концентрацию заряженных субстратов и протонов, может довольно существенным образом сказаться на поведении ферментов, активный центр которых локализован у поверхности мембраны. При физиологической ионной силе этот эффект будет проявляться главным образом в области, непосредственно примыкающей к заряженной поверхности мембраны, но тем не менее может оказаться весьма существенным. Влияние поверхностного потенциала проявляется в изменении измеряемой величины Км для заряженных субстратов или в сдвиге рН-зависимости активности фермента, поскольку локальная концентрация любого заряженного вещества будет либо выше, либо ниже, чем концентрация в объеме. Поэтому кинетические характеристики мембранного фермента, встроенного в везикулы, которые получены из разных фосфолипидов и имеют разную поверхностную плотность заряда, могут различаться, и в свою очередь отличаться от свойств фермента, находящегося в нейтральных детергентных мицеллах.
Подобные эффекты наблюдались для некоторых митохондриальных и микросомных ферментов - как in situ, так и встроенных в фосфолипидные везикулы, например для арилсульфатазы С, использующей отрицательно заряженный субстрат, или для моноаминооксидазы, катализирующей превращения катионного субстрата. Изменение липидного окружения /3-гидроксибути-ратдегидрогеназы также влияет на величины Км для NADH. Полагают, что это влияние обусловлено изменением плотности поверхностного заряда.
В заключение отметим, что в литературе активно обсуждалась роль поверхностного заряда тилакоидных мембран как фактора, регулирующего латеральное распределение мембранных белков и взаимодействие между мембранами. В этом случае, однако, поверхностный заряд мембраны определяется главным образом белковыми компонентами, а не липидами. Каж бы то ни было, ясно, что учет поверхностного потенциала совершенно необходим при анализе работы многих мембранных ферментов in vivo, а также при реконструировании систем из очищенных компонентов, моделирующих природные структуры.
2. Реконструкция мембранных ферментов
После того как мембранный фермент очищен, для изучения его каталитической активности желательно, а часто и необходимо реконструировать его с фосфолипидами. Кинетические характеристики многих ферментов in situ и после очистки и реконструкции одинаковы. Несмотря на то что свойства фермента в искусственных системах могут изменяться, изучение очищенных и реконструированных ферментов дает большие преимущества. В частности, а такой системе ие протекают различные конкурирующие реакции, присущие биомембранам. Удается устранить и другие осложняющие исследование проблемы. Использование реконструированной системы позволяет не только охарактеризовать изолированную систему, но и определить минимальное число компонентов, необходимых для проявления тех или иных биохимических активностей. С помощью реконструкции в фосфолипидные везикулы, например, было показано, что за поглощение лактозы клетками Е. coli ответствен только один белок, лактозопермеаза. Аналогичным способом было однозначно определено минимальное число белковых компонентов, необходимых для реконструкции дыхательной цепи Е. coli и системы аденилатциклазного гормонального ответа.
Для встраивания солюбилизированных в детергенте очищенных мембранных компонентов в модельные мембранные системы разработано несколько методов. Чаще всего ферменты встраиваются в однослойные фосфолипидные везикулы. Характеристики же белков, активно или пассивно увеличивающих ионную проводимость мембраны, часто определяют после их встраивания в плоский бислой. Плоские мембраны удобны для электрических измерений, позволяющих определить величину ионной проводимости и прочие производные характеристики, например зависимость доли открытых каналов от приложенного электрического напряжения. В таких системах, однако, трудно или даже невозможно определить биохимические характеристики белка, в частности его каталитические активности, отличные от ионной проницаемости.
2.1 Встраивание мембранных ферментов в липидные везикулы
Для встраивания мембранного белка в липидную везикулу прежде всего необходимо избавиться от находящегося в препарате белка детергента, который, если он присутствует в значительных количествах, дестабилизирует фосфолипидный бислой. Обычно детергент удаляют уже из смеси белка с фосфолипидом, но в некоторых случаях белок очищают от детергента до начала реконструкции. Для удаления детергента используют гель-фильтрацию, диализ или адсорбцию на поверхности шариков из полистирола. Последний способ применяют в первую очередь для удаления тритона Х-100. Все перечисленные методы довольно эффективны, однако следует иметь в виду, что даже после самых интенсивных обработок в системе обычно всегда остается то или иное количество связанного детергента.
Методы реконструкции можно разделить на две группы.
I. Процедуры, при которых белок предварительно очищают от детергента, а затем проводят реконструкцию.
II. Процедуры, в которых белки и фосфолипиды смешивают в присутствии детергента, а затем удаляют детергент до образования протеолипосом. Единственное ограничение здесь состоит в следующем: выбранный фосфолипид должен быть способен к формированию стабильных бислоев. Нельзя, например, использовать ненасыщенные фосфатидилэтаноламины. Весьма удобен суммарный фосфолипид из соевых бобов, поскольку он относительно недорог, легкодоступен и применим во многих случаях.
I. Реконструкция без избытка детергента
Условия включения мембранных белков в предварительно сформированные фосфолипидные везикулы часто совпадают с условиями, способствующими слиянию фосфолипидных везикул. В основе обоих процессов лежат определенные нарушения бислойной структуры, или образование "дефектов", которые могли бы облегчить как встраивание белка, так и слияние везикул. Механизмы этих процессов изучены мало. Возможной трудностью в применении этих методов является агрегация белка.
1. Инкубация белка с заранее полученными везикулами. Этот способ применим далеко не всегда и используется для реконструкции не пронизывающих бислой белков с ограниченной гидрофобной поверхностью, например цитохрома bs и /З-гидроксибутиратдегидрогеназы. Конформация встроенного таким образом белка, однако, отличается от нативной.
Реконструкция с участием амфифильных катализаторов. В ряде работ было показано, что добавление в белково-фосфолипидную смесь амфифильных веществ в низких концентрациях облегчает встраивание в везикулы таких мембранных ферментов, как бактериородопсин или цитохром с-оксидаза. В качестве амфифильных веществ использовали холестерол, короткоцепочечные фосфатидилхолины и жирные кислоты. Данный способ хорош тем, что в нем не используются какие-либо грубые процедуры, в том числе обработка избытком детергентов, однако пока он мало распространен.
Замораживание-оттаивание/обработка ультразвуком. В некоторых случаях с успехом используется метод замораживания-оттаивания смеси с последующей обработкой ультразвуком. Эта методика, однако, применяется нечасто из-за опасности денатурации белка. Иногда для облегчения реконструкции используют простую обработку ультразвуком. Вероятнее всего, белок вначале включается в маленькие везикулы, обладающие высокой кривизной. Замораживание-оттаивание, возможно, нужно для слияния мелких протеолипосом в более крупные и более однородные по размерам.
2. Реконструкция с использованием детергентов
В настоящее время для реконструкции гораздо чаще используют методики, состоящие в солюбилизации смеси белка и фосфолипида детергентом и последующем удалении детергента. После его удаления белок и фосфолипид спонтанно формируют однослойные везикулы, вполне пригодные для энзимологических исследований. Обычно выбирают детергенты с высокой критической концентрацией мицеллообразования и малыми размерами мицелл, с тем чтобы их можно было легко удалить диализом или гельфильтрацией. Чаще всего используют холат натрия и октилглюкозид. Распределение полученных везикул по размерам определяется соотношением детергент: фосфолипид, а также способом и скоростью удаления детергента. Обычно используют диализ как более медленный способ. В качестве примеров можно привести встраивание цитохром с-оксидазы и Na + /K+-ATPa3bi.
С помощью такой методики можно ввести в везикулы отличные от фосфолипидов вещества, например холестерол или убихинон. В ряде случаев возникает необходимость в достаточно быстром удалении детергента, особенно если белок нестабилен при его избытке. Тогда применяют гельфильтрационную хроматографию, тоже позволяющую эффективно отделить белково-липидные везикулы от детергента. На рис.1 показан профиль элюции с такой колонки.
Еще более быстрым является метод разведения, когда белково-липидно-детергентную смесь разводят до концентрации детергента много меньшей, чем критическая концентрация мицеллообразования. При этом спонтанно образуются белково-фосфолипидные везикулы, которые можно отделить от детергента центрифугированием.
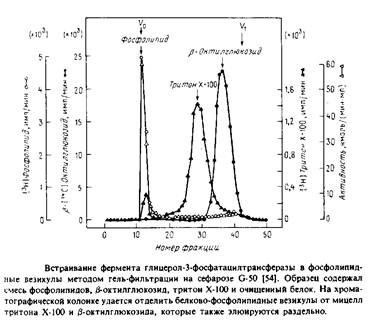
Обычно используемый для очистки мембранных ферментов тритон Х-100 весьма неудобен при реконструкции, поскольку его трудно Удалить из системы. Для удаления тритона применяют шарики из полистирола, и одна из проблем - потеря белка из-за его сорбции на поверхности шариков. В качестве примера белка, реконструируемого этим методом, можно привести натриевый канал.
И наконец, для реконструкции применяли метод, основанный на диспергировании смеси холестерол-фосфолипид-белок в диэтиловом эфире и последующем испарении обращенной фазы.
Однако маловероятно, что многие белки выдержат такую процедуру.
3. Некоторые характеристики реконструированных белково-фосфолипидных везикул
В результате применения всех методов, разработанных для реконструкции мембранных белков, образуются однослойные везикулы. Характеристики некоторых из них детально изучены. Это, в частности, протеолипосомы, содержащие цитохром с-оксидазу, Ыа + /К+-АТРазу, цитохром Ь5 и гликофорин. Особый интерес представляют:
1) средний размер везикул и распределение их по размерам;
2) распределение белка в популяции везикул;
3) ориентация белка по отношению к плоскости бислоя;
4) проницаемость везикул. Эти характеристики особенно важны, если фермент катализирует трансмембранный перенос веществ или ионов. Для количественного анализа кинетики таких ферментов необходимо знать внутренний объем везикул, их проницаемость и распределение белка. Для ферментов, катализирующих векторные реакции, молекулы, которые имеют противоположную ориентацию и находятся в одной везикуле, будут работать "вхолостую", компенсируя друг друга при создании результирующего ионного градиента.
Размер везикул. Размер везикул сильно зависит от процедуры реконструкции. Для его определения лучше всего использовать методы электронной микроскопии или гельфильтрации. При удалении детергента диализом образуются протеолипосомы диаметром от 500 до 2500 А в зависимости от белка и используемого метода. При любом способе реконструкции размеры получаемых везикул варьируют в довольно широких пределах; протеолипосомы нужного диаметра можно затем отделить с помощью гельфильтрационной хроматографии.
Распределение белка. Когда при реконструкции используется диализ для удаления детергента из смеси, содержащей избыток ли-пида, распределение белка между полученными везикулами должно подчиняться распределению Пуассона. Однако на самом деле оно может зависеть от встраиваемого белка и методических деталей. Следует отметить, что при спонтанном встраивании в предварительно полученные липосомы некоторые белки включаются преимущественно в везикулы малых размеров. Цитохром bs, например, в 200 раз эффективнее встраивается в везикулы диаметром 200 А, чем 1000 А.
Ориентация белка. Этот вопрос важен с точки зрения энзимологии, поскольку белок, активный центр которого локализован внутри везикулы, может быть недоступен для субстрата. Как ни удивительно, многие ферменты, например цитохром с-оксидаза, Ыа + /К+-АТРаза, глицерол-3-фосфатацил-трансфераза, бактериородопсин, способны встраиваться в мембрану таким образом, что их активный центр с вероятностью 75-95Чо оказывается снаружи везикулы. Везикулы, содержащие цитохром с-оксидазу, с помощью ДЭАЭ-хроматографии удается разделить на две популяции: с активным центром, ориентированным внутрь, и с активным центром, ориентированным наружу. В принципе такой способ разделения пригоден и для других белков.
Причина такой асимметрии встраивания неизвестна. В некоторых случаях ориентированная наружу часть фермента имеет больший размер, а встраивание белка более массивной частью внутрь везикулы невыгодно. Поскольку преимущественная ориентация наблюдается и при встраивании белков в крупные липосомы, по-видимому, асимметрия встраивания не связана с кривизной везикулы, как в случае распределения липидов в везикулах малых размеров. Вероятно, важную роль играют какие-то кинетические факторы, однако их трудно оценить, поскольку неясна природа переходных состояний.
Нельзя не отметить также, что некоторые белки встраиваются в везикулы неправильным образом, т.е. в конформации, отличной от нативной. Наиболее типичный пример - цитохром bs, который в зависимости от метода реконструкции может находиться в одной из двух конформации. Такое поведение характерно также для компонента Н-2К главного комплекса гистосовместимости у мышей и, возможно, для белка оболочки бактериофага Ml 3. Все эти белки имеют один трансмембранный гидрофобный домен, и при некоторых условиях он включается в бислой в U-образной конфигурации, когда N - и С-концевые аминогруппы экспонированы наружу.
Проницаемость. Важность этой характеристики для ферментов, катализирующих перенос веществ или ионов через бислой, несомненна. Многие системы транспорта и ионные насосы изучали после встраивания их в протеолипосомы, и очевидно, что протеолипосомы, пригодные для таких исследований, должны обладать достаточно низкой проницаемостью. Присутствие белка обычно приводит к увеличению проницаемости везикул, но степень этого увеличения очень сильно зависит от выбора липида и от числа молекул белка на везикулу. Высказывалось предположение, что молекулы некоторых липидов благодаря их форме лучше упаковываются вокруг встроенных в бислой белков; тем самым сглаживаются дефекты структуры на границе белок-липид и уменьшается их проницаемость для растворенных веществ. Однако прямые доказательства по этому поводу отсутствуют.
3.1 Влияние липидов на активности мембраносвязанных ферментов
Каталитическая активность многих мембранных ферментов зависит от липидов. Липиды при этом могут выполнять две функции:
1) создавать необходимую среду;
2) действовать как аллостерический регулятор, модулирующий активность фермента. В первом случае липиды не только предотвращают денатурацию ферментов, но и облегчают взаимодействие ферментов друг с другом и с прочими мембраносвязанными компонентами, в частности с ли-пофильными субстратами. В качестве аллостерических эффекторов липиды обычно активируют фермент преимущественно путем стабилизации его в определенной конформации. В принципе две эти функции липидов совершенно различны, однако разграничить их экспериментально бывает крайне трудно. В идеальной экспериментальной системе аллостерическим эффектором должен быть специфический липид, а необходимое для работы окружение фермента должно создаваться всей основной массой липидов в бислое. К сожалению, пока обнаружен только один пример абсолютной специфичности фермента к определенному липиду. /З-Гидроксибутиратде-гидрогеназе для проявления каталитической активности необходим именно фосфатидилхолин, в большинстве же случаев ферменты достаточно эффективно активируются различными липидами. А поскольку любой липид может в той или иной степени выполнять как функцию окружения, так и функцию специфического аллостерического эффектора, различить эти два эффекта становится практически невозможно. На ферментативную активность может влиять также физическое состояние бислоя, в частности поверхностная плотность заряда и вязкость. Систематически подбирая липиды разной структуры и изменяя физическое состояние мембраны, можно установить корреляции между активностью фермента и этим" параметрами, но само по себе такое исследование еще не позволяет разграничить две функции липидов. Изменение физического состояния бислоя может влиять на взаимодействие с ферментом любых липидов, в том числе и тех, которые функционируют как аллостерические эффекторы. При изучении ферментов, субстратом которых служат липофильные соединения, возникают особые проблемы, поскольку такие субстраты должны быть включены в бислои до или после получения везикул, а большие концентрации растворенного в бислое субстрата не могут не сказаться на физическом состоянии модельной мембраны.
Для исследования влияния липидов на мембранные ферменты применяется еще одна стратегия - так называемый метод смешанных мицелл. Фермент растворяют в детергенте, не активирующем его, и к смеси добавляют липиды. Многие мембранные ферменты сохраняют определенную активность и в детергенте, причем такая активность сильно зависит не только от природы фермента, но и от выбранного детергента, а также, возможно, от наличия эндогенных липидов в препарате очищенного фермента. Вообще говоря, для метода смешанных мицелл желательно полностью освободить фермент от липида, однако для этого иногда приходится использовать весьма грубые процедуры, которые могут привести к денатурации белка. Методы полного обезжиривания обычно основаны на пропускании препарата фермента через среду с большим избытком детергента. Для этого используют гель-фильтрацию, центрифугирование в градиенте плотности сахарозы или связывание фермента с каким-либо твердым носителем с последующим промыванием избытком детергента.
Метод смешанных мицелл имеет еще и то преимущество, что липофильный субстрат можно добавить в мицеллах того же детергента, хотя в этом случае могут возникнуть трудности, связанные с пространственным разделением фермента и субстрата. Наблюдаемые в такого рода системах эффекты липидов являются преимущественно аллостерическими, поскольку здесь нет бислоя, а связывание липидов с белком происходит в глобулярной мицелле в присутствии большого количества детергента. К сожалению, физическое состояние комплекса фермент-детергент-фосфолипид определить практически невозможно, и это серьезный недостаток описываемого подхода.
Любые эффекты, наблюдаемые в такой системе для какого-либо липида, должны быть получены с использованием нескольких не активирующих фермент детергентов. Только в этом случае можно быть уверенным, что детергент нейтрален. К сожалению, такие работы встречаются не часто.
Результаты исследования многих систем позволяют сделать несколько общих выводов.
Для активации фермента очень редко бывает необходим липид с какой-то строго определенной структурой. Безусловно, одни липиды активируют данный фермент с большей эффективностью, чем другие, однако такое предпочтение может зависеть от условий измерения, а уж говорить о его физиологическом значении как минимум преждевременно. Вполне может оказаться, что липид, с высокой эффективностью активирующий фермент, вообще не присутствует в мембране, из которой этот фермент выделен. Поэтому к утверждениям о специфичности липида следует относиться с. осторожностью.
Измеряемая в системе со смешанными мицеллами зависимость скорости ферментативной реакции от концентрации липида обычно свидетельствует о высокой кооперативности процесса. Такое поведение можно объяснить, в частности, тем, что липиды связываются некооперативио с несколькими эквивалентными центрами на ферменте, но активными являются только те молекулы фермента, у которых занята большая часть липидсвязывающих центров. Нередко при активации фермента липидом наблюдается оптимум в концентрационной зависимости, вероятно связанный с достижением определенного соотношения между липидом и детергентом и образованием в такой смеси конкретных структур.
Сама по себе бислойная структура не является необходимой для активации ферментов, поскольку многие ферменты проявляют активность в присутствии детергента или в составе липидио-детергентных мицелл. Известны случаи, когда мембранные ферменты эффективно активируются липидами, вообще не формирующими стабильные бислои.
Важным параметром, определяющим активность большинства мембранных ферментов, безусловно является физическое состояние бислоя. Однако четких данных о физиологической регуляции ферментативной активности с помощью этого параметра in vivo нет. При пер