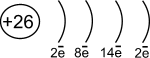Методические особенности изучения темы "Железо" на уроках химии в средней школе
Железо играло и играет исключительную роль в материальной истории человечества. Первое металлическое железо, попавшее в руки человека, имело, вероятно, метеоритное происхождение. Руды железа широко распространены и часто встречаются даже на поверхности Земли, но самородное железо на поверхности крайне редко. Вероятно, еще несколько тысяч лет назад человек заметил, что после горения костра в некоторых случаях наблюдается образование железа из тех кусков руды, которые случайно оказались в костре. При горении костра восстановление железа из руды происходит за счет реакции руды как непосредственно с углем, так и с образующимся при горении оксидом углерода (II) СО. Возможность получения железа из руд существенно облегчило обнаружение того факта, что при нагревании руды с углем возникает металл, который далее можно дополнительно очистить при ковке. Получение железа из руды с помощью сыродутного процесса было изобретено в Западной Азии во 2-м тысячелетии до нашей эры. Период с 9 – 7 века до нашей эры, когда у многих племен Европы и Азии развилась металлургия железа, получил название железного века, пришедшего на смену бронзовому веку. Усовершенствование способов дутия (естественную тягу сменили меха) и увеличение высоты горна (появились низкошахтные печи — домницы) привело к получению чугуна, который стали широко выплавлять в Западной Европе с 14 века. Полученный чугун переделывали в сталь. С середины 18 века в доменном процессе вместо древесного угля начали использовать каменно-угольный кокс. В дальнейшем способы получения железа из руд были значительно усовершенствованы, и в настоящее время для этого используют специальные устройства — домны, кислородные конвертеры, электродуговые печи.
Целью моей работы является освещение основных наиболее остро стоящих экологических проблем, связанных с железом и его соединениями, и возможные пути их решения.
Задачи:
1. Обзор состояния данного вопроса в современной российской школе.
2. Анализ школьных программ и учебников, а также другой литературы, показывающих как тема: «Железо и его соединения»изучаются в средней школе.
3. Составить план урока, на котором была бы успешно проведена экологизация знаний.
ГЛАВА 1. ИЗУЧЕНИЕ ТЕМЫ: «ЖЕЛЕЗО И ЕГО СОЕДИНЕНИЙ» В ШКОЛЬНОМ КУРСЕ ХИМИИ
Историческая справка
В земной коре железо распространено достаточно широко — на его долю приходится около 4,1% массы земной коры (4-е место среди всех элементов, 2-е среди металлов). Известно большое число руд и минералов, содержащих железо. Наибольшее практическое значение имеют красные железняки (руда гематит, Fe2O3; содержит до 70% Fe), магнитные железняки (руда магнетит, Fe3О4; содержит 72,4% Fe), бурые железняки (руда гидрогетит НFeO2·nH2O), а также шпатовые железняки (руда сидерит, карбонат железа, FeСО3; содержит около 48% Fe). В природе встречаются также большие месторождения пирита FeS2 (другие названия — серный колчедан, железный колчедан, дисульфид железа и другие), но руды с высоким содержанием серы пока практического значения не имеют. По запасам железных руд Россия занимает первое место в мире. В морской воде 1·10–5 — 1·10–8% железа.
1.2 Тема «Железо и его соединения» в школьных программах по химии
В программе школьного курса химии на изучении темы «Железо и его соединения» отводится 5 часов; эта тема разбита на следующие подразделы: Общие понятия о положении железа в периодической системе химических элементов и строение атома. Основные методы получения железа-восстановление из оксидов железа и электролиз водных растворов солей железа. Физические, химические свойства и применение. Основные соединения железа и их получение. Экологические аспекты данной темы в школьной литературе изложены очень поверхностно или не изложены вовсе.
В школьных учебниках «Химия.9 класс»/Г. Е. Рудзитис, Ф. Г. Фельдман, «Химия. 9класс»/Н. С. Ахметов, и Пособие по химии для поступающих в вузы/ Г. П. Хомченко, на эту тему выделено три основных параграфа: § 1.Положение железа в периодической системе химических элементов и строение атома § 2.Нахождение железа в природе,его получение, свойства и применение § 3.Соединения железа, и мы будем рассматривать каждый параграф более подробно.
§ 1. Положение железа в периодической системе химических элементов и строение атома
Fe
d- элемент VIII группы; порядковый номер – 26; атомная масса – 56; (26p11; 30 n01), 26ē(1)
| 1s22s22p63s23p63d64s2 |
Металл средней активности, восстановитель.
Основные степени окисления - +2, +3
§ 2. Нахождение железа в природе,его получение и свойства
Нахождение в природе.
Железо является вторым по распространенности металлом в природе (после алюминия). В свободном состоянии железо встречается только в метеоритах, падающих на землю (2). Наиболее важные природные соединения:
Fe2O3 • 3H2O - бурый железняк;
Fe2O3 - красный железняк;
Fe3O4(FeO • Fe2O3) - магнитный железняк;
FeS2 - железный колчедан (пирит).
Соединения железа входят в состав живых организмов.
Получение железа.
В промышленности железо получают восстановлением его из железных руд углеродом (коксом) и оксидом углерода (II) в доменных печах (1, 3). Химизм доменного процесса следующий:
C + O2 = CO2,
CO2 + C = 2CO.
3Fe2O3 + CO = 2Fe3O4 + CO2,
Fe3O4 + CO = 3FeO + CO2,
FeO + CO = Fe + CO2.
Его также можно получить:
1)восстановлением железа из его оксида, например, ![]() водородом при нагревании;
водородом при нагревании;
2)восстановлением железа из его оксидов ![]() и
и ![]() алюминотермическим методом;
алюминотермическим методом;
3)электролизом водных растворов солей железа (II) (1).
Физические свойства.
Железо – серебристо серый металл, обладает большой ковкостью, пластичностью и сильными магнитными свойствами. Плотность железа – 7,87 г/см3, температура плавления 1539°С (1).
У Хомченко (3) также написано, что железо легко намагничивается и размагничивается, а потому применяется в качестве сердечников динамомашин и электромоторов. Кроме того, железо состоит из четырех стабильных изотопов с массовыми числами 54, 56(основной), 57 и 58. Применяются радиоактивные изотопы ![]() и
и ![]() .
.
Химические свойства
В реакциях железо является восстановителем. Однако при обычной температуре оно не взаимодействует даже с самыми активными окислителями (галогенами, кислородом, серой), но при нагревании становится активным и реагирует с ними:
2Fe + 3Cl2 = 2FeCl3 Хлорид железа (III)
3Fe + 2O2 = Fe3O4(FeO · Fe2O3) Оксид железа (II,III)
Fe + S = FeS Сульфид железа (II)
При очень высокой температуре железо реагирует с углеродом, кремнием и фосфором:
3Fe + C = Fe3C Карбид железа (цементит)
3Fe + Si = Fe3Si Силицид железа
3Fe + 2P = Fe3P2 Фосфид железа (II)
Железо реагирует со сложными веществами.
Во влажном воздухе железо быстро окисляется (корродирует):
4Fe + 3O2 + 6H2O = 4Fe(OH)3,
O
Fe(OH)3 = Fe
O – H + H2O
Ржавчина
Железо находится в середине электрохимического ряда напряжений металлов, поэтому является металлом средней активности. Восстановительная способность у железа меньше, чем у щелочных, щелочноземельных металлов и у алюминия. Только при высокой температуре раскаленное железо реагирует с водой(700-900):
3Fe + 4H2O = Fe3O4 + 4H2
Железо реагирует с разбавленными серной и соляной кислотами, вытесняя из кислот водород:
Fe + 2HCl = FeCl2 + H2
Fe + H2SO4 = FeSO4 + H2
При обычной температуре железо не взаимодействует с концентрированной серной кислотой, так как пассивируется ею (3). При нагревании концентрированная H2SO4 окисляет железо до сульфита железа (III):
2Fe + 6H2SO4 = Fe2(SO4)3 + 3SO2 + 6H2O.
Разбавленная азотная кислота окисляет железо до нитрата железа (III):
Fe + 4HNO3 = Fe(NO3)3 + NO + 2H2O.
Концентрированная азотная кислота пассивирует железо.
Из растворов солей железо вытесняет металлы, которые расположены правее его в электрохимическом ряду напряжений:
Fe + CuSO4 = FeSO4 + Cu, Fe0 + Cu2+ = Fe2+ + Cu0.
Применение и биологическая роль железа и его соединений.
Важнейшие сплавы железа – чугуны и стали – являются основными конструкционными материалами практически во всех отраслях современного производства (1).
Хлорид железа (III) FeCl3 применяется для очистки воды. В органическом синтезе FeCl3 применяется как катализатор. Нитрат железа Fe(NO3)3 · 9H2O используют при окраске тканей.
Железо является одним из важнейших микроэлементов в организме человека и животных (в организме взрослого человека содержится в виде соединений около 4 г Fe). Оно входит в состав гемоглобина, миоглобина, различных ферментов и других сложных железобелковых комплексов, которые находятся в печени и селезенке. Железо стимулирует функцию кроветворных органов (2, 3).
§ 3.Соединения железа
Соединения железа (II)
Оксид железа (II) FeO – черное кристаллическое вещество, нерастворимое в воде. Оксид железа (II) получают восстановлением оксида железа(II,III) оксидом углерода (II):
Fe3O4 + CO = 3FeO + CO2.
Оксид железа (II) – основной оксид, легко реагирует с кислотами, при этом образуются соли железа(II):
FeO + 2HCl = FeCl2 + H2O, FeO + 2H+ = Fe2+ + H2O.
Гидроксид железа (II) Fe(OH)2 – порошок белого цвета, не растворяется в воде. Получают его из солей железа (II) при взаимодействии их со щелочами:
FeSO4 + 2NaOH = Fe(OH)2¯ + Na2SO4,
Fe2+ + 2OH- = Fe(OH)2¯.
Гидроксид железа () Fe(OH)2 проявляет свойства основания, легко реагирует с кислотами:
Fe(OH)2 + 2HCl = FeCl2 + 2H2O,
Fe(OH)2 + 2H+ = Fe2+ + 2H2O.
При нагревании гидроксид железа (II) разлагается:
Fe(OH)2 = FeO + H2O.
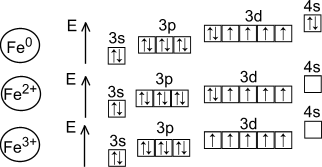
Соединения со степенью окисления железа +2 проявляют восстановительные свойства, так как Fe2+ легко окисляются до Fe+3:
Fe+2 – 1e = Fe+3
Так, свежеполученный зеленоватый осадок Fe(OH)2 на воздухе очень быстро изменяет окраску – буреет. Изменение окраски объясняется окислением Fe(OH)2 в Fe(OH)3 кислородом воздуха:
4Fe+2(OH)2 + O2 + 2H2O = 4Fe+3(OH)3.
Восстановительные свойства проявляют и соли двухвалентного железа, особенно при действии окислителей в кислотной среде. Например, сульфат железа (II) восстанавливает перманганат калия в сернокислотной среде до сульфата марганца (II):
10Fe+2SO4 + 2KMn+7O4 + 8H2SO4 = 5Fe+32(SO4)3 + 2Mn+2SO4 + K2SO4 + 8H2O.
Качественная реакция на катион железа (II).
Реактивом для определения катиона железа Fe2+ является гексациано (III) феррат калия (красная кровяная соль) K3(Fe(CN)6):
3FeSO4 + 2K3(Fe(CN)6) = Fe3(Fe(CN)6)2¯ + 3K2SO4.
При взаимодействии ионов (Fe(CN)6)3- с катионами железа Fe2+ образуется темно-синий осадок – турнбулева синь:
3Fe2+ +2(Fe(CN)6)3- = Fe3(Fe(CN)6)2¯ (3).
Соединения железа (III)
Оксид железа (III) Fe2O3 – порошок бурого цвета, не растворяется в воде. Оксид железа (III) получают:
А) разложением гидроксида железа (III):
2Fe(OH)3 = Fe2O3 + 3H2O
Б) окислением пирита (FeS2):
4Fe+2S2-1 + 11O20 = 2Fe2+3O3 + 8S+4O2-2.
![]()
![]()
![]() Fe+2 – 1e ® Fe+3
Fe+2 – 1e ® Fe+3
2S-1 – 10e ® 2S+4
![]() O20 + 4e ® 2O-2 11e
O20 + 4e ® 2O-2 11e
Оксид железа (III) проявляет амфотерные свойства:
А) взаимодействует с твердыми щелочами NaOH и KOH и с карбонатами натрия и калия при высокой температуре:
Fe2O3 + 2NaOH = 2NaFeO2 + H2O,
Fe2O3 + 2OH- = 2FeO2- + H2O,
Fe2O3 + Na2CO3 = 2NaFeO2 + CO2.
Феррит натрия
Гидроксид железа (III) получают из солей железа (III) при взаимодействии их со щелочами:
FeCl3 + 3NaOH = Fe(OH)3¯ + 3NaCl,
Fe3+ + 3OH- = Fe(OH)3¯.
Гидроксид железа (III) является более слабым основанием, чем Fe(OH)2, и проявляет амфотерные свойства (с преобладанием основных). При взаимодействии с разбавленными кислотами Fe(OH)3 легко образует соответствующие соли:
Fe(OH)3 + 3HCl « FeCl3 + H2O
2Fe(OH)3 + 3H2SO4 « Fe2(SO4)3 + 6H2O
Fe(OH)3 + 3H+ « Fe3+ + 3H2O
Реакции с концентрированными растворами щелочей протекают лишь при длительном нагревании. При этом получаются устойчивые гидрокомплексы с координационным числом 4 или 6:
Fe(OH)3 + NaOH = Na(Fe(OH)4),
Fe(OH)3 + OH- = (Fe(OH)4)-,
Fe(OH)3 + 3NaOH = Na3(Fe(OH)6),
Fe(OH)3 + 3OH- = (Fe(OH)6)3-.
Соединения со степенью окисления железа +3 проявляют окислительные свойства, так как под действием восстановителей Fe+3 превращается в Fe+2:
Fe+3 + 1e = Fe+2.
Так, например, хлорид железа (III) окисляет йодид калия до свободного йода:
2Fe+3Cl3 + 2KI = 2Fe+2Cl2 + 2KCl + I20
Качественные реакции на катион железа (III)
А) Реактивом для обнаружения катиона Fe3+ является гексациано (II) феррат калия (желтая кровяная соль) K2(Fe(CN)6).
При взаимодействии ионов (Fe(CN)6)4- с ионами Fe3+ образуется темно-синий осадок – берлинская лазурь:
4FeCl3 + 3K4(Fe(CN)6) « Fe4(Fe(CN)6)3¯ +12KCl,
4Fe3+ + 3(Fe(CN)6)4- = Fe4(Fe(CN)6)3¯.
Б) Катионы Fe3+ легко обнаруживаются с помощью роданида аммония (NH4CNS). В результате взаимодействия ионов CNS-1 с катионами железа (III) Fe3+ образуется малодиссоциирующий роданид железа (III) кроваво-красного цвета:
FeCl3 + 3NH4CNS « Fe(CNS)3 + 3NH4Cl,
Fe3+ + 3CNS1- « Fe(CNS)3 (1,3)
ГЛАВА II. ЭКОЛОГИЧЕСКИЕ АСПЕКТЫ, СВЯЗАННЫЕ С ИЗУЧЕНИЕМ ТЕМЫ: « ЖЕЛЕЗО И ЕГО СОЕДИНЕНИЯ»
Железо присутствует в организмах всех растений и животных как микроэлемент, то есть в очень малых количествах (в среднем около 0,02%). Однако железобактерии, использующие энергию окисления железа (II) в железо (III) для хемосинтеза, могут накапливать в своих клетках до 17-20% железа. Основная биологическая функция железа — участие в транспорте кислорода (O) и окислительных процессах. Эту функцию железа выполняет в составе сложных белков — гемопротеидов, простетической группой которых является железопорфириновый комплекс — гем. Среди важнейших гемопротеидов дыхательные пигменты гемоглобин и миоглобин, универсальные переносчики электронов в реакциях клеточного дыхания, окисления и фотосинеза цитохромы, ферменты каталоза и пероксида, и других. У некоторых беспозвоночных железосодержащие дыхательные пигменты гелоэритрин и хлорокруорин имеют отличное от гемоглобинов строение. При биосинтезе гемопротеидов железо переходит к ним от белка ферритина, осуществляющего запасание и транспорт железа. Этот белок, одна молекула которого включает около 4 500 атомов железа, концентрируется в печени, селезенке, костном мозге и слизистой кишечника млекопитающих и человека. Суточная потребность человека в железе (6-20 мг) с избытком покрывается пищей (железом богаты мясо, печень, яйца, хлеб, шпинат, свекла и другие). В организме среднего человека (масса тела 70 кг) содержится 4,2 г железа, в 1 л крови — около 450 мг. При недостатке железа в организме развивается железистая анемия, которую лечат с помощью препаратов, содержащих железо. Препараты железа применяются и как общеукрепляющие средства. Избыточная доза железа (200 мг и выше) может оказывать токсичное действие. Железо также необходимо для нормального развития растений, поэтому существуют микроудобрения на основе препаратов железа (4,5). Однако железо может представлять определенную экологическую опасность для окружающей среды, и это следует также рассматривать при изучении темы: «Железо и его соединения». Рассмотрим экологические проблемы, связанные с железом.
В зонах металлургических комбинатов в твердых выбросах содержится от22000 до 31000 мг/кг железа. В прилегающие к комбинатам почвы поступает до 31-42 мг/кг железа. Вследствие этого железо накапливается в огородных культурах (6).
Содержание железа в составе сырого осадка, выпадающего в первичных отстойниках крупного промышленного города, может достигать 1428 мг/кг. Пыль, дым промышленных производств могут содержать большие количества железа в виде аэрозолей железа, его оксидов, руд.
Пыль железа или его оксидов образуется при заточке металлического инструмента, очистке деталей от ржавчины, прокате железных листов, электросварке и при других производственных процессах, в которых имеют место железо или его соединения. Железо может накапливаться в почвах, водоемах, воздухе, живых организмах (6,7).
Основные минералы железа подвергаются в природе фотохимическому разрушению, комплексообразованию, микробиологическому выщелачиванию, в результате чего, железо из труднорастворимых минералов переходит в водные объекты.
Железосодержащие минералы окисляются бактериями типа Th. Ferrooxidans. Пирит – обычный примесный компонент угольных месторождений, и его выщелачивание приводит к закислению шахтных вод. По одной из оценок, в1932г. в реку Огайо (США) с шахтными водами поступило около 3 млн. тонн H2SO4. Микробиологическое выщелачивание железа осуществляется не только за счет окисления, но и при восстановлении окисленных руд. В нем принимают участие микроорганизмы относящиеся к разным группам. В частности, восстановление Fe3+ до Fe2+ осуществляют представители родов Bacillus и Pseudomonas, а так же некоторые грибы.
Упомянутые здесь широко распространенные в природе процессы протекают так же в отвалах горнорудных предприятий, металлургических комбинатов, производящих большое количество отходов (шлаки, огарки и т.п.). С дождевыми, паводковыми и грунтовыми водами высвобождающиеся из твердых матриц металлы переносятся в реки и водоемы. Железо находится в природных водах в разных состояниях и формах: в истинно растворенной форме входит в состав донных отложений и гетерогенных систем (взвеси и коллоиды).
Донные отложения рек и водоемов выступают в качестве накопителя железа. При определенных условиях железо может высвобождаться из них, в результате чего происходит вторичное загрязнение воды (8).
В воздух рабочей зоны на металлургических, предприятиях поступает пыль, аэрозоли из частиц железа и его соединений.
При воздействии на кожу возможны аллергические дерматиты, при вдыхании такого воздуха происходит раздражение дыхательных путей, разрушение легких, плевры, нарушения функции печени, желудочные заболевания. Поэтому установлено ПДК (Предельно Допустимая Концентрация) для железосодержащих частиц в воздухе рабочей зоны в зависимости от типа частиц от 2 до 4мг/м3.
При сгорании железного порошка, при операциях, связанных с работой электрической дуги, в окружающую атмосферу поступает дым оксида железа Fe2O4, который вызывает патологические изменения функции легких. ПДК для Fe2O3 в воздухе (в пересчете на Fe) – 0,04мг/м3.
Сульфаты и хлориды железа являются наиболее токсичными вредными примесями. ПДК для сульфата (в пересчете на Fe) в атмосферном воздухе –0,007 мг/м3, для хлорида – 0,004 мг/м3.
Аэрозоли (пыль, дым) железа и его оксидов, руд и других соединений при длительном воздействии откладываются в легких и вызывают специфическое заболевание легких – сидероз. Различают, так называемый «красный сидероз», вызываемый оксидом железа (III) и «черный сидероз», возникающий от вдыхания пыли железа, его карбонатов и фосфатов.
У рабочих, обрабатывающих пириты, наблюдаются желудочные заболевания (гастриты, дуодениты) (6).
У рабочих доменного и мартеновского производств наблюдается нарушение обоняния.Среди электросварщиков, сталеваров часты воспалительные заболевания верхних дыхательных путей.
У рабочих железорудных шахт и горнообогатительных фабрик особенно часты хронические бронхиты, иногда осложненные астмой, эмфиземой легких. Встречаются стоматиты, воспаления десен, поражения зубов, поражения слизистой рта.
Мероприятия, обеспечивающие безопасность работы в атмосфере с повышенным содержанием частиц железа и его соединений, заключаются в очистке воздуха от вредных примесей, в эффективной вентиляции помещений, в применении спецодежды, респираторов, очков.
Реальную опасность при приеме внутрь представляют железо, поступающее в организм в составе лекарственных веществ и сульфат железа (II). Токсические дозы FeSO4 или чистого железа (для человека ЛД = 200-250 мг/кг) приводят к смертельному исходу в результате химического ожога внутренних органов.
Токсичность соединений железа в воде зависит от pH. В щелочной среде токсичность возрастает. От избыточного содержания железа в воде могут гибнуть рыбы, водоросли. Большую опасность представляют сточные воды и шламы производств, связанных с переработкой железосодержащих продуктов.
Подпороговые концентрации в воде водоемов: сульфат и нитрат железа (III), гидроксид железа (II) – 0,5 мг/л; хлорид железа (III) – 0,9 мг/л.
Соединения железа (II) обладают общим токсическим действием. Соединения железа (III) менее ядовитые, но действуют прижигающе на пищеварительный канал и вызывают рвоту.
ПДК железа в питьевой воде 0,3 мг/л.
В природных водоемах, например, в Ладожском озере, в Неве, содержание железа меньше 0,3 мг/л. Перед поступлением в сети городского водоснабжения вода из водоемов подвергается фильтрации и действию коагулянтов, которые вместе с органическими примесями удаляют и часть железа.
Обработка воды с повышенным содержанием железа заключается в фильтровании на механических фильтрах (антрацит), коагуляции, глинозем Al2(SO4)3), иногда - в обработке магнитными полями (в случае магнитных форм железа).
Профилактические мероприятия, обеспечивающие безопасные условия труда при воздействии на работающих железа и его соединений определяются нормативными документами применительно к конкретным условиям производства (7,8).
В этой главе мы рассмотрели некоторые (на самом деле их гораздо больше) экологические вопросы, связанные с железом и его соединениями, а также способами устранения. И в следующей главе мы будем рассматривать, способы проведения уроков в школе по этой теме.
ГЛАВА 3. ИЗУЧЕНИЕ ТЕМЫ «ЖЕЛЕЗО И ЕГО СОЕДИНЕНИЯ» НА УРОКЕ ПО ХИМИИ В СРЕДНЕЙ ШКОЛЕ
3.1 План урока
Железо: его строение и свойства
“Век девятнадцатый, железный,
Воистину жестокий век!
Тобою в мрак ночной, беззвездный
Беспечный брошен человек!”
Цели урока:
· сформировать представление о физических и химических свойствах железа в зависимости от проявляемой им степени окисления и природы окислителя;
· развивать теоретическое мышление учащихся и их умения прогнозировать свойства вещества, опираясь на знания о его строении;
· развивать понятийное мышление таких операций, как анализ, сравнение, обобщение, систематизация;
· развивать такие качества мышления, как объективность, лаконизм и ясность, самоконтроль и активность.
Задачи урока:
· актуализировать знания учащихся по теме: “Строение атома”;
· организовать коллективную работу учащихся от постановки учебной задачи до конечного результата (составить опорную схему к уроку);
· обобщить материал по теме: “Металлы” и рассмотреть свойства железа и его применение;
· организовать самостоятельную исследовательскую работу в парах по изучению химических свойств железа;
· организовать взаимоконтроль учащихся на уроке.
Тип урока: изучение нового материала.
Реактивы и оборудование:
· железо (порошок, пластина, скрепка),
· сера,
· соляная кислота,
· сульфат меди (II),
· кристаллическая решетка железа,
· плакаты для игры,
· магнит,
· подборка иллюстраций по теме,
· пробирки,
· спиртовка,
· спички,
· ложка для сжигания горючих веществ,
· географические карты.
Структура урока
1. Вводная часть.
2. Изучение нового материала.
3. Сообщение домашнего задания.
4. Закрепление изученного материала.
Ход урока
1. Вводная часть
Организационный момент.
Проверка наличия учащихся.
Сообщение темы урока. Запись темы на доске и в тетрадях учащихся.
2. Изучение нового материала
– Как вы думаете, как будет звучать тема нашего сегодняшнего урока?
1. Появление железа в человеческой цивилизации положило начало железному веку.
Откуда же древние люди брали железо в то время, когда еще не умели добывать его из руды? Железо в переводе с шумерского языка – это металл, “капнувший с неба, небесный”. Первое железо, с которым столкнулось человечество, было железом из метеоритов. Впервые доказал, что “железные камни падают с неба”, в 1775 г. русский ученый П.С. Палас, который привез в Петербург глыбу самородного железного метеорита весом 600 кг. Самым крупным железным метеоритом является найденный в 1920 г. в Юго-Западной Африке метеорит “Гоба” весом около 60 т. Вспомним гробницу Тутанхамона: золото, золото. Великолепная работа восхищает, блеск слепит глаза. Но вот что пишет К.Керрам в книге “Боги, гробницы, ученые” о маленьком железном амулете Тутанхамона: “Амулет относится к числу наиболее ранних изделий Египта, и …в гробнице, наполненной чуть ли не до отказа золотом, именно эта скромная находка имела наибольшую с точки зрения истории культуры ценность”. Всего несколько железных изделий было найдено в гробнице фараона, среди них железный амулет бога Гора, небольшой кинжальчик с железным клинком и золотой рукояткой, маленькая железная скамеечка “Урс”.
Ученые предполагают, что именно страны Малой Азии, где проживали племена хеттов, были местом возникновения черной металлургии. В Европу железо пришло из Малой Азии уже в I тыс. до н.э.; так в Европе начался железный век.
Знаменитую булатную сталь (или булат) делали на Востоке еще во времена Аристотеля (IV в. до н.э.). Но технология ее изготовления держалась в секрете много веков.
Мне приснилась иная печаль
Про седую дамасскую сталь.
Я увидел, как сталь закалялась,
Как из юных рабов одного
Выбирали, кормили его,
Чтобы плоть его сил набиралась.
Выжидали положенный срок,
А потом раскаленный клинок
В мускулистую плоть погружали,
Вынимали готовый клинок.
Крепче стали, не видел Восток,
Крепче стали и горше печали.
Поскольку булат – это сталь с очень большой твердостью и упругостью, изготовленные из нее изделия обладают способностью не тупиться, будучи остро заточенными. Раскрыл секрет булата русский металлург П.П. Аносов. Он очень медленно охлаждал раскаленную сталь в специальном растворе технического масла, подогретого до определенной температуры; в процессе охлаждения сталь ковалась.
2. Положение железа в ПСХЭМ.
Выясняем положение железа в ПСХЭМ, заряд ядра и распределение электронов в атоме.
3. Физические свойства железа.
– Какие физические свойства железа вы знаете?
Железо – это серебристо-белый металл с температурой плавления 1539оС. Очень пластичный, поэтому легко обрабатывается, куется, прокатывается, штампуется. Железо обладает способностью намагничиваться и размагничиваться, поэтому применяется в качестве сердечников электромагнитов в различных электрических машинах и аппаратах. Ему можно придать большую прочность и твердость методами термического и механического воздействия, например, с помощью закалки и прокатки.
Различают химически чистое и технически чистое железо. Технически чистое железо, по сути, представляет собой низкоуглеродистую сталь, оно содержит 0,02 -0,04% углерода, а кислорода, серы, азота и фосфора – еще меньше. Химически чистое железо содержит менее 0,01% примесей. Химически чистое железо – серебристо-серый, блестящий, по внешнему виду очень похожий на платину металл. Химически чистое железо устойчиво к коррозии (вспомним, что такое коррозия? Демонстрация коррозионного гвоздя) и хорошо сопротивляется действию кислот. Однако ничтожные доли примесей лишают его этих драгоценный свойств.
4. Химические свойства железа.
Исходя из знаний о химических свойствах металлов, как вы думаете, какими химическими свойствами будет обладать железо?
| +2 | +3 |
| Взаимодействие с неметаллами | |
| Fe + S= FeS | 2Fe +3CL2 = 2FeCL3 |
| С кислотами | |
Fe + 2HCL= FeCL2 + H2 | |
| С солями | |
Fe + CuSO4 = FeSO4 + Cu | |
| С водой | |
3 Fe + 4H2O (пары) = Fe3O4 + 4H2 | При температуре 700-900оС |
Подобные работы:
Методические особенности изучения темы "Земноводные" в школьном курсе биологии
Методические особенности изучения темы "Корень" в школьном курсе биологии
Методические особенности изучения темы "Подобные треугольники" в средней общеобразовательной школе
Методические особенности преподавания темы "Многообразие видов рыб"
Методология историко-педагогического исследования развития педагогического знания