Виготовлення лікарських препаратів на основі амілолітичних ферментів
ЗМІСТ
ВСТУП
1. ДЖЕРЕЛА ОДЕРЖАННЯ АМІЛОЛІТИЧНИХ ФЕРМЕНТІВ
1.1 Продуценти –прокаріоти
1.2 Продуценти – дріжджеподібні гриби
1.3 Продуценти – мікроскопічні гриби
1.4 Патентний пошук
1.4.1 Штам цвілевого гриба Aspergillus аwamori IMBF-100017 - продуценту амілолітичних ферментів
1.4.2 Штам бактерій Васillus licheniformis – продуцент комплексу термостабільних амілолітичних і протеолітичних ферментів
2. МЕХАНІЗМ ДІЇ ТА ВЛАСТИВОСТІ АМІЛОЛІТИЧНИХ ФЕРМЕНТІВ
2.1 Властивості та структура ферментів
2.2 Класифікація амілолітичних ферментів
2.3 Механізм дії амілолітичних ферментів
3. ФІРМИ ВИРОБНИКИ АМІЛОЛІТИЧНИХ ФЕРМЕНТНИХ ПРЕПАРАТІВ
3.1 Українські виробники
3.2 Закордонні виробники
3.3 Російські виробники
4. ГАЛУЗІ ВИКОРИСТАННЯ АМІЛОЛІТИЧНИХ ФЕРМЕНТНИХ ПРЕПАРАТІВ
4.1 Хлібопекарська і крохмалопаточна промисловість
4.2 Пивоваріння та спиртова промисловість
4.3 Текстильна промисловість
4.4 Фармацевтична промисловість
5. СУЧАСНІ НАУКОВІ ДОСЛІДЖЕННЯ, ПОВ`ЯЗАНІ З РОЗРОБКОЮ АМІЛОЛІТИЧНИХ ФЕРМЕНТНИХ ПРЕПАРАТІВ
5. 1Комп'ютерне моделювання структурі амілолітичних ферментів
6. ОСОБЛИВОСТІ ТЕХНОЛОГІЧНОГО ПРОЦЕСУ ВИРОБНИЦТВА АМІЛОЛІТИЧНИХ ФЕРМЕНТНИХ ПРЕПАРАТІВ
6.1 Виробничі способи культивування мікроорганізмів – продутентів ферментів
6.2 Отримання амілолітичних ферментних препаратів з глибинних культур мікроорганізмів
6.3 Отримання амілолітичних ферментних препаратів з поверхневих культур мікроорганізмів
7. МЕТОДИКИ ВИЗНАЧЕННЯ ФЕРМЕНТАТИВНОЇ АКТИВНОСТІ АМІЛОЛІТИЧНИХ ФЕРМЕНТІВ
7.1 Спектрофлюрометричні методи
7.2 Колориметричні (фотометричні) методи
7.3 Спектрофотометричні методи
7.4 Манометричні методи і інші методи
ВИСНОВОК
СПИСОК ЛІТЕРАТУРИ
ВСТУП
Ферменти або ензими – органічні каталізатори білкової або РНК природи. Ферменти каталізують більшість хімічних реакцій, які відбуваються у живих організмах.
Великою і незаперечною перевагою ферментів перед хімічними каталізаторами є те, що вони діють при нормальному тиску, при температурах від 20 до 70 ° С, рН в діапазоні від 4 до 9 і мають у більшості випадків виключно високу субстратну специфічність, що дозволяє в складній суміші біополімерів направлено впливати тільки на визначені з'єднання.
НА сьогоднішній день в світі інтенсивно збільшується виробництво ферментів для використання їх в різноманітних ланках людської життєдіяльності. Не виняток і амілолітичні ферментні препарати. Завдяки своїм особливості – каталізу реакцій гідролізу різноманітних оліго- та полісахаридів – амілолітичні ферменти використовуються в харчовій промисловості, легкій промисловості, медичній промисловості, та в діагностичних цілях. Їх використання значно спрощує та значно здешевлює технологічний процес виробництва.
Все це свідчить про те, що виробництво амілолітичних ферментних препаратів є одним з перспективних напрямків у біотехнології, що буде і далі інтенсивно розвиватися та розширюватися. І саме тому цей реферат наддає докладну інформацію про структуру та функції а також схему виробництва амілолітичних препаратів.
1. ДЖЕРЕЛА ОТРИМАННЯ АМІЛОЛІТИЧНИХ ФЕРМЕНТІВ
НА сьогоднішній день амілолітичні ферментні препарати в Україні та за кордоном набули дуже широкого використання.
До розвитку ферментної промисловості головним промисловим джерелом отримання амілаз в європейських країнах було проросле зерно (солод). Для медичних цілей амілази отримували з тваринної сировини. В даний час головним джерелом амілаз є прокаріоти, особливо бактерії, гриби і найрідше дріжджі(1,2).
1.1 Прокаріоти
Серед бактеріальної мікрофлори найбільш ефективними продуцентами є такі мікроорганізми: Вас. subtilis, Вас. diastaticus, Вас. mesentericus, Вас. macerans і Вас. polymycus та ін.
Бацили – продуценти амілолітичних ферментів представляють собою в більшості випадків Г+ палички довжиною 1,2 ... 1,3 мкм і діаметром 0,6 ... 0,8 мкм. Палички з'єднуються по два, три, іноді утворюють ланцюжки. собою утворюють спори, що надають стійкість клітині при дії несприятливих умов. Такі форми легко переносять висушування, низькі та високі температури, опромінення і т. д. Цикл розвитку бактерій порівняно короткий.
рН-стабільність мікробних глюкоамілаз лежить в широкому діапазоні від 2,5 до 9. Термостабільність глюкоамілаз лежить в інтервалі від 30 до 45 ° С і рідко підвищується до 55-60 ° С. Глюкоамілази різного походження помітно відрізняються по молекулярній масі, яка, за даними різних авторів, має значення від 48 000 до 210 000.
Бактерію Вас. subtilis-82, що застосовується в даний час на спиртових заводах як продуцент α-амілази в суміші з препаратами глюкоамілази, вирощують протягом 48 ... 60 годин при температурі +30 - +35 ° С.
Особливість застосування бактерій у виробництві – їх здатність утворювати високоактивну термостійку α-амілазу. Для розрідження крохмалю також застосовуються амілолітичні препарати, що містять α-амілазу: α-амілаза гідролізує внутрішні альфа-1,4-глікозидні зв'язки крохмалю, приводячи до швидкого зниження в'язкості клейстеризованих розчинів крохмалю, тим самим забезпечуючи підготовку сусла до дії глюкоамілази. Кінцевими продуктами дії бактеріальної альфа-амілази на крохмаль є низькомолекулярні розчинні декстрини з невеликим змістом моно-і дисахаридів (глюкози і мальтози). (3).
1.2 Дріжджоподібні гриби
Амілолітичні ферменти синтезують також деякі дріжджі і дріжджоподібні гриби родів Saccharomyces, Candida, Endomycopsis і Endomyces.
Відомо більше 100 видів дріжджів, які добре ростуть на крохмалі як на єдиному джерелі вуглецю. Серед них особливо виділяються два види, які утворюють як глюкоамілази, так і β-амілази, ростуть на крохмалі з високим економічним коефіцієнтом і можуть не тільки асимілювати, але і зброджувати крохмаль: Schwanniomyces occidentalis і Saccharomycopsis fibuliger. Обидва види - перспективні продуценти амілолітичних ферментів на крохмалевмісних відходах.
У спиртовому виробництві знайшли застосування дріжджоподібні гриби End. bispora і End. species 20-9, що вирощуються глибинним способом і продукують головним чином активну глюкоамілазу; активність ферменту виявляється слабо. Високоактивний End. bispora має розгалужений міцелій, утворює бластоспори; гіфи – септовані, зернисті; на твердих агаризованних середовищах пророщують колонії з повітряним сірувато-білим міцелієм, на рідких поживних середовищах - гіфи і деяка кількість бластоспор.
Дріжджоподібні гриби в спиртовому виробництві самостійно не застосовують, тому що вони не містять інших ферментів, необхідних для нормального оцукрювання сусла з крохмалевмісної сировини. Зазвичай їх використовують у суміші з ферментними препаратами з мікроскопічних грибів чи бактерій (4).
1.3 Мікроскопічні гриби
Для отримання амілаз широко застосовують мікроскопічні гриби роду Aspergillus, видів: niger, oryzae, usamii, awamori, batatae, роду Rhizopus, видів: delemar, tonkinensis, niveus, japonicum та ін, А також окремі штами Neurospora grassa і Mucor.
Мікроскопічні гриби дуже широко поширені в природі; основне місце їх проживання – грунт.
Всі роди і види мікроскопічних грибів характеризуються нитковидною будовою тіла і специфічною будовою плодоносних органів. Тіло гриба складається з довгих переплетених ниток сіруватого або білого кольору, що називаються гіфами. Вони поширюються по поверхні поживного субстрату, утворюючи міцелій, і частково вростають в нього. Деякі гіфи, що піднімаються над поверхнею у вигляді легкого пуху, мають більш складну будову і мають органи плодоношення, що називаються конідіями або спорангієносцями. У мукорових грибів на спорангієносця знаходиться кулевидне здуття, оточене оболонкою, всередині якого утворюються спори. У аспергіллів кінець конідієносця має булавкоподібні потовщення, від якого відходять подовжені клітини, звані стеригмами; від стеригм відшнуровуются більш дрібні круглі клітини – конідії
Відокрелені конідії або спори, потрапляючи у сприятливі умови, починає проростати, потім гіфи гілкуються, утворюючи міцелій; при виснаженні живильних речовин у середовищі гриб переходить у стадію споро- або конідієутворення. Спори і конідії мікроскопічних грибів містять пігменти, що і додає зрілим культурам характерного забарвлення. Спори розвиваються трьома різними способами, в залежності від виду мікроскопічного гриба:
· як круглі ділянки в межах мережі гіфів;
· як речовина в торбинці на кінці антени Гіфа;
· як схожі на ланцюгу ділянки на кінці антени Гіфа
Аспергілли - типові аерофіли, тому вони можуть розвивватись тільки на поверхні твердого або рідкого середовища або в рідкому середовищі, що аерується. Оптимальна температура для більшості аспергіллів +25 - +30 ° С, для деяких - до 35 ° С. Більшість грибів при поверхневому культивуванні можуть переносити короткочасне підвищення температури до 40 ° С і навіть 45 ° С без помітної втрати активності ферментів. Оптимальна вологість середовища для них близько 65%.
Для живлення аспергіллів необхідні вуглеводи, азотисті і мінеральні речовини. Як джерело вуглеводу, крім моносахаридів, багатьох оліго- і полісахаридів, можуть бути спирти і органічні кислоти, однак для накопичення амілази в середовищі обов'язково повинні бути присутніми крохмаль, декстрини або мальтоза. У середовищах, що містять інші цукри, в тому числі глюкозу, гриби не утворюють амілази. Джерелом азоту можуть бути білки і їх гідролізати, амонійні солі та нітрати.
Середа повинні містити сполуки, до складу яких входять сірка, фосфор, калій, магній і мікроелементи. Більшість мікроскопічних грибів засвоюють сірку з сульфатів, а фосфор – з фосфатів. Аспергілли не потребують готових вітамінах та фактори росту, тому що здатні самі синтезувати їх з більш простих сполук, що є в середовищі. Препарати ферментів з мікроскопічних грибів включають, як правило, широкий набір ферментів, тому можуть повністю замінювати зерновий солод(4,5).
1.4 Патентний пошук
1.4.1 Штам цвілевого гриба Aspergillus аwamori IMBF-100017 - продуценту амілолітичних ферментів
Суть винаходу: Винахідвідноситься дохарчової промисловості, зокрема до спиртової, і може бути використаний на спиртових заводах для оцукрювання крохмалемісних субстратів. Відомі продуценти амілолітичних ферментів Asp. niger, Asp. oryzae, Rhizopus, Asp. awamon штам 224-21, 78-2, AK-1 (Глюкоамипаза микроорганизмов - M 1975 -C 6-10) Відомий штам Asp. awamon № 466, якийзастосовується на спиртових заводах дляодержання ферментів глкжоамілазного комплексу (Промисловий регламент виробництва аміпоглюкавамаріну Гх-466, Київ, 1995 - С 3 -4), але цей штам має не дуже високу активність синтезу амілолітичних ферментів За 120 -144 год росту накопичує 140-180 од/см3 активності
Задача винаходу – селекція нового штаму Asp. awamon з підвищеною бюсинтетичною активністю і швидкістю росту культури. Технічний результат, який одержують від реалізації винаходу полягає в підвищенні ферментативної активності штаму та швидкості його росту.
Описання винаходу: Досягається технічнийрезультат використанням нового штаму Aspergillus awamon IMBF 100017 – продуцента амілолітичних ферментів для оцукрювання крохмалю з підвищеною бюсинтетичною активністю. При цьому виникає пов'язана з технічним результатом споживча властивість заявляемого об'єкту – підвищення виходу і активності цільового продукту. Штам пліснявого гриба Aspergillus awamon IMBF 100017 відселекційоновано шляхом багатоступінчатого відбору з виробничої популяції продуценту амілолітичних ферментів Одержаний штам гриба Aspergillus awamon IMBF 100017 має такі морфологічні та фізіологічні ознаки.
Культурально-морфолопчні ознаки.На середовищі Чапека із сахарозою гігантська колонія на 12 добу росту при температурі 30°С має розмір 39,0 - 43,0мм, форма колоній кругла, колір колонії від темно-коричневого до чорного, край колонії нерівний, поверхня колонії плоска, складчастість слабо виражена, переважно в центрі колони, пігмент із зворотної сторони колони світлокоричневий, ексудат відсутній, конідії утворюються по всій поверхні колонії, більш щільно в центрі колонії, колір конідій від темно-коричневого до чорного. Через 12 діб проводять мікроскопічне дослідження колоній гриба на чашках Петрі з метою вивчення органів розмноження. При спостереженнікраюколонії виявлено сегментований міцелій, від якого вертикально відходять конідієносці На їх вершинах утворюються розширення у вигляді головок, або булав, на поверхні яких з'являються чисельні дрібні вирости-стеригми Стеригми прості, не розгалужуються Від стеригм відшнуровуються ланцюжки округлих гладеньких темнокоричневих або чорних конідій. Розмноження безстатеве, вегетативне, шляхом утворення конідій. Фізіологічні ознаки. На рідких поживних середовищах культура здатна утилізувати крохмаль, сахарозу, глюкозу, мальтозу.
Оптимальна температура росту на рідких поживних середовищах - 30°С.
Тип дихання – аеробний.
Технологічнахарактеристика: При вирощуванні гриба штаму 1MB F 100017 на водно-борошняній суспензії (концентрація сухих речовин кукурудзяного, житнього або пшеничного сусла повинна бути не менше 18 - 20%) культура активно синтезує ферменти глюкоамілазного комплексу При глибинному культивуванні на 5 добу в умовах інтенсивної аерації глюкоамілазна активність досягає 200 - 220 од/см3). Біотехнологічні показники заявленого штаму 1MB F 100017 ілюструються прикладом.
Приклад: Оцінку виробничих якостей штаму 1MB F 100017 проводили методом глибинного культивування на розвареній оцукреній водно-борошняній суспензії Співвідношення борошна і води 1 2,5, оцукрювали бактеріальною а-амілазою (1,5 од/г крохмалю) Витрати повітря на аерацію 25 - ЗО м3/м3/год при постійному перемішуванні 110-120 об/хв.
Температура культивування - 35°С
Тривалість процесу -120 годин
В культуральній рідині (в кінці вирощування) визначали активність амілолітичних ферментів. Дані, які підтверджують перевагу заявленого штаму в порівнянні зі штамом-прототипом, наведені є таблиці 1.1.
Таблиця 1.1. Показники продуктивності шатму гриба Asp. awamon
| Показники | Штами гриба Asp. awamon | |
| (заявлений) | (прототип) | |
| Тривалість процесу, год | 120 | 144 |
а-аміпазна активність, од/см3 | 50 ±5 | 30 ±5 |
Глюкоамілазна активність од/см3 | 150±10 | 110 ± 10 |
Сумарна амілолггична активність, од/см3 | 200 - 220 | 140-180 |
Як видно з таблиці, при використанні заявленого штаму а-амілази накопичусться на 15% більше ніж за прототипом Глюкоамілазна активність - на 36% більше, ніж за прототипом Тривалість процесу накопичення ферментів скорочується на 20%
Таким чином застосування заявленого штаму дозволяє збільшити на 20 - 30% накопичення амілолггичних ферментів, а також скоротити тривалість їх накопичення на 20%
Номер патенту: 47822
Клас (и) патенту: C12N 1 / 14, C12R 1 / 665, C12P 7 / 06
Номер заявки: 2001096648
Дата подачі заявки: 28.09.2001
Дата публікації: 15.07.2002
Заявник (и): Український науково-дослідний інститут спирту і біотехнології продовольчих продуктів.
Автор (и): Олійнічук Сергій Тимофійович; Левандовський Леонід Вікторович; Ткаченко Алла Феодосіївна; Рудніченко Людмила Вікторівна; Коваль Катерина Олександрівна; Бейко Наталія Євгенівна
Патентовласник (и): Український науково-дослідний інститут спирту і біотехнології продовольчих продуктів.
1.4.2 Штам бактерій Васillus licheniformis – продуцент комплексу термостабільним амілолітичні і протеолітичних ферментів
Суть винаходу: винахід відноситься до біотехнології і може бути використане в спиртовому, крохмале-патоковому, пивоварному, хлібопекарському, кондитерському, плодово-ягідному, текстильному виробництвах, де потрібні ферменти, стійкі до підвищених температур. Штам бактерій Bacillus licheniformis ВКМ У-2184 Д виділений селекційним шляхом при вивченні природної мінливості штаму МКПМ В-6508 із застосуванням методів ефективного мутагенезу. Продукує комплекс, що містить не менше п'яти термостабільних амілолітичних і протеолітичних ферментів. Активний діапазон значень рН 5,0-11,0 і температури 30-105 º С з максимальною активністю альфа-амілази при 90-95 º С, пуллуланази - при 75 º С, протеази - при 60 º С. Перспективний для одночасної обробки крохмалю або крохмалевмісних сировини з метою його глибокого гідролізу і як продуцент лужних протеаз для глибокого розщеплення білків до амінокислот. Штам має підвищену здатність синтезу комплексу термостабільним амілолітичні і протеолітичних ферментів, що володіє також бета-глюканазной і ламінаріназной активностями.
Номер патенту: 2177995
Клас (и) патенту: C12N1/20, C12N9/28, C12N9/44, C12N9/56, C12N1/20, C12R1: 10
Номер заявки: 98102082/13
Дата подачі заявки: 05.02.1998
Дата публікації: 10.01.2002
Заявник (и): Товариство з обмеженою відповідальністю Науково-виробнича компанія "Фермтек"
Автор (и): Цурікова Н.В.; Нефедова Л.І.; Окунєв О.Н.; Синицин А.П.; Черноглазов В.М.
Патентовласник (и): Товариство з обмеженою відповідальністю Науково-виробнича компанія "Фермтек"
Опис винаходу: винахід відноситься до галузі біотехнології, а саме до отримання комплексу амілолітичних і протеолітичних ферментів, і може бути використане в мікробіологічнійпромисловості. Амілолітичні ферменти широко використовуються для розрідження або перетворення крохмалю і крохмалевмісної рослинної сировини в такі продукти, як мальтодекстрин, цукрові сиропи, декстрозу, мальтозу, глюкозу та ін При промисловому використанні амілолітичних ферментів необхідні термостабільні ферменти, що обумовлені їх здатністю вести гідроліз сировини при високих температурах - 80-100 º С, що дуже важливо з точки зору ведення процесу клейстерізації крохмалю. При цьому поєднуються два процеси: клейстерізація крохмалю і його ферментативний гідроліз. Значно знижується вартість ферментативного процесу за рахунок скорочення дозування ферменту і тривалості гідролізу крохмалю, більш якісно ведеться підготовка сировини до розварювання - забезпечується висока ступінь гідролізу крохмалю і, як наслідок цього, збільшується вихід цільового продукту. Для переважної більшості продуцентів амілолітичних ферментів характерний переважний біосинтез одного з ферментів. Здатність до утворення комплексу ендогенних амілолітичних ферментів, особливо термостабільності, виявляється дуже рідко. У цьому зв'язку можна назвати ряд термостабільним анаеробів з роду Clostridium. Відомий штам Clostridium thermohidrosulfuricum, що синтезує комплекс, що містить термостабільні пуллуланазу і глюкоамілазу. У літературі описано декілька анаеробних термофілів з роду Clostridium, що здійснюють біосинтез амілази і пуллуланази або альфа-амілази і глюкоамілази, активних при високій температурі. Однак складність культивування анаеробних бактерій в заводських умовах робить цей спосіб отримання препарату амілолітичних ферментів практично непридатним. З літературних даних відомо, що найбільш термостабільними гідролітичними ферментами, такими як альфа-амілази, пуллуланази, а в ряді випадків і протеази є ферменти, які продукують термофільних бактерій Bacillus licheniformis. Відомий аеробний Термофіл Bacillus licheniformis, який при культивуванні на середовищі з кукурудзяної борошном оптимального для отримання продукту складу синтезує комплекс позаклітинних амілолітичні ферментів - альфа-амілазу і пуллуланазу в кількості 2 од / мл і 0,68 од / л відповідно (5). Недоліком цього штаму є низька активність продукуються ферментів, вузький спектр дії комплексу і тривалість процесу культивування (144 години). Недоліками штаму є порівняно низький рівень активності, а також висока вартість культивування через застосування висококонцентрованою живильного середовища та тривалості процесу.
Культурально-морфологічні ознаки: Клітини являють собою грампозитивні, поодинокі рухливі палички розміром 0,6-0,8 і 0,2-0,3 мк, спороутворюючі. У перші години зростання (логарифмічна фаза) утворюються ланцюжки з 2-3 клітин більш витягнутої форми, до 48-56 години зростання (стаціонарна фаза) ланцюжка розпадаються, клітини товщають, з'являються спори, що мають центральне положення і овальну форму.
2. МЕХАНІЗМ ДІЇ ТА ВЛАСТИВОСТІ АМІЛОЛІТИЧНИХ ФЕРМЕНТІВ
2.1 Властивості та структура ферментів
Принципова структура ферменту наступна: кожен фермент складається з апофермента і коферменту, які, кожен окремо, не активний, але виявляють свою дію в комплексі - холоферменті. Всі ферменти мають білкову природу. Вони являють собою або прості білки, цілком побудовані з поліпептидних ланцюгів і розпадаються при гідролізі тільки на амінокислоти (наприклад, гідролітичні ферменти трипсин і пепсин, уреаза), або - в більшості випадків - складні білки, що містять разом з білкової частиною (апоферментом) небілкової компонент (кофермент або простетичної групу). Багато ферменти з великою молекулярною масою проявляють каталітичну активність тільки у присутності специфічних низькомолекулярних речовин, які називаються коферментом (або кофактором). Роль коферментів грають більшість вітамінів і багато мінеральних речовин. Вітаміни РР (нікотинова кислота, або ніацин) і рибофлавін, наприклад, входять до складу коферментів, необхідних для функціонування дегідрогеназ. Цинк - кофермент карбоангідрази, ферменту, який каталізує вивільнення з крові діоксиду вуглецю, який видаляється з організму разом з повітрям, що видихається. Залізо і мідь служать компонентами дихального ферменту цитохромоксидази. Речовини, яка піддається перетворенню в присутності ферменту, називають субстратом. Субстрат приєднується до ферменту, який прискорює розрив одних хімічних зв'язків в його молекулі та створення інших; що утворюється в результаті продукт від'єднується від ферменту. Продукт теж можна вважати субстратом, оскільки всі ферментативні реакції в тій чи іншій мірі оборотні.
За типом реакцій, що каталізуються ферменти підрозділяються на 6 класів згідно ієрархічної класифікації ферментів (КФ, EC - Enzyme Comission code). Кожен клас містить підкласи, так що фермент описується сукупністю чотирьох чисел, розділених крапками. Перше число грубо описує механізм реакції, що каталізується ферментом:
КФ 1: оксидоредуктаиз, каталізують окислення або відновлення.
КФ 2: трансферази, каталізують перенос хімічних груп з однієї молекули субстрату на іншу.
КФ 3: Гідролази, каталізують гідроліз хімічних зв'язків. Приклад: естерази, пепсин, трипсин, амілаза, ліпопротеінліпаза
КФ 4: Ліази, каталізують розрив хімічних зв'язків без гідролізу з утворенням подвійного зв'язку в одному з продуктів.
КФ 5: Ізомерази, каталізують структурні або геометричні зміни в молекулі субстрату.
КФ 6: Лігази, каталізують утворення хімічних зв'язків між субстратами за рахунок гідролізу АТФ.
Будучи каталізаторами, ферменти прискорюють як пряму, так і зворотну реакції, тому, наприклад, ліази здатні каталізувати і зворотну реакцію – приєднання по подвійним зв'язкам.
Ферменти являють собою біокаталізатори білкової природи. Каталізуючи переважна більшість біохімічних реакцій в організмі, ферменти регулюють обмін речовин і енергії, граючи тим самим важливу роль у всіх процесах життєдіяльності. Всі функціональні прояви живих організмів (дихання, м'язова скорочення, передача нервового імпульсу, розмноження і т.д.) забезпечуються дією ферментних систем. Сукупністю ферментних реакцій, що каталізуються, є синтез, розпад та інші перетворення білків, жирів, вуглеводів, нуклеїнових кислот, гормонів та інших сполук.
Активність ферментів визначається їх тривимірної структурою (3). Як і всі білки, ферменти синтезуються у вигляді лінійного ланцюжка амінокислот, яка згортається певним чином. Кожна послідовність амінокислот згортається особливим чином, і виходить молекула (білкова глобула) має унікальні властивості. Кілька білкових ланцюгів можуть об'єднуватися в білковий комплекс. Третинна структура білків руйнується при нагріванні або дії деяких хімічних речовин.
Щоб каталізувати реакцію, фермент повинен зв'язатися з одним або декількома субстратами. Білковий ланцюг ферменту згортається таким чином, що на поверхні глобули утворюється щілина, або западина, де зв'язуються субстрати. Ця область називається сайтом зв'язування субстрату. Зазвичай він збігається з активним центром ферменту або знаходиться поблизу нього. Деякі ферменти містять також сайти зв'язування кофакторів або іонів металів.
Фермент, з'єднуючись з субстратом:
• очищає субстрат від водяної «шуби»
• має у своєму розпорядженні реагують молекули субстратів в просторі за потрібне для протікання реакції чином
• готує до реакції (наприклад, поляризує) молекули субстратів.
Зазвичай приєднання ферменту до субстрату відбувається за рахунок іонних або водневих зв'язків, рідше – за рахунок ковалентних. Наприкінці реакції її продукт (або продукти) відділяються від ферменту.
У результаті фермент знижує енергію активації реакції. Це відбувається тому, що в присутності ферменту реакція йде іншим шляхом (фактично відбувається інша реакція), наприклад:
У відсутності ферменту:
А + В = АВ
У присутності ферменту:
А + Ф = АФ
АФ + В = АВФ
АВФ = АВ + Ф
де А, В - субстрати, АВ - продукт реакції, Ф - фермент.
Ферменти не можуть самостійно забезпечувати енергією ендергонічні реакції (для протікання яких потрібна енергія). Тому ферменти, що здійснюють такі реакції, сполучати їх з екзергонічними реакціями, що йдуть з виділенням більшої кількості енергії (2,7).
2.2 Класифікація амілолітичних ферментів
Амілолітичні ферменти об'єднують велику групу ферментів, які здійснюють гідроліз переважно α-(1,4)-Глікозидних зв'язків амілози, амілопектину, глікогену та інших мальтоолігосахаридів. До групи амілолітичних ферментів відносяться наведені нижче і деякі інші ферменти:
КФ 3.2.1.1 α-амілаза
КФ 3.2.1.2 β-амілаза
КФ 3.2.1.3 Глюкоамілаза
КФ 3.2.1.41 Пуллуланаза
КФ 3.2.1.68 Ізоамілаза
КФ 3.2.1.20 α-глюкозидази
КФ 3.2.1.11 Декстраназа
КФ 2.4.1.19 Амілаза Bacillus macerans (циклодекстроглюканотрансфераза)
Амілази бувають двох типів: ендо-і екзоамілази. Чітко вираженої ендоамілазой є α-амілаза, здатна до розриву внутрішньомолекулярних зв'язків у полімерних ланцюгах субстрату. Глюкоамілаза і β-амілаза є екзоамілазами, тобто ферментами, що атакують субстрат з нередукуючого кінця.
Субстратами для дії амілаз є крохмаль, що складається з амілози і амілопектину, продукти часткового гідролізу крохмалю і глікоген. Крохмаль - рослинний полісахарид з дуже складною будовою. Цей двокомпонентний з'єднання, що складається з 13-30% амілози і 70-85% амілопектину. Обидва компоненти неоднорідні, їх молекулярна маса (М. м.) коливається в широких межах і залежить від природи крохмалю. Амілоза - це необертающийся полімер, в якому залишки глюкози Сполучених α-1,4-Глікозидний зв'язком; ступінь полімеризації близько 2000. У «аномальних» амілози з однією-двома α-1,6-зв'язками полімеризація може зрости до 6000. Амілоза практично не має відновлюючої здатності, тому що в кожній молекулі амілози є тільки один вільна альдегідна група (8).
Реакції, що каталізуються амілазами, мають дві стадії: коротку передстаціонарну і тривалу – стаціонарну. Під час першої стадії ендоамілаза швидко зменшує молекулярну масу субстрату, утворюючи суміш лінійних та розгалужених олігосахаридів. Другий етап реакції триває, поки продукти гідролізу не перестануть забарвлюватися йодом; він протікає значно повільніше і залежить від індивідуальних властивостей ферменту та його природи(9).
α-амілаза (1,4-α-D-глюканглюканогідролаза) є ендоамілазою, що викликає гідролітичні розщеплення α-1,4-глікозидних зв'язків всередині полімерного субстрату. Це водорозчинний білок, що має властивості глобуліну і має молекулярну масу 45-60 кДа. Всі α-амілази відносяться до металоензимів, вміст у них Са коливається від 1 до 30 г-атом / 1 г-моль ферменту. Повне видалення Са приводить до інактивації ферменту. Глутамінова і аспарагінова кислоти становлять 25 мас. % Від маси білка. Залежно від виду мікроорганізму властивості α-амілаз можуть сильно відрізнятися не тільки за механізмом дії на субстрат і по кінцевим продуктам, але і за оптимальними умовами для прояву максимальної активності. Присутність в промислових препаратах протеїназ знижує каталітичну активність α-амілази. У результаті впливу α-амілази на перших стадіях в гідролізаті накопичуються декстрини, потім з'являються тетра- і тримальтоза, що не зафарбовуються йодом і які дуже повільно гідролізуються α-амілазою до ди- і моносахаридів(5).
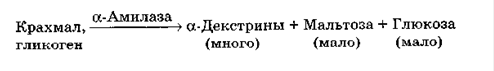
Рисунок 2.1. Механізм дії α-амілази(2)
β-амілаза (β -1,4-глюкан мальтогідролаза, КФ 3.2.1.2) - активний білок, що володіє влатсивостями альбуміну. Каталітичний центр ферменту має сульфгідрильні і карбоксильні групи і імідозольний цикл залишків гістидину. β-Амілаза –екзофермент кінцевої дії, що виявляє спорідненість до передостаннього β -1,4-зв'язку з нередукуючого кінця лінійного ділянки амілози і амілопектину.
На відміну від α-амілази β-амілаза практично не гідролізують нативний крохмаль, тоді як клейстеризований крохмаль гідролізуєтся нею з утворенням мальтози β-конфігурації. Якщо гідролізу піддається амілоза, то гідроліз йде повністю до мальтози. Незначна кількість декстринів може здіснюватися при гідролізі «аномальної» амілози, тому що гідроліз β-амілазою йде тільки по лінійній ланцюга до α -1,6-зв'язків. Якщо субстратом для β-амілази служить амілопектин, то гідроліз йде в значно меншому ступені. β-Амілаза відщеплює фрагмент з нередукуючим кінцем ділянки від зовнішніх лінійних гілок, які мають по 20-26 глюкозних залишків, з утворенням 10-12 молекул мальтози. Гідроліз призупиняється на передостанній α -1,4-зв'язку, що межує з α -1,6-зв'язком. У гідролізаті накопичується 54-58% мальтози, решту становлять високомолекулярні декстрини, що містять значну кількість α -1 ,6-зв'язків – так звані β -декстрини.
β-амілази виявляють більшу стабільність у відсутність іонів Са2+. Молекулярна маса β-амілази рослин досить висока, вона складає від 50000 до 200000. Фермент може складатися з однієї або чотирьох субодиниць до 50 000 кожна. Фермент містить SH-групи та чутливий до дії важких металів. Вважається, що (β-амілазу має високу здатність до нескінченої атаки субстрату. Для амілози середньої молекулярні маси в одному при з'єднанні ферменту до субстрату можливо відчеплення до чотирьох залишків мальтози. При збільшенні молекулярної маси субстрату можлива і більша кількість місць атаки.
Продукт реакції – мальтоза – має β-конфігурацію. Гідроліз іде по лінійному ланцюзі тільки до α-1,6-зв'язків. При гідролізі крохмалю утворюється 54-58% мальтози і 42-46% високомолекулярних декстринів (β-декстринів). β-амілази виявляють більшу стабільність у відсутність іонів Са. Фермент може складатися з однієї або чотирьох субодиниць, містить SH-групи та чутливий до дії важких металів. Властивості β-амілаз залежать від джерел їх виділення. Для отримання мальтози з крохмалю використовують бактеріальні β-амілази(5).
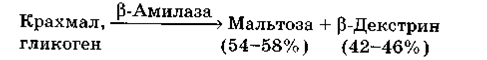
Рисунок 2.2. Принциповий механізм дії β-амілази(2)
Глюкоамілаза (1,4-α-D-глюканглюкогідролаза) широко рас-розлогий в природі. Вона синтезується багатьма мікроорганізмами і утворюється в тканинах тварин. У літературі фермент відомий під різними назвами: амілоглюкозідаза, γ-амілаза, лізосомальних α-глюкозидази, кисла мальтаза, матулаза, екзо-α-1 ,4-глюкозидази. Глюкоамілаза каталізує послідовне відщеплення кінцевих залишків α-D-глюкози з нередуцірующіх решт субстрату. Цей фермент проявляє екзогенний механізм впливу на субстрат. Багато глюкоамілази володіють також здатністю гідролізувати α-1 ,6-глюкозідние зв'язку. Однак це відбувається в тому випадку, коли за α-1 ,6-зв'язком слід α-1 ,4-зв'язок, тому декстран ними не гідролізується. Глюкоамілаза значно швидше гідролізують полімерний субстрат, ніж оліго-і дисахариди. Майже всі глюкоамілази є глікопротеїдів, що містять від 5 до 35% вуглеводів, які складаються з оліго-, ди- і моносахаридів.
Майже всі глюкоамілази є глікопротеїдів, що містять від 5 до 35% вуглеводів, які складаються з оліго-, ди-і моносахаридів. Угле ¬ водний компонент може бути цілісним фрагментом або ж розбитими на індивідуальні сполуки, які прикріплюються до білка через треонін і серин. Наприклад, у глюкоамілази A. niger їх 20. Більшість відомих глюкоамілаз має оптимум при рН 4,5-5,2, рідше - при 5,7-6,0, в основному для дріжджових глюкоамілаз(8).
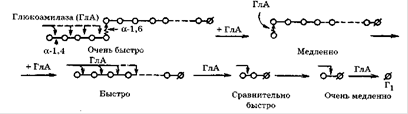
Рисунок 2.3. Принциповий механізм дії глюкоамілаз(2)
Фермент пуллуланаза (пуллулан-6-глюканогідролаза) раніше був відомий під назвами: R-фермент, гранична декстриназа або амілопектин-6-глюканогідролаза. Пуллуланаза, як і α-амілаза, є ендогенних ферментом, але на відміну від неї здатна невпорядковано гідролізувати α-1 ,6-зв'язку в пуллулані, амілопектину, глікогену та граничних декстрину, одержуваних при спільному впливі на крохмаль і глікоген α-і β - амілаз. Якщо між двома α-1 ,6-зв'язками розташовано більше трьох залишків глюкози, то розрив α-1 ,6-зв'язку йде значно повільніше, тому амілопектин гідролізується пуллуланазой гірше за інших розгалужених полісахаридів. Найбільш частим відщеплює фрагментом є мальтотріоза. Пуллуланази з різних джерел мають різні властивості(7).
Ізоамілаза (глікоген-6-глюканогідролаза), або дебранчінг-фермент, гідроліз α-1 ,6-зв'язку в розгалужених полісахаридів, таких як амілопектин, глікоген, β-граничні декстрини. Відмінною особливістю ізоамілази в порівнянні з пуллуланазой є те, що вона не здатна гідролізувати пуллулан і слабко діє на граничні β-декстрини. Бактеріальна ізоамілаза розщеплює α-1 ,6-зв'язку в глікогенній повністю, а пуллуланаза діє на цей субстрат слабо. Ізоамілазу утворюють багато мікроорганізмів, такі як B. amyloliquefacie, Cytophaga, Streptomyces, Pseudomonas amyloderamosa, Saccharomyces cerevisiae та ін, ферменти яких мають здатність гідролізувати субстрат при рН від 3,5 до 6,5 і температурах від 25 до 53 ° С. Ізоамілаза не стабілізується кальцієм, за винятком ферменту з Cytophaga. Молекулярна маса ізоамілаз коливається від 90 до 120 кДа.
α-глюкозидази (α-D-глюкозідглюкогідролаза) має здатність гідролізувати α-1 ,4-зв'язку від нередуцірующего кінця субстрату з відщеплення залишку глюкози. Фермент проявляє найбільшу спорідненість до низькомолекулярним субстрату, легко гідролізують мальтозу, олігосахариди, а полісахариди гідролізують повільно або зовсім не гідролізують. α-глюкозидази об'єднує групу ферментів і має ряд інших назв: мальтаза, глюкоінвертаза, глюкозідосахараза. Властивості ферментів, які продукуються різними мікроорганізмами, можуть значно відрізнятися. Фермент має здатність до перенесення α-D-глюкозільних залишків на відповідні акцептори, часто з утворенням α-1 ,6-зв'язків(5).
Декстраназа (1,6-α-D-глюкан-6-глюканогідролаза) каталізує розщеплення α-1 ,6-зв'язків у бактеріальному полісахариди декстрану. Серед продуцентів декcтраназ слід зазначити B. subtilis, B. megaterium, Lactobacillus befidus, Streptococcus mutans, Bravibacterium fuscum, Pseudomonas UQM-733, різні грунтові бактерії, а також численні види мікроскопічних грибів роду Penicilium, Aspergillus і Fusarium. Декстранази мають молекулярну масу від 35 до 71 кДа; вони є слабокислими білками. Ізоелектричної точка для всіх грибних декстраназ лежить в діапазоні від 4,0 до 4,6. Для більшості бактеріальних декстраназ оптимальна температура каталітичної дії 35-37 ° С; для грибних продуцентів температура трохи вище - 55-60 ° С. Оптимальне значення рН коливається в залежності від виду продуцента від 4,4 до 7,5. За допомогою ендодекстраназ можна отримувати з декстрану кровозамінники необхідної молекулярної маси; їх також використовують у стоматології для зняття зубних бляшок, що складаються з декстраноподобних глюканов(5).
![]()
Рисунок 2.4. принциповий механізм дії декстранази(2)
Амілаза B. Macerans (1,4-α-D-глюкан-4-α-(1,4-α-глюкану) трансфераза (ціклізующая)) Ця унікальна амілаза, яка вперше була знайдена в культурі B. macerans. Вона циклізує частину ланцюга 1,4-α-глюкану шляхом утворення 1,4-α-глюкозідной зв'язку. Робоча назва цього ферменту – циклодекстринглюканотрансфераза (ЦГТ-аза). При дії на крохмаль і аналогічні субстрати утво