Хламідії. Будова та морфологічні особливості
Міністерство освіти та науки України
Національний технічний університет України «КПІ»
Факультет
Курсова робота
з курсу «…»
на тему «Хламідії. Будова та морфологічні особливості»
Керівник:
Виконав:
Студент 2-го курсу
Допущений до захисту:
«___»__________2009р
групи
Захищено з оцінкою:
____________________
Залікова книжка:
№ …………….
Київ-2009
ВСТУП
Хламідія - мікроорганізм, що займає проміжне положення між бактеріями і вірусами і що є збудником хламідіозу.
У природі існує два види хламідій, але патогенними для людини є тільки мікроорганізми, що відносяться до другого вигляду. Основний збудник сечостатевого хламідіозу - Chlamydia trachomatis серотипів D-K, проте відомо, що венеричний лімфогрануломатоз і трахома також викликаються різновидами Chlamidia trachomatis.
Інфекцією можуть вражатися будь-які слизисті оболонки, покриті циліндровим епітелієм. Даний мікроорганізм може існувати як зовні, так і усередині клітини хазяїна, де він посилено розмножується. Повний цикл розвитку триває в середньому 2-3 доби, що залежить від штаму збудника, особливостей навколишнього середовища і клітини-хазяїна. Поява нових запалень сприяє посиленню імунної відповіді хазяїна, а також ступеню пошкоджень. Chlamidia trachomatis, як і всі внутріклітинні мікроорганізми, здатна міняти захисні механізми клітини-хазяїна.
У деяких випадках інфекція може тривалий час існувати всередині клітини при цьому не розмножуючись. Таку інфекцію називають персистентною, як правило, вона ніяк не виявляється клінічно. Персистенція є наслідком впливу зовнішніх чинників на мікроорганізм, тобто він знаходиться в таких умовах, при яких нормальне розмноження неможливе.
Хламідійна інфекція надзвичайно широко поширена в природі. Вона може виявлятися більш ніж в 20 клінічних синдромах, приводячи до сліпоти, безпліддя, інвалідності, часто вражає різні ділянки органів сечостатевої системи. Хламідії - облігатні внутрішньоклітинні паразити, представлені двома формами, що відрізняються, які володіють загальним груповим антигеном і змінюють один одного в циклі розвитку збудника . Не дивлячись на те, що дані про внутріклітинну локалізацію хламідії з'явилися більше 70 років назад, патогенетичні механізми їх паразитизму вивчені недостатньо.
Враховуючи особливості хламідій, діагностика і лікування захворювань, що викликаються цими мікроорганізмами, дещо ускладнені. Проте, використання сучасних методів дослідження і новітніх лікарських препаратів дозволяють визначити всі особливості збудника і добитися повного одужання.
1. Огляд літератури
1.1 Відкриття хламідій та історія їх вивчення
Вже в XV столітті до нашої ери в староєгипетському папірусі згадується ексудативне захворювання очей. Тоді це ж захворювання було відомо в Китаї, Греції і Римі. Ним страждали такі видатні діячі, як Цицерон, Горації, Плиній - молодший (1).
У 60-і роки нашої ери сицилійський лікар Pedanius Diasсarides для назви цієї хвороби ввів термін «трахома», що означає «нерівний, шорсткий». Пізніше Гален встановив чотири стадії цього захворювання (2).
У 1879 р. був відкритий гонокок Neisser. У цей же період у новонароджених відзначали офтальмію, яка, як незабаром з'ясувалося, також має гонококову і негонококову природу. Kroner (1884) припустив, що негонококова офтальмія, ймовірно, викликається невідомим мікроорганізмом, зараження яким відбувається в генітальному тракті породіль.
Такі відомі учені, як Koch, Halberstaedter і Prowazek в 1883-1907 р відзначили наявність схожих включень в кон’юнктивальних мазках у дітей з негонококовою офтальмією. Аналогічні включення в клітках мазків, одержаних з шийки матки і уретри батьків дітей з природженою офтальмією, це і відзначав Heyman (1910), але оскільки у ряді таких випадків разом з включеннями виявляли і гонококи, то це приводило до спірного трактування їх етіологічній ролі. Проте Wahl (1911) стверджував, що гонококові для поста уретрити (ПГУ) викликаються не гонореєю, а є результатом первинної змішаної інфекції, викликаної і гонококами, і збудниками негонококових уретритів (НГУ) (3).
Таким чином, протягом декількох років були встановлені ключові епідеміологічні факти генітального хламідіозу - його роль в етіології НГУ і ураження очей у новонароджених, передача статевим шляхом. Подальше вивчення проблеми затримувалось через неможливість культивування С. trachomatis в лабораторних умовах.
Bedson, Bland ( 1934) встановили наявність схожості в життєвих циклах С. psittaci і С. trachomatis. Thygеson, Mengert (1936) припустили, що включення розміщуються в проміжному епітелії шийки матки (2).
Спроби виділення мікроорганізмів з фільтрату уражень із застосуванням хоріон-аллантоісних мембран курячих ембріонів були безуспішні.
Інтерес до цього мікроорганізму пожвавило виділення збудника трахоми T’ang і співавторами (1957). Для його культивування T’ang і співавтори застосували запліднені курячі яйця. У перших дослідах захист яєць від суперінфекції здійснювали пеніциліном, але незабаром було відмічено, що він несприятливо діє на хламідії. У цій же роботі повідомляється про наявність у С. trachomatis чутливості до тетрацикліну і резистентності до аміноглікозиду (3).
Знахідки T’ang і його співробітників незабаром підтвердили і інші дослідники, зокрема Collier, Sowa.
Їх подальшими роботами (Collier, Duke-Elder, Jones, 1958) встановлено, що передача збудника від людини до людини викликає трахому. Послідували енергійні пошуки методів профілактики трахоми і боротьби з нею,включаючи спроби одержати вакцину.
Вперше з урогенітального тракту С. trachomatis виділили Jones, Collier, Smith (1959), і серією проведених ними важливих клінічних досліджень знов були підтверджені основні епідеміологічні факти, що відносяться до хламідіозу: зв'язок з негонококовими уретритами, передача статевим шляхом, взаємозв'язок захворювань у дорослих і очних уражень у дітей.
Великим досягненням стало досягнення Gordon, Quan (1965) метод культивування С. trachomatis на тканинних моношарових середовищах, що включає центрифугування зразків клінічного матеріалу, інкубацію і забарвлення клітин для демонстрації включень. Відносна простота методики дозволяє досліджувати велике число клінічних зразків, і незабаром було відмічено, що вона чутливіша, чим методика культивування, що раніше застосовувалася, на жовткових мішках курячих ембріонів. Ця ж група дослідників встановила, що метод можна використовувати для виділення хламідій з генітального тракту, прямої кишки, очей і з інших органів (Dunlop, Hare et al., 1969). Вони ще раз продемонстрували наявність взаємозв'язку очних і генітальних уражень і показали, що збудник виділяється у чоловіків з НГУ і у жінок, з якими вони знаходилися в статевому контакті.
Труднощі, що виникають при культивуванні С. trachomatis в лабораторних умовах, привели до необхідності пошуку серологічних методів. Спочатку застосовувався лише метод комплементифіксації (КФ) з антигенами пситтакозу або венеричні лімфогранулеми. Тест мав недостатню чутливість для діагностики кон'юнктивіту з включеннями. Великі переваги мав метод мікроімунофлюорисценсії (МІФ), розроблений Wang (1971). Цей метод цінніший при епідеміологічних дослідженнях (2).
2. Класифікація роду Chlamydia
2.1 Питання класифікації
Про природу хламідій були різні думки: їх вважали бактеріями, рикетсіями або атиповими вірусами (1). Унаслідок того, що хламідії неможливо вирощувати на звичайних бактеріологічних середовищах і в результаті таксономічної плутанини, термінологія, що відноситься до хламідіозів, протягом тривалого часу була недосконалою. На думку Page (1966), що інтенсивно вивчав морфологію, цитологію, хімічну структуру і метаболізм цих мікроорганізмів, їх слід віднести до бактерій.
Перші дослідники трахоми Halberstaedter, Ргоwazek (1907) запропонували для найменування сімейства термін Chlamydozoa (від грецького chlamys - мантія, для позначення матриксу навколо елементарних тілець. Акцентуючи наявність відмінностей між рикетсіями і хламідіями, Jones, Rake, Stearns (1945) вперше запропонували таксометрично обгрунтовану назву Chlamydia.
Між 1957 (7-е видання Визначника Bergey і 1975 р. (8-е видання Визначника Bergey) дискусія велася щодо числа родів в сімействі Chlаmуdiacae. Moulder (1964, 1966) розділив сімейство на дві групи:
· група А - збудники трахоми і супутніх захворювань;
· група Б - псіттакози.
Page (1968) запропонував розрізняти два види в одному роді, а саме С. trachomatis в групі А і С. psittaci в групі Б. У класифікації Bergey (8-е видання Визначника), хламідії за традицією все ще відносилися до групи рикетсій, хоча спорідненістю вони з ними не зв'язані. Схожість же їх життєвих циклів, ймовірно, є результатом конвергентної еволюції (2).
До 1980 р. ці бактерії називали бедсоніями, міягаванеллами, гальпровіями. У 1980 р. в результаті роботи Міжнародної Асоціації Мікробіологічних Суспільств була дана назва хламідія (3).
По сучасній класифікації хламідії поміщені в одну таксономічну групу з рикетсіями, з якими їх об'єднує внутріклітинний паразитизм (4).
Отже, сучасна класифікація хламідій така:
Царство: Бактерії
Тип: Ріккетсії
Відряд:Chlamydiales
Сімейство:Chlamydiaceae
Рід:Chlamydia
Вид:Ch. trachomatis, Ch. psittaci, Ch. pneumoniae, Ch. pecorum (3).
2.2 Ознаки роду Chlamydia
Хламідії - своєрідна таксономічна група патогенних мікроорганізмів, що володіють схожими антигенними, морфологічними, біохімічними характеристиками. Вони не можуть вільно існувати поза клітками організму господаря, не можуть самостійно синтезувати такі життєво необхідні з'єднання, як АТФ, а використовують для цього системи біоенергетики кліток макроорганізму.
Хламідії як біологічно своєрідні "енергетичні" паразити різних кліток-господарів володіють унікальним циклом внутріклітинного розвитку. Найдрібніші спороподібні елементарні тільця не мають аналогів серед бактерій, фільтруються через бактерійні фільтри і не ростуть на штучних живильних середовищах. У зв'язку з цим хламідії кардинально відрізняються від всіх інших бактерій і тому виділені в особливий порядок - Chlamidiales, що включає одне сімейство- Chlamidiaceas, що містить один рід - Chlamуdiа, хоча ряд біологічних ознак і дані електронної мікроскопії доводять їх приналежність до грамнегативних.
Рід Chlamуdia об'єднує 4 види: C. psittaci, C. trachomatis, C. pneumoniae і C. pecorum (табл.2.1).
Таблиця 2.1- Класифікація хламідій (5).
| Рід | Види | Біовари | Серовари |
Chlamydia | Chlamуdia trachomatis | Трахома, пара трахома | A, B, Ba, C |
Урогенітальний хламідіоз, кон’юнктивіт і пневмонія Новонароджених | D, E, F, H, I, J, K | ||
| Венерична лімфогранульома (ВЛГ) | L1, L2, L3 | ||
| Мишача пневмонія | I | ||
Chlamydia psittaci | Первинні патології тварин | I3 | |
Chlamydia pneumoniae | Пневмонія, ГРЗ, атеросклероз, саркоїдоз, астма | TWAR, AR, KA, CWL | |
Chlamydia pecorum | Виділені від хворих тварин | ? |
Таким чином, хламідії близькі по структурі і хімічному складу до класичних бактерій, але не володіють багатьма метаболічними механізмами, необхідними для самостійного розмноження. Особливостями хламідій є:
Обов'язковий внутрішньоклітинний енергозалежний від хазяїна паразитизм
Унікальний цикл розвитку.
Бактеріоподібні характеристики хламідійної клітини:
Збереження морфологічної суті на протязі всього життєвого циклу
Ділення вегетативних форм
Наявність клітинної стінки
Чутливість до ряду антибіотиків широкого спектру дії
Наявність загального родоспецифічного антигена.
Все це визначає самостійне положення цих мікроорганізмів серед прокаріот (5).
3. Характеристика будови та морфології представників роду Chlamydia
3.1 Морфологічні особливості
Хламідії є групою прокаріотних мікроорганізмів і мають вид дрібних грамнегативних коків. Добре видні в не зафарбованому стані при мікроскопії вологих препаратів під склом за допомогою фазовоконтрастної оптичної системи (6). Це облігатні внутрішньоклітинні паразити, представлені двома формами, що відрізняються, і що мають загальний груповий антиген (7).
Із-за невеликих розмірів і нездатності виживати на неживих бактеріологічних середовищах хламідії вважалися вірусами. У табл. 3.1. перераховані характеристики Chlamydia порівняно з бактеріями, мікоплазмами і вірусами.
Таблиця 3.1 - Порівняльна характеристика хламідій, бактерій, мікоплазм та вірусів (2).
Ознака | Хламідії | Бактерії | Мікоплазми | Віруси |
| Розмір (500 нм) | + | - | + | + |
| Клітинна оболонка | + | + | - | - |
| ДНК / РНК | + | + | + | - |
Ядро без обмежувальної мембрани | + | + | + | - |
| Метаболізм карбон гідрату | + | + | + | - |
| Рибосоми 70S | + | + | + | - |
| Екліпсо-фаза | - | - | - | + |
| Використання нуклеїнових кислот хазяїна | - | - | - | + |
| Бінарне ділення | + | + | + | - |
| Інгібіювання антибіотиками | + | + | + | - |
| Ріст на неживих бактеріологічних середовищах | - | + | + | - |
Дві форми мікроорганізмів, що відрізняються, позначають як елементарні та ініціальні (або ретикулярні) тільця. Елементарні тільця є невеликими частинками розміром близько 300 нм. Це транспортні форми, високо інфекційні, адаптовані до виживання в неклітинному середовищі, не піддаються дії антибіотиків (8), при забарвленні по Гімзе дають рожево-фіолетовий відтінок. Вони оточені оболонкою, яка представлена жорсткими тришаровими структурами, аналогічними клітинним стінкам грамнегативних бактерій, вміщують нуклеоїд та протопласт, що забезпечує витривалість до факторів зовнішнього середовища при переносі від клітини до клітини (9). Розмір ініціальних (ретикулярних) тілець 800-1200 нм, вони мало інфекційні і є внутріклітинними репродуктивними формами, що забарвлюються по Гімзе в голубуватий колір. Ініціальні тільця, отримали свою назву, оскільки вони з'являються на самому початку розвитку хламідійних включень. Клітинна оболонка ініціальних тілець тонша і ніжніша, ніж у елементарних, і тісніше прилягає до клітинної мембрани. Цей факт має важливе значення, оскільки дозволяє здійснюватися дифузії матеріалу включень, що розвиваються (2). Елементарні тільця мають більшу електронну щільність, ніж ядерний матеріал, я також фібрилярний нуклеоїд. Проміжні тільця — проміжна стадія між елементарними і ретикулярними тільцями (9). Форми їх досягають 500-1000 нм і навіть до гігантських розмірів діаметром 2-3 мкм діляться бінарно, або способом внутрішньої фрагментації. Знання про наявність проміжних форм має практичне значення і важливе при мікроскопії мазків (10). Життєвий цикл хламідій в оптимальних умовах росту в еукаріотичних клітинах складає 17-40 год (6).
3.2 Будова бактеріальної клітини хламідій
3.2.1 Мембрана та внутрішньоклітинні структури
Хламідії мають досить складну структурну організацію. Зовнішня мембрана, хімічний склад якої відповідає складу такої ж у грамнегативних бактерій (6), представлена в більшості ліпополісахаридом (ЛПС ), який вміщує детермінанти родової серологічної специфічності збудника. Вона складається із внутрішньої цитоплазматичної та зовнішньої мембран( обидві є подвійними, що забезпечує міцність клітинної стінки) (4). В ній у великій кількості вміщуються ліпіди і пептидоглікан, до складу якого входить н-ацетилмурамова кислота (9). Антигенні властивості хламідій визначаються внутрішньою мембраною (4).
Клітинна оболонка частинок містить лізин і D-аланін, але не має диамінопімелової кислоти. Дискутабельним є наявність N-ацетилмурамової кислоти (її виявляють тільки у бактерій). Структура клітинної оболонки ініціальних тілець (РТ) відрізняється від структури елементарних тілець (ET) тим, що пептидоглікани не сполучені пептидними містками. Можливо, що це збільшує проникність аденозинтрифосфату через клітинну оболонку ініціальних тілець. Передбачається, що пептидоглікан має інші функції, відмінні від інших бактерій (4). На відміну від мікоплазм хламідії не містять холестеролу в клітинних оболонках. Спостерігаються в значних кількостях ліпіді і карбондигідратів, але частка нуклеїнових кислот не велика (2).
Оскільки хламідії є облігатними внутріклітинними паразитами, їх внутрішня будова набагато простіша, ніж у вільноживучих бактерій, багато органели зредуковані, або відсутні взагалі. Так головною їх ознакою є відсутність мітохондрій, і дані бактерії забезпечують своє існування за рахунок енергії клітин-хазяїна, тобто, використовують їх АТФ (11).
На відміну від вірусів, хламідії містять як ДНК (ядерний апарат), так і рибосоми (7). Геном хламідії має невеликий розмір і складає не більше 15% генома кишкової палички. Він складається з хромосоми, що містить 1042519 пар основ (58,7% ) і плазміди, що має в своєму складі 7493 пара основ. Аналіз генома дозволив виділити 894 гени, що кодують різні білки. Схожість з раніше дослідженими білками інших бактерій дозволила визначити функціональне призначення 604 (68%) кодованих білків. 35 (4%) білків були схожі з білками, що є у інших бактерій. У тих, що залишилися 255 (28%) білках послідовності були несхожі раніше вивчені. Аналіз білкових послідовностей показав, що 256 (29%) хламідійних білків групуються в 58 сімейств в межах генома подібно до групування білків у бактерій з невеликим геномом, таких як мікоплазми і Haemophilus influenzae (4). Так само як і в бактерійних клітинах, виявлена рибосома 70S, що підрозділяється на компоненти 30S і 50S. Описана наявність вісімнадцяти амінокислот. Важливим моментом, що відрізняє хламідії від вірусів, є виявлення циклогексіміда (Tribby, Friis, Moulder, 1973). Цей компонент інгібує синтез рибосом в еукаріотних клітинах, отже, на відміну від вірусів хламідії синтезують свій власний ДНК-протеїн (2).
3.2.2 Антигени
Хламідії володіють специфічними антигенами. Один з них - термостабільний групоспецифічний – являє собою ліпоглікопротеїд, інший - термолабільний видоспецифічний антиген (6).
Всі хламідії мають загальний груповий, родоспецифічний антиген (ліпополісахаридний комплекс, реактивною половиною якого є 2-кето-3-дезоксиоктановая кислота), що використовується при діагностиці захворювання імунофлуоресцентними методами із специфічними антитілами.
Білки MOMР (Major Outer Membrane Protein) і OMР-2 (Outer membrane proteins) містять видо- і серотипоспецифічні епітоти. Проте в них є також області з високою схожістю серед видів (родоспецифічні епітоти), що зумовлює можливість появи перехресних реакцій. Основний білок клітинної мембрани і багаті цистеїнами інші білки зв'язані дисульфідними зв'язками. Виявлено п'ять генів дисульфізв'язаних ізомераз, що можливо грають роль в реструктуризації цистеїнбагатих білків при диференціації елементарних тілець в ретикулярні. У Сhl. trachomatis виявлено 9 генів, що кодують поверхневі мембранні білки, у Chlamydia рneumonia -18 (4). У таблиці 3.2 наведені пізні групи антигенів у хламідій та їхній хімічний склад:
Таблиця 3.2 - Антигени хламідій (по Mardh P., 1990) (4)
Антиген | Хімічний склад | Примітка |
Родоспецифічний (загальний для всіх видів хламідій: Chlamydia psittaci, Chlamydia trachomatis, Chlamydia pneumoniae) | Ліпосахарид | Три різних антигенних домени |
Видоспецифічний (різний для всіх видів хламідій Chlamydia psittaci, Chlamydia trachomatis, Chlamydia pneumoniae) | Білки | Більше 18 різних компонентів 155 кДа у Chlamydia trachomatis, епітопи у білку 40 кДа, білок теплового шоку hsp-60 |
Типоспецифічний (різний для сероварів Chlamydia trachomatis) | Білки | Епітопи в 40 кДа протеїнів(МОМР), протеїнів 30 кДа у серотипів А и В |
3.2.3 Особливості поверхневих структур елементарних та ретикулярних тілець
Раніше методом скануючої електронної мікроскопії на поверхні хламідій були виявлені куполоподібні структури, пронизані Мікрофіламентами. Мікрофіламенти, що виходять з їх центру досягають мембрани включень і пронизують її. Функцію цієї структури пов'язують з транспортом живильних речовин від еукаріотичних клітин до паразита. Виявлення в геномі хламідій генів, що кодують апарат для 3 типу секреції, який зумовлює вірулентність грамнегативних бактерій, дозволив припустити, що це утворення здійснює передачу сигналу від паразита до еукаріотичних клітин (4).
Як уже згадувалося, спороподібна форма (елементарні тільця) забезпечує реалізацію механізму передачі інфекції і виживання вигляду в зовнішньому середовищі (12). Вегетативна форма (ретикулярні тільця) забезпечує репродукцію організму усередині клітин організму-хазяїна, але не здатна інфікувати інші клітки. Ці форми розрізняються по ультраструктурі і фізіологічним потенціям (13). На поверхні очищених елементарних і ретикулярних тілець збудника менінгопневмонії (С. psittaci) були описані своєрідні трубчасті відростки діаметром 5 - 6 нм і завдовжки 35-40 нм, що начиняються, мабуть, від цитоплазматичної мембрани і що проходять через клітинну стінку (14).
На поверхні деяких елементарних тілець виявили кільцеподібні структури діаметром 15-22 нм, що мали світліший центр діаметром 4-7,5 нм. Вони були розташовані в гексагональній упаковці з відстанню між центрами 45 нм. Іноді на відстані 45 нм один від одного зустрічаються відростки діаметром 3 - 4 нм і завдовжки 10-20 нм.
Ці субодиниці клітинної стінки є характерним елементом поверхні більшості грамнегативних бактерій (15).
За розміром і періодичністю розташування виявлені відростки відповідають трубчастим відросткам, детально описаним на поверхні елементарних тілець збудника міненгопневмонії. Трубчасті відростки завдовжки 35-40 нм і діаметром 5-6 нм проходять, згідно моделі Matsumoto (16), через отвори в клітинній стінці - «розетки» - і кріпляться до цитоплазматичної мембрани у області В-структур - своєрідних вп'ячування цієї мембрани.
Кільцеподібні структури на поверхні елементарних тілець відповідають «розеткам». Модель Matsumoto була побудована на підставі вивчення за допомогою різних методів (негативного контрастування, заморожування - труять, спеціальних обробок ультратонких зрізів очищених препаратів елементарних тілець (16).
Трубчасті відростки є і у ретикулярних тілець (15). У збудника менінгопневмонії їх діаметр 10-13 нм. Розміри розеток: зовнішній діаметр 17-18 нм, внутрішній 14-15 нм. Максимальне число їх спостерігається через 10 г після зараження L-клітин ( приблизно 45), а за тим поступово зменшувалося до 20 через 20 г після зараження. Розетки на клітинній стінці розташовуються або 1-2 групами, або безладно по всій поверхні (особливо для ранніх ретикулярних тілець).
Роль описаних відростків в прикріпленні хламідій поки встановити не вдалося, але на думку Matsumoto вони можуть служити своєрідним каналом, що зв'язує цитоплазми хламідій і клітини-хазяїна для транспорту метаболітів (13). Можливо відростки елементарних тілець схожі до фімбрій бактерій.
Отже поверхня клітинної стінки хламідій утворена округлими субодиницями діаметром 4 нм, виявлені відростки і кільцеподібні структури, через які вони проходять, і розташовані вони в гексагональній упаковці.
4. Характеристика метаболізму та життєвий цикл хламідій
4.1 Характеристика метаболізму хламідій
Як вже згадувалось, хламідії, як енергетичні паразити живих епітеліальних клітин, використовують для свого метаболізму їх АТФ. В даний час аналіз генома показав, що хламідії здатні синтезувати АТФ, хоч і в незначних кількостях, шляхом гліколізу і розщеплювання глікогену (4).
Як було виявлено Weiss і співавт. (1964), у хламідій спостерігається анаеробний метаболізм глюкози, що проходить по шляху пептозофосфату і одного з гліколітичних шляхів. Тобто, при додаванні кофакторів яких вони потребують, хламідії можуть метаболізавати глюкозу, а також піровиноградну і глутамінову кислоти (7).
Ця активність здійснюється на низькому рівні і за цих умов приводить до втрати АТФ і НАД. Система транспорту електронів відсутній, хоча обидві частинки містять цитохром С-редуктазу. Макромолекулярний синтез клітин хазяїна гальмується хламідіями, і високоенергетичні субстанції кліток хазяїна переходять на синтез протеїнів і ліпідів хламідій. Таким чином, забезпечення мікроорганізму метаболітами здійснюється в основному за рахунок життєдіяльності клітин хазяїна. Деякі з цих метаболітів (ізолейцин) можуть бути інгібіторами зростання хламідій і, ймовірно, можуть мати відношення до латентної течії при хламідіозі (Hatch, 1975) (2).
Як яскравий приклад метаболічної активності хламідій і впливу на метаболізм клітин хазяїна є дослідження Харківського ПІІ дерматології і венерології на споживання глюкози клітинами (17). Досліди проводили на зараженій культурі клітин L-929. Утилізація глюкози інфікованою культурою достовірно вище протягом всього процесу культивування. Оскільки в інфікованій культурі інтенсивне зростання кліток не відбувається, можна припустити, що збільшення споживання глюкози кліткою пов'язано з цитоплазматичним включенням, що розвивається, тобто хламідійною інфекцією (18). Через 5 г після зараження, коли фагосома з елементарних тілець (ET) переміщається в пластинчастий комплекс і ЕТ перетворюється на ретикулярні тільця (РT) через проміжні тільця (PT), споживання глюкози клітками культури більш ніж в 7 разів вище, норми. Можливо, в цей період активізуються біосинтетичні процеси клітини-хазяїна, продукти яких будуть використані збудником на побудову включення.
Згідно з літературними даними (19), починаючи з 10-12 г після впровадження збудника і до 36 г РT, зазнає 10-11 поділень, при цьому утворюється пул кліток, що є цитоплазматичним включенням. Звичайно цей процес закінчується до 24 г. Можливо, достовірне зниження споживання глюкози інфікованою клітиною, яке більш ніж в 4 рази вище в порівнянні з нормою, в цей період пов'язано з уповільненням її метаболічній активності при швидкому зростанні морфологічних структур збудника.
Можна припустити, що перетворення метаболічно активних РT в неактивні ЕТ, як правило, що завершується до 48 г, супроводжується розкріпаченням власних метаболічних процесів, клітини, і, як наслідок, спостерігається тенденція до збільшення споживання глюкози (18).
До 72 г цикл розвитку хламідій завершується. При мікроскопуванні препаратів спостерігали зрілі бочкоподібні включення збудника, що займають практично весь об'єм клітини. Значна частина моношару зруйнована, вміст глюкози в середовищі збільшений. І не дивлячись на це, споживання глюкози інфікованою клітиною в цей період в 3 рази вищий, норми.
Таким чином встановлено, що споживання глюкози інфікованою кліткою впродовж всього циклу розвитку збудника достовірно вищий, ніж у нормі. Спостерігаються певні кореляційні залежності між стадіями розвитку збудника і споживанням глюкози інфікованою кліткою.
Також проводилися дослідження синтезу білка в клітинах хазяїна по активності трансаміназ. Активність аланіномінотрансферази (AлT), аспартатаминотранферази (AсT) визначали по методу С. Райтмана, С. Френкеля (1957).
Так, до 24 гактивність обох трансфераз у сфері культивування нормальних клітин достовірно збільшилася (AсT - в 4 рази, АлТ-в 8 разів) і залишилася на досягнутому рівні весь період, що залишився. Можна припустити, що інтенсифікація діяльності ферментів до 24 г культивування пов'язана з посиленим утворенням амінокислот в ході реакцій трансамінування, які використовуються як субстрат при синтезі білкових молекул в культурі, що активно ділиться (експоненціальна фаза зростання). До 72 г розвиток клітин в культурі виходить на плато. Крім того, спостерігається деяка тенденція до зниження активності ферментів (17).
Через 24 г після інфікування не було відмічено достовірних відмінностей між активністю ферментів в середовищі культивування нормальних клітин і в середовищі культивування інфікованих клітин, тоді як у всіх інших часових інтервалах активність ферментів в середовищі культивування інфікованих клітин була достовірно вища. Відносно низька активність ферментів в середовищі інкубації інфікованої культури клітин через 24 г може свідчити, про те, що амінокислоти інтенсивно включаються в синтез білка, і немає сенсу здійснювати ширше їх використання для інших цілей (18). Разом з тим в період від 24 до 48 г культивування активність AлT і AсT збільшувалася майже в 2 рази, причому в цей період вона вища, ніж в нормі, відповідно в 2,9 і 3,5 рази. Це може бути пов'язане з інтенсифікацією процесу глюконеогенезу в інфікованій культурі. Дійсно, згідно з літературними даними (19). саме у цей період завершується ділення РT, починається їх перетворення в ЕТ, а при мікроскопуванні в інфікованих клітках виявили гранули глікогену. Іншою причиною такого швидкого зростання активності ферментів в середовищі може бути збільшення проникності мембран інфікованої клітки.
До 72 г активність AлT зростає ще в 2,1 рази, в цей період вона вища, ніж в нормі, в 6,7 рази, AсT, відповідно, - в 5,6 рази. У цей період закінчується цикл розвитку хламідій, клітини руйнуються і росте вміст ферменту і середовища (17).
Таким чином, виявлені достовірні відмінності у ферментативній активності клітин нормальної і інфікованої культур. Показано, що активність ферментів в середовищі культивування інфікованих кліток збільшується в процесі дослідження, що корелює з циклом розвитку збудника (17).
Деякі факти, виявлені в ході дослідження, не знайшли свого пояснення у зв'язку з тим, що хламідії в процесі пристосування до внутріклітинного паразитизму виробили унікальні структури і біосинтетичні механізми, що не мають аналогів у інших бактерій. Не пояснений той факт, що у хламідій не виявлений висококонсервативний ген Ftsz, абсолютно необхідний для клітинного ділення всіх прокаріот, оскільки він відповідальний за утворення клітинної перегородки під час ділення клітки. У хламідії відсутній пептидоглікан - компонент клітинної стінки існує як у грампозитивних, так і у грамнегативних бактерій, але при цьому в геномі містяться гени, що кодують білки, які необхідні для його повного синтезу. Передбачається, що пептидоглікан, що синтезуються, або пептидогліконовий компонент мають інші функції, відмінні від інших бактерій (4).
4.2 Життєвий цикл хламідій всередині зараженої клітини
Зрілою формою збудника хламідіозу є спороподібне ЕТ з діаметром 250-300 нм, що володіє інфекційністю і обмеженою метаболічною активністю.
Ретикулярні тільця утворюються в процесі розмноження мікроорганізму всередині клітини-хазяїна, є попередником нового покоління ЕТ і є вегетативною формою хламідії. У протилежність ЕТ - вельми лабільні, неінфекційні і володіють вираженою метаболічною активністю. Проміжні тільця утворюються на двох стадіях циклу розвитку хламідій: на ранній, при перетворенні ЕТ в РT, і на пізніше, при реорганізації РT в ЕТ .
Цикл розмноження хламідій - облігатних внутріклітинних паразитів - реалізується при їх взаємодії з чутливою клітиною-хазяїном.
Схематично і спрощено основні морфологічні етапи цього циклу представлені на (рис.4.2.1). Інфекційні ЕТ адсорбуються на поверхні клітини, яка потім поглинає їх шляхом ендоцитозу. Доля фагоцитованих ЕТ на цьому першому критичному етапі взаємодії з клітиною-хазяїном може скластися двояко:
• EТ гине під впливом лізосомної активності клітини-хазяїна
• ЕТ зберігає життєздатність і вступає в цикл розвитку (5).
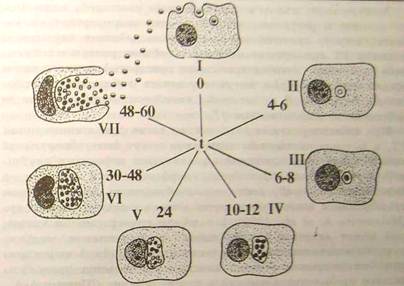
Рисунок 4.2.1 - Схема циклу розвитку хламідій в чутливій клітині: (Шаткін А.А., Мавров І.І., 1983) (5)
Хламідії здатні якимсь чином стимулювати специфічний фагоцитоз, що дає очевидні переваги облігатному внутріклітинному паразиту. Проникнення елементарних тілець в клітину супроводжується руйнуванням оболонок, внаслідок чого відбувається розм'якшення клітинних стінок. Присутність інфекційних частинок у фагосомі не супроводжується розщеплюванням лізосом, як при звичайному фагоцитозі. Цей процес управляється самими хламідіями, оскільки показано, що якщо в результаті фагоцитозу захоплюються хламідії, убиті нагріванням, то злиття лізосом не відбувається (Friis, 1972). Неспеціалізовані клітини (не здібні до активного фагоцитозу) стимулюються хламідіями так, щоб вони їх захоплювали (Byrne, Moulder, 1978) (2).
Можна виділити 4 основних шляхи, по яких можуть реалізуватися подальші етапи взаємодії хламідій з клітиною-хазяїном (Шаткін А.А., Мавров І.І., 1983) (19):
· Деструкція хламідії в фаголізосомній системі клітини-хазяїна
· Продуктивний цикл розвитку хламідій - репродукція
· L-подібна трансформація хламідій
· Персистенція хламідій.
Через 4-6 годин після зараження ЕТ (5), елементарні тільця розташовуються у вакуолі, оточеною деріватною мембраною, що захищає їх від дії лізоцимів. На відміну від вірусів хламідії не мають екліпсо-фази (). Деструкції, що далі не піддалися, в сприятливих умовах функціонування клітки-господаря, вступають в цикл розвитку, який протікає по відомій схемі: ЕТ реорганізуються у вегетативну форму - РT (через ПT); РT вступають в клітинний цикл, діляться бінарно (всього 8-12 циклів); дочірні РT перетворяться в ПT і далі в ЕТ- інфекційні форми нового покоління мікроорганізму. Цикл розвитку звичайно займає 48-72 години.
Вегетативну стадію в циклі розвитку хламідії, зокрема ділення і реорганізацію РT, можна розглядати як другий критичний етап взаємодії паразита і хазяїна. РT високочутливі до несприятливих екзогенних (наприклад, антибактеріальні препарати) і ендогенних дій, які можуть зумовити загибель паразита, що розмножується. В той же час антибіотики практично не діють на інфекційні ЕТ (20).
За несприятливих умов, на етапі функціонування РT, в цитоплазматичному включенні можуть бути виявлені аномальні форми хламідій з різними дефектами клітинної стінки. Ці утворення, морфологічно схожі з L-формами бактерій, закономірно утворюються під впливом тих, що традиційних трансформують агентів - Пеніциліну і ін. (Matsumoto A. et al., 1970). L-подібна трансформація хламідії може бути основою одного з механізмів, що індукують виникнення персистентної хламідійної інфекції, при безсимптомному перебігу яких спостерігається тривале перебування хламідій в клітині-хазяїна (Шаткін А.А., Попов В.Л., 1986).
Персистенція хламідій може спостерігатися при всіх відомих хламідіозах і у ряді випадків має надійне мікробіологічне підтвердження. Проте знання про цей шлях взаємодії паразита з хазяїном вкрай обмежені (5). Схематично цей шлях з боку господаря може бути пов'язаний з нездатністю забезпечити відтворення паразита необхідними метаболітами і / або використанням обмежених механізмів захисту, здатних лише інгібірувати розмноження, але не елімінувати патогенний агент. Як і інші шляхи взаємодії, персистенція хламідій поза сумнівом контролюється імунною системою. Відомо, що лімфоцити від імунних тварин оберігають персистентно інфіковані макрофаги від активації хламідійної інфекції. Відома і активна течія і генералізує локалізованих експериментальних хламідійних інфекцій у іммуносупресованих тварин. Активний розвиток цього напряму досліджень є одним з актуальних завдань хламідіологів (2).
В процесі взаємодії з хламідією клітина-хазяїн піддається дії її чинників патогенності, що викликають різні порушення життєдіяльності клітки. При продуктивному циклі розвитку хламідій в клітині-хазяїна послідовно пригнічуються життєві функції, що приводять до її загибелі і руйнування. Цей результат, як правило, наступає в період завершення циклу розвитку хламідій. Суть подій, що протікають в клітині-хазяїна при L-подібній трансформації і персистенції хламідій, залишається нерозкритою. Функціонально в цих ситуаціях реалізується часовий збалансований стан, результат якого теоретично може бути на к