Рак желудка
Рак желудка
Желудок, ventriculus (gaster)
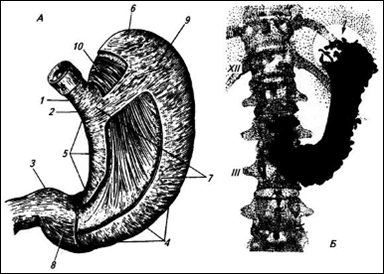
Рисунок 1. Желудок:
А – вид спереди, без серозной оболочки и со вскрытыми слоями мышечной оболочки; 1 – брюшная часть пищевода; 2 – область входа в желудок; 3 – привратник; 4 – большая кривизна; 5 – малая кривизна, 6 – свод; 7 – тело желудка; 8 – продольный слой мышечной оболочки (почти на всем протяжении желудка снят); 9 – слой кольцевых мышц (в двух местах снят); 10 – слой косых мышц; Б – рентгенограмма желудка при среднем наполнении его контрастной массой, XII – двенадцатое ребро; III – третий поясничный позвонок. Стрелка показывает на газовый пузырь в желудке
Желудок – наиболее расширенная часть пищеварительной трубки. Расстояние от резцов до желудка составляет приблизительно 40 см, что учитывается при его зондировании. Желудок имеет вид изогнутого мешка, асимметрично расположенного в полости брюшины: большая часть его (5/6) находится слева, а меньшая (1/6) – справа от срединной плоскости тела. Длинная ось желудка направлена слева сверху и сзади – вправо вниз и вперед.
Начальная часть желудка называется кардиальной, pars cardiaca, конечная – пилорической, pars pylorica; большая, средняя часть желудка, расположенная между кардиальной и пилорической, называется телом желудка, corpus ventriculi, и самая верхняя часть тела желудка, находящаяся вверху и слева от кардии, – дном желудка, fundus ventriculi, или его сводом, fornix.
При исследовании желудка живого человека (например, рентгенологическом) соответственно анатомо-физиологическим особенностям кардиальная часть, дно и тело желудка объединяются в понятие пищеварительного мешка, saccus digestorius, а пилорическая часть и сам пилорус – в эвакуаторный канал, canalis egestorius.
В желудке различают переднюю стенку, paries anterior, и заднюю, paries posterior. Передняя стенка всегда более выпуклая, чем задняя. Обе стенки при переходе одна в другую образуют верхний и нижний края желудка. Верхний край, более короткий и слегка вогнутый, называется малой кривизной желудка, curvatura ventriculi minor; нижний край выпуклый, значительно длиннее верхнего и называется большой кривизной желудка, curvatura ventriculi major.
При умеренном наполнении желудок проецируется на переднюю стенку в эпигастральной области и большей частью в левом подреберье. Вход в желудок, cardia, соответствует прикреплению к грудине хрящей левых VI–VII ребер. Выход желудка (пилорус) проецируется на 2,0–2,5 см вправо от средней линии на уровне хряща VIII ребра. При наполненном желудке pylorus смещается вправо от средней линии на 3–5 см.
Малая кривизна желудка, прикрытая печенью, соответствует дугообразной линии, окружающей мечевидный отросток слева и снизу. Проекция большой кривизны желудка начинается вверху от нижнего края V ребра по левой среднеключичной линии и идет по изогнутой влево пологой дуге к Х ребру по той же среднеключичной линии и дальше дугообразно вправо к латеральному краю левой прямой мышцы, пересекая ее и среднюю линию. Отсюда она направляется вправо и вверх на середине правой прямой мышцы, на уровне восьмого межреберного промежутка, скрывается под нижней границей печени.
Газовый пузырь желудка (пространство Траубе) соответствует дну желудка, скрытому слева под ребрами в виде полулунного участка.
Форма желудка непостоянна и меняется в зависимости от наполнения, положения тела, функционального состояния, состояния окружающих органов, а также при патологии его. Свободный от пищи желудок представляет собой плоский полый орган, стенки которого внутренними поверхностями, покрытыми слизистой оболочкой, соприкасаются друг с другом. При понижении тонуса желудок удлиняется.
Отмечаются выраженные индивидуальные различия в форме желудка. На основании рентгеноанатомических исследований выделено его несколько форм: желудок в форме чулка, в форме крючка (форма Ридера), в форме рога (форма Гольцкнехта) и др. У новорожденных желудок имеет веретенообразную форму. При патологических состояниях выделяют ряд характерных форм: желудок в форме песочных часов, улиткообразный желудок, «каскадный» желудок и др.
Вместимость желудка чрезвычайно индивидуальна, средней можно считать 1,5 – 2,5 л.
Желудок расположен по отношению к брюшине интраперитонеально, не покрыты брюшиной лишь участки большой и малой кривизны в месте прикрепления к ним большого и малого сальников, где проходят сосуды и нервы желудка. Желудок удерживается в своем положении за счет фиксации пищеводно-желудочного перехода в пищеводном отверстии диафрагмы, привратника – к задней брюшной стенке, окружающими органами, тонусом брюшной стенки, а также связочным аппаратом, образованным за счет перехода брюшины с желудка на стенки брюшной полости, а также из остатков первичных дорсальной и вентральной брыжеек его.
Различают поверхностные и глубокие связки желудка. Поверхностные связки желудка лежат во фронтальной плоскости, глубокие – в горизонтальной.
Поверхностные связки желудка непосредственно переходят друг в друга и создают непрерывный связочный ореол.
Желудочно-ободочная связка, lig. gastrocolicum, представляет собой переход двух листков висцеральной брюшины (переднего и заднего) с большой кривизны желудка на поперечную ободочную кишку. Она связывает большую кривизну желудка с поперечной ободочной кишкой на протяжении от привратника до нижнего полюса селезенки, являясь верхней частью большого сальника. Связка рыхло соединена с брюшиной передней стенки поперечной ободочной кишки, что позволяет при резекции желудка по поводу рака бескровно отделять большую кривизну желудка вместе с большим сальником от поперечной ободочной кишки.
Вдоль всей большой кривизны желудка между листками связки идут навстречу друг другу справа – правая желудочно-сальниковая артерия, a. gastroepiploica dextra, слева – левая желудочно-сальниковая артерия, a. gastroepiploica sinistra, которые анастомозируют между собой.
Желудочно-селезеночная связкa, lig. gastrolienale, соединяет верхнюю часта большой кривизны желудка с воротами селезенки, прикрывая сосудистую ножку ее. В толще связки проходят a. et vv. gastric ae breves
Желудочно – диафрагмальнaя связка, lig. gastrophrenicum, образуется за счет перехода париетальной брюшины с диафрагмы на переднюю поверхность дна желудка и частично кардии. В ней мало сосудов и при мобилизации желудка не требуется лигирования.
Диафрагмально-пищеводная связка, lig. phrenicoesophageum, также пред ставляет собой переход париетальной брюшины с диафрагмы на пищевод и кардиальную часть желудка. В основании ее в рыхлой клетчатки по передней поверхности пищевода идут г. esophageus из a. gastrica sinistra и ствол левого блуждающего нерва (truncus vagalis anterior)
Печеночно-желудочная связка lig. hepatogastricum, связывает нижнюю поверхность печени с малой кривизной желудка, она идет от ворот печени в виде двух листков брюшины и имеет форму трапеции, широко основание которой располагается на малой кривизне, где она, расходясь на два листка, переходит в висцеральную брюшину передней и задней стенок желудка. В клетчатке вдоль алой кривизны желудка проходят анастомозирующие между собой левая и правая желудочные артерии, а также лимфатические сосуды, здесь находятся левые желудочные лимфатические узлы. Количество жировой клетчатки между листками связки по направлению от малой кривизны к воротам печени постепенно уменьшается.
Глубокие связки желудка выявяются после рассечения lig. gastrocolicum и отведения желудка вверх. В этом положении выявляются две складки брюшины, идущие от верхнего края поджелудочной железы к кардиальной и пилорической частям желудка.
Желудочно – поджелудочная связка, lig. gastropancreaticum, образуется в результате перехода париетальной брюшины с верхнего края поджелудочной железы на заднюю поверхность тела и кардии желудка. В связке проходят левые желудочные сосуды, a et v. gastricae sinistra и чревная ветвь n. vagus.
Привратниково – поджелудочная связка, lig. pyloropancreaticum, расположена между пилорическим отделом желудка и правой частью тела поджелудочной железы. Она треугольной формы и содержит между листками жировую клетчатку и лимфатические узлы.
Артериальное кровоснабжениежелудка осуществляется из системы truncus celiacus через аа. gastricae sinistra et dextra, gastroepiploicae sinistra et dextra, а также аа. gastricae breves.
Левая желудочная артерия, a. gastrica sinistra, отходит от чревного ствола (75%), реже – от общей печеночной, селезеночной артерии или даже непосредственно от аорты (рис. 9). Длина ее у взрослых в среднем 3–7 см, диаметр 2–5 мм. A. gastrica sinistra идет в желудочно-поджелудочной связке к малой кривизне желудка в области кардии. При подходе к желудку она отдает восходящие пищеводные ветви, rr. esophageales. Основная нисходящая ветвь проходит слева направо вдоль малой кривизны, отдавая передние и задние ветви соответственно стенкам желудка.
Правая желудочная артерия, a. gastrica dextra, начинается чаще от собственной печеночной артерии, реже – от общей печеночной или желудочно-двенадцатиперстной артерии. Длина ее в среднем 2–5 см, диаметр 1–2 мм. Она идет справа налево между листками печеночно-двенадцатиперстной связки, отдавая ветви к желудку и анастомозируя с ветвями левой желудочной артерии.
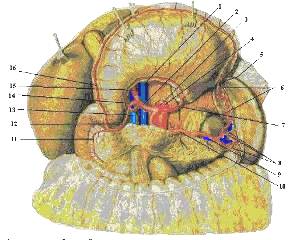
Рисунок 2. Артерии органов брюшной полости; вид спереди.
1 – v. cava inferior; 2 – а. hepatica communis; 3 – truncus coeliacus; 4 – aorta; 5 – gastroepiploica sinistra; 6 – aa. gastricae breves; 7 – a. gastrica sinistra; 8 – rr. lienales; 9 – v. lienalis; 10 – a. lienalis; 11 – a. pancreaticoduodenalis superior anterior; 12 – gastroduodenalis; 13 – v. portae; 14 – a. gastrica dextra; 5 – a. hepatica propria; 16 – gastroepiploica dextra.
Таким образом, на малой кривизне желудка образуется мощная анастомотическая артериальная дуга, от которой к стенке желудка идут многочисленные ветви.
Левая желудочно-сальниковая артерия, a. gastroepiploica sinistra, является ветвью селезеночной артерии. Ствол ее диаметром 0,5–1,5 мм располагается между листками селезеночно-желудочной связки, достигает большой кривизны желудка и идет вдоль нее слева направо. Длина ее колеблется от 3 до 25 см, в среднем 9–14 см. Левая желудочно-сальниковая артерия отдает левую сальниковую артерию, направляющуюся в большой сальник.
Правая желудочно-сальниковая артерия, a. gastroepiploica dextra, начинается обычно от желудочно-двенадцатиперстной артерии и идет к большой кривизне желудка. Длина ее колеблется от 9 до 38 см, в среднем 20–27 см, диаметр 1,5–3,0 мм.
На большой кривизне желудка благодаря анастомозам правой и левой желудочно-сальниковых артерий также образуется хорошо выраженная артериальная дуга, от которой отходят многочисленные ветви к передней и задней стенкам желудка, а также 4–8 правых сальниковых артерий.
Короткие артерии желудка, аа. gastricae breves, отходят от селезеночной артерии в количестве 1–6 ветвей. В селезеночно-желудочной связке они подходят к желудку и анастомозируют с ветвями левой желудочно-сальниковой и левой желудочной артерий.
Ветви перечисленных выше артерий проникают в стенку желудка и, разветвляясь, образуют внутриорганные сети, которые располагаются в различных слоях стенки желудка. Выделяют подсерозную, межмышечную, подслизистую и внутрислизистую сети.
Вены желудка, как и артерии, разделяют на внеорганные и внутриорганные. Внутри органная венозная сеть возникает из венозных сплетений слизистой оболочки и подслизистого слоя и серозной оболочки. Лучше всего выражено подслизистое венозное сплетение, оно рассматривается как центральное.
Крупные вены подслизистого слоя располагаются поперечно к оси органа, идут к большой и малой кривизне, где формируют соответственно левую и правую желудочные, левую и правую желудочно-сальниковые и короткие вены желудка. Иногда вены подслизистого слоя могут быть резко расширены, особенно в пищеводно-кардиальном отделе, где они, набухая, участвуют в замыкании пищеводно-желудочного соустья. В случаях варикозного расширения они могут быть причиной угрожающих жизни пищеводно-желудочных кровотечений.
Левая желудочная вена, v. gastrica sinistra, проходит в желудочно-поджелудочной связке брюшины справа от левой желудочной артерии и за головкой поджелудочной железы впадает в воротную вену, реже в v. lienalis или v. mesenterica superior.
Правая желудочная вена, v. gastrica dextra, идет с одноименной артерией по малой кривизне и в печеночно-двенадцатиперстной связке достигает ворот печени, где впадает в воротную вену или ее левую ветвь.
Правая желудочно-сальниковая вена, v. gastroepiploica dextra, как правило, впадает в верхнюю брыжеечную вену вблизи места формирования воротной вены, реже – непосредственно в воротную вену. Анастомоз между правой желудочно-сальниковой и правой желудочной венами на передней поверхности pylorus носит название пилорической вены, которую при оперативных вмешательствах принимают за ориентир границы между привратником и двенадцатиперстной кишкой.
Левая желудочно-сальниковая вена, v. gastroepiploica sinistra, проходит между листками большого сальника, отступя на 0,5–3,5 см от нижнего края желудка, идет к воротам селезенки и впадает в селезеночную вену.
Короткие вены желудка, vv. gastricae breves, соответствуют одноименным артериям и впадают в селезеночную вену.
Лимфатическая система желудка также подразделяется на внутриорганную (сети лимфатических капилляров и сосудов по слоям стенки желудка) и экстраорганную (отводящие лимфатические сосуды, несущие лимфу в регионарные узлы).
Внутриорганные лимфатические сосуды находятся во всех слоях стенки желудка и подразделяются на капиллярные сети слизистой оболочки, подслизистого слоя, мышечной и серозной оболочек. Перечисленные сети соединены в единое целое многочисленными лимфатическими анастомозами и образуют отводящие лимфу сосуды.
Экстраорганные лимфатические сосуды малой кривизны и прилегающих отделов кардии и тела идут по ходу желудочных кровеносных сосудов к регионарным лимфатическим узлам первого порядка, расположенным в малом сальнике. Из этих узлов выносящие сосуды следуют к узлам второго порядка, расположенным у чревного ствола.
Лимфатические сосуды большой кривизны идут по ходу желудочно-сальниковых и коротких желудочных кровеносных сосудов к регионарным лимфатическим узлам первого порядка области ворот селезенки, тела и хвоста поджелудочной железы, в подпилорические и верхнебрыжеечные узлы.
Чревные лимфатические узлы, nodi lymphatici coeliaci, в количестве 1–3, расположенные непосредственно у чревного ствола, являются основными регионарными узлами второго порядка для желудка, печени, поджелудочной железы, ворот селезенки и двенадцатиперстной кишки. Из чревных узлов лимфа оттекает в аортальные и кавальные лимфатические узлы.
При резекции желудка, производимой по поводу рака, обязательно удаление лимфатических узлов первого и второго порядка, собирающих лимфу из области локализации опухоли.
Иннервация желудка осуществляется ветвями переднего и заднего блуждающих стволов, чревного сплетения и его производных; верхнего и нижнего желудочных, печеночного, селезеночного и верхнего брыжеечного сплетений.
Передний (левый) блуждающий ствол, располагаясь на передней поверхности брюшного отдела пищевода, при подходе к желудку распадается на ветви, идущие к передней поверхности желудка. Он отдает 3–6 ветвей к пищеводу, кардиальному отделу желудка, ко дну, посылает 1–3 ветви между листками малого сальника к печени, а остальная часть левого ствола следует вдоль переднего края малой кривизны желудка и распадается на многочисленные желудочные ветви. Самая длинная ветвь его, идущая к пилороантральному отделу желудка, получила название ветвь Латарже (левая).
Задний (правый) блуждающий ствол лежит между задней поверхностью пищевода и брюшной аортой. В области кардии он также распадается на ряд ветвей, идущих к пищеводу, к задней поверхности дна и тела желудка. Самая крупная ветвь его идет в lig. gastropancreaticum sinistrum слева от a. gastrica sinistra к чревному сплетению, а самая длинная (правая ветвь Латарже) – к задней поверхности пилороантрального отдела желудка.
Ветви обоих блуждающих стволов в области кардиального отдела в малой кривизны желудка имеют многочисленные связи. Кроме того, к желудку подходят также нервы диафрагмально-брюшных ветвей, rr. phrenicoabdominales, через чревное сплетение.
Наличием широких связей афферентных нервов желудка с нервами окружающих соседних органов брюшной полости (печень, двенадцатиперстная кишка, поджелудочная железа и др.) объясняются сходная иррадиация болей при заболевании этих органов, а также нарушение функции одного органа при поражении другого.
Рак желудка
Рак желудка остается одним из самых распространенных заболеваний в мире. Ежегодно регистрируется почти 800 тысяч новых случаев и 628 тысяч смертей от этого заболевания. Странами – «лидерами» являются Япония, Россия, Чили, Корея, Китай (40% всех случаев), Коста–Рика, Филиппины. Странами с низкой заболеваемостью являются США, Австралия, Новая Зеландия. В США ежегодно регистрируется 24 тысячи новых больных. В Японии, численность населения которой составляет 126 млн. и вполне сопоставима с населением России, заболеваемость у мужчин составляет 77,9 и у женщин 33,3 на 100000 населения (мировой стандарт). Число вновь выявленных больных в России снизилось с 1990 года на 10 тысяч (16%) и составило 48,2 тысячи. Заболеваемость среди мужчин почти вдвое превышает заболеваемость среди женщин и составляет 32,8 на 100000 тысяч населения (44,5 в 1990 году), для женщин – 14,3 (19,6 в 1990 году). В России самый высокий показатель заболеваемости приходится на Новгородскую область и Республику Тува, минимальные показатели – в регионах Северного Кавказа, Магаданской области и Чукотском автономном округе. По уровню смертности Россия в ранжированном ряду 45 стран занимает 2 место (у мужчин) и 3 место (у женщин). В Москве в 2001 году было выявлено 2872 новых случаев. Несмотря на снижение заболеваемости за последние 10 лет показатель летальности на 1 году даже увеличился, что связано с увеличением доли больных с IV стадией и ухудшением онкологической помощи населению России. Самая высокая выживаемость в мире зарегистрирована в Японии – 53%, в других странах она не выше 15–20% (6). Доля раннего рака желудка в Японии также наивысшая и составляет половину всех случаев, тогда как в Европе, США и других странах – не более 20%. Указанные факты позволили предположить некоторым исследователям, что рак желудка у японцев является принципиально отличным от рака желудка у европейцев. Однако дальнейшие исследования в молекулярной биологии показали, что это не так, а успехам в улучшении выживаемости Япония обязана массовому скринингу населения и принятым национальным программам по борьбе с раком. В последнее десятилетие отмечен удельный рост заболеваемости раком кардиоэзофагеальной зоны и снижение заболеваемости раком антрального отдела желудка. Эта тенденция наиболее отчетлива в странах Европы, в то время как в Японии доминирующим остается рак антрального отдела желудка. Предполагается, что рак желудка дистальных отделов ассоциирован с инфекцией H. pylori, а эрадикационные схемы лечения вызывают миграцию H. pylori в проксимальном направлении, оказывая канцерогенный эффект в кардиоэзофагеальной зоне.
Инфекционный фактор
В 1926 году датчанин Johannes Andreas Grib Fibiger, директор Института патологической анатомии получил Нобелевскую премию за открытие инфекционной природы рак желудка. Ученым были проведены эксперименты по заражению мышей инфицированными тараканами, которые являются переносчиками гельминтов. Автор скармливал тараканов подопытным мышам и впоследствии у части из них наблюдал развитие опухолей желудка. Был сделан ошибочный вывод о том, что сходный механизм передачи может существовать у человека. Открытие в 1983 году Helicobacter pylori (HP) вновь заставило вспомнить предпосылки для изучения инфекционного фактора. Роль HP в этиологии язвенной болезни желудка была доказана, включение антибиотиков в схемы противоязвенной терапии было настолько успешным, что в развитых странах практически полностью отказались от хирургического лечения язвенной болезни. Инфицированность HP происходит в детском возрасте, коррелирует с возрастом и выше среди развивающихся стран. Возможно реинфицирование после успешной эрадикации. За последнее десятилетие проведено множество работ по изучению инфицированности населения, однако отсутствие четких критериев исследования, разные методы (дыхательный тест, наличие антител в сыворотке крови, гастроскопия с биопсией слизистой желудка) обусловливают широкий разброс в показателях инфицированности. Тем не менее, мета–анализ 10 проспективных когортных исследований, где изучались образцы крови, взятые у здоровых людей, у которых впоследствии развился рак желудка, и контрольной группы, которая также представляла членов когорты. Выявил, что у инфицированных статистически достоверно повышен риск развития рака желудка (относительный риск равен 2,5). Ассоциация наиболее выражена для рака дистального отдела желудка. Международным Агентством по изучению рака HP признан канцерогеном первого порядка, то есть связь с развитием РЖ считается доказанной. В связи с этим представляются логичными рекомендации по проведению антигеликобактерной терапии у пациентов, перенесших резекции желудка по поводу рака желудка с целью санации оставшейся части желудка. Несмотря на, казалось бы, убедительные данные об этиологической роли HP, существуют и аргументы «против». В северной Нигерии есть районы, эндемичные по заболеванию HP, однако РЖ развивается редко. Кроме того, миллионы людей являются носителями инфекции, и на протяжении всей жизни у них не развивается РЖ. Инфицированность среди мужчин и женщин одинакова, однако мужчины болеют РЖ почти в 2 раза чаще. У небольшой части людей инфицированных развивается лимфома желудка. Включение антибиотиков против HP в схемы химиотерапии лимфом желудка повышает эффективность лечения, что также подтверждает связь инфицированности HP с этим редким заболеванием. Точные механизмы повреждающего действия HP на слизистую желудка изучаются. Длительность воздействия HP (более 20 лет), влияние других факторов (характер питания, употребление спиртных напитков, курение) оказывают усиливающий эффект. Большинство исследователей считают, что HP вызывает РЖ не непосредственно, а через развитие гастрита, развитие кишечной метаплазии, дисплазии и т.д. Почему у одних носителей инфекции развивается РЖ, а у других – лимфома желудка, остается неясным.
Другим инфекционным агентом, обнаруженном при РЖ, является вирус Эпштейна–Барр (EBV). EBV инфицированы более 90% населения. Веским доказательством патогенетической роли EBV в возникновении определенных морфологических форм РЖ стало обнаружение вирусных маркеров (m РНК EBER-1) в 80–100% опухолевых клеток этих больных, а также демонстрация моноклональной интеграции генома в клетках опухоли. В Японии EBV-ассоциированная форма РЖ встречается в 7%, в США в 16%, в России в 9% случаев. Хотя EBV-позитивные случаи выявлялись среди разных гистологических типов РЖ, самый высокий процент таких опухолей обнаружен при недифференцированном раке. Значительно чаще EBV+ раки встречаются в кардии. Рабочая группа Международного Агентства по изучению рака пришла к заключению, что имеется достаточно данных для подтверждения роли EBV в этиологии лимфомы Беркита, рака носоглотки, лимфогранулематоза, синоназальной ангиоцентрической Т–клеточной лимфомы, лимфомы у больных с иммунодефицитом. Однако данных для подтверждения связи EBV и рака желудка недостаточно.
Генетические факторы
Роль генетического фактора в развитии РЖ была заподозрена в связи с тем, что у лиц с группой крови A(II) заболеваемость выше на 20%, чем у лиц с группой O(I) и B(III). Основной вклад в исследование генетического фактора внес анализ наследственного РЖ. В случаях семейного РЖ выявлен мутантный ген Е–кадхерин (CDH-1). Наследственные и спорадические опухоли желудочно–кишечного тракта довольно часто ассоциированы с мутациями в генах Е–кадхерина, b-катенина или гена полипоза толстой кишки. Е–кадхерин является представителем семейства трансмембранных гликопротеинов, осуществляющих адгезионные межклеточные контакты типа «зона слипания» (zona adhaerence). Мутации Е–кадхерина также наблюдаются при ненаследственных формах рака молочной железы, яичника и ряда других новообразований, причем нарушение его экспрессии иили локализации в клетке коррелирует с приобретением инвазивного типа. Кроме того, Е–кадхерин, по–видимому, влияет на регуляцию р53. Продемонстрировано, что мутации Е–кадхерина и разобщение межклеточных контактов вызывают уменьшение экспрессии и функциональной активности р53. Наглядным примером внедрения генодиагностики в клиническую практику могут служить случаи гастрэктомий в семьях у родственников больных РЖ, носителей мутантного гена Е–кадхерина. Несмотря на отрицательные данные гастробиопсий в подавляющем большинстве случаев в удаленных образцах находили перстневидноклеточный рак. Таким образом, «профилактические» гастрэктомии являлись по сути «лечебными».
Патогенез
В 1965 году Lauren описал два гистологических подтипа рака желудка, интестинальный и диффузный. Интестинальный тип чаще встречается преимущественно у пожилых лиц и поражает дистальные отделы желудка. В возникновении этого гистологического подтипа рака желудка большую роль играет метаплазия являющаяся исходом хронического воспаления обусловленного экзогенными факторами. Результаты исследований проведенных в Швеции и Испании свидетельствуют о роли нитратов и нитритов в этиологии рака желудка. Однако вместе с тем нет убедительных данных о том, что именно использование холодильных устройств для хранения пищи вместо её копчения, засаливания или вяления, привело к снижению частоты интестинального типа рака желудка в течение последних 50-ти лет. Международный Фонд по изучению рака привел убедительные данные, свидетельствующие о снижении заболеваемости при увеличении употребления фруктов. Однако исследование, проведенное в Швеции, показало, что в популяции, состоящей из 25 000 человек, употребление в пищу большего количества фруктов предотвратит развитие рака пищевода у 1 человека в год, и совсем не влияет на частоту возникновения рака кардии.
Патогенез рака желудка сложен и во многом не изучен. При дифференцированных формах рака желудка основные генетические нарушения обнаружены в изменении экспрессии следующих генов: p53 (40%), k–ras (10%), c–erb B2 (20%), c–met (11%), APC, E–cadherin. При низкодифференцированных аденокарциномах – k–sam, E–cadherin. Надо признать, что по мере открытия новых онкогенов представленный список будет непрерывно пополняться и будет отражать разные стадии развития опухолевой клетки. Большинство исследователей признают, что гистогенез рака желудка может развиваться по двум направлениям. Первый путь схематично можно представить следующим образом. Длительное воздействие (более 20 лет) на нормальную слизистую факторов окружающей среды, питания, и прежде всего Helicobacter pylori, приводит к атрофическому гастриту. Атрофический гастрит либо через кишечную метаплазию, дисплазию / аденому, дифференцированную карциному, либо через неметапластическую атрофию слизистой и низкодифференцированную аденокарциному приводит к инвазивному раку и метастазированию. Данный тип гистогенеза чаще наблюдается у пожилых и не связан с наследственным фактором. Второй тип гистогенеза предполагает наличие мультипотентной пролиферативной клетки шеечной зоны. Мультипотентная пролиферативная клетка развивается либо в карциноид, либо через дифференцированную аденокарциному в ряд злокачественных новообразований: муцинозная («слизистая») аденокарцинома, низкодифференцированная аденокарцинома, перстневидноклеточный рак, эндокриноклеточная карцинома, AFP (a-фетопродуцирующий) рак. Данный тип гистогенеза чаще развивается без предшествующего гастрита у молодых пациентов. Иммунофенотипические изменения, прежде всего заключаются в снижении экспрессии молекул главного комплекса гистосовместимости HLA–I и HLA–II класса, в изменении экспрессии рецептора трансферрина (CD71), молекул адгезии ICAM (CD54). Особо надо отметить изучение экспрессии карбогидратных (углеводных) антигенов на клетках РЖ, таких как Lewis–x, Lewis–a, Lewis–y, Lewis–b, Lewis–Tn и их сиалированных форм (sialyl–Lewis), как фактора более злокачественного течения рака желудка. Так, было показано, что сиалированные формы Lewis – антигенов участвуют в метастатическом процессе посредством связывания с E и Р–селектинами эндотелия сосудов, мезотелия брюшины. Имеются данные об участии карбогидратных антигенов в прокаогулянтной активности (Lewis–y), апоптозе, клеточно–матриксном взаимодействии. Показано прогностическое значение экспрессии Lewis-антигенов при I, II, III стадии рака желудка японскими исследователями.
Фоновые и предраковые заболевания желудка
В большинстве случаев рак желудка развивается на фоне длительно существующих предопухолевых состояний слизистой. Термин «предраковые» означает морфологически подтвержденное замещение нормальной слизистой на диспластическую. Термин «фоновые» можно трактовать как сумму клинических, биологических, анатомических условий, при которых риск развития РЖ повышен. Фоновые и предраковые заболевания не обязательно приводят к раку. Показано обратное развитие HP-ассоциированных гастритов на фоне антибактериальной терапии и снижение риска РЖ у пролеченных больных. Выделяют три степени дисплазии (слабую, умеренную и тяжелую). Более того, в 2000 году на международной согласительной конференции японских, американских и европейских ученых была предложена схема ранних изменений в слизистой желудка, включающая 5 диагностических категорий: норма; подозрение на дисплазию; неинвазивная дисплазия; подозрение на инвазивный рак; рак. Увеличение критериев вряд ли можно назвать «согласительной» тенденцией. Оценка микроскопической картины является в достаточной степени субъективной и зависит от ряда причин. Одной, из которых является, в частности, «школа» страны и принятые в ней критерии. Широко известны факты, когда японские морфологи гораздо чаше ставили диагноз «рак» в то время, когда европейские исследователи останавливались на «дисплазии умеренной» или «тяжелой». Некоторыми учеными данный факт признается основной причиной большого количества «ранних» РЖ в Японии и, соответственно, гораздо более высокой 5-тилетней выживаемостью. Фоновыми заболеваниями считаются: хронический атрофический гиперпластический гастрит, аденоматозные полипы, пернициозная анемия, состояния после резекции желудка, болезнь Менетрие (гипертрофическая гастропатия, гиперпластический гигантоскладочный гастрит). Ранее в учебниках часто указывалось, что длительно текущие хронические язвы желудка являются предраковыми заболеваниями. В настоящее время большинством исследователей признается, что «малигнизированная язва» – это первичный, своевременно не установленный рак. ВОЗ исключил язвенную болезнь желудка из списка фоновых предраковых заболеваний желудка. Данный факт совсем не означает, что больные с язвой желудка не должны быть под пристальным вниманием терапевтов. Наоборот, регулярные гастроскопии с биопсией не только краев язвы, но и других участков слизистой, должны быть обязательными. Диагностика гастрита включает не только клиническую картину, но и морфологическое подтверждение биопсией. Рекомендуется 6 точек, из которых следует брать биопсию (Yokohama Recommendation at the 10th Asian Pacific Congress of Gastroenterology, Yokohama, 1996):
1. Середина антрального отдела по малой кривизне.
2. Угол желудка.
3. Середина тела желудка по малой кривизне (посередине между углом и кардией).
4. Середина антрального отдела по большой кривизне.
5. Точка напротив угла желудка (по большой кривизне в области антрального отдела).
6. Середина тела по большой кривизне (точка посередине между входом в антральный отдел и дном).
Развитие хронического атрофического гастрита, ассоциированного с H. pylori, чаще развивается с антрального отдела и с течением времени «граница» его поднимается вверх. Наибольшему риску развития РЖ подвержены пациенты, заболевшие атрофическим гастритом в молодом возрасте. Самой частой и трагической ошибкой, встречающейся в клинической практике, является привыкание как пациента, так и лечащего врача к, казалось бы, безобидному диагнозу «гастрит». Со временем пациенты перестают обращаться к врачу, отказываются от ежегодной гастроскопии, принимают медикаменты «от боли в желудке», широко рекламируемые по телевидению. Появление новых симтомов или нарастание привычных расценивается пациентами и врачами, как обострение, назначается диета и т.д.
Аденоматозные полипы имеют повышенный риск малигнизации. Считается, что аденоматозные полипы, размеры которых превышают 2 см, малигнизируются в 50% случаев. Малигнизация гиперпластических полипов не превышает 0,5%. Необходимо помнить, что наличие аденоматозных полипов в желудке является одним из проявлений фамильного аденоматозного полипоза, в таких случаях требуется колоноскопия. Соответственно, при обнаружении полипов в толстой кишке необходимо проведение эзофагогастродуоденоскопии.
При сочетании пернициозной анемии и атрофического гастрита риск развития РЖ повышается до 10%. Патогенез пернициозной анемии заключается в продукции антител против клеток протонной помпы, клеток, продуцирующих пепсиноген и внутренний фактор Касла. При присоединившейся инфекции HP слизистая желудка страдает в еще большей мере, чем в обычных условиях и диспластические изменения развиваются быстрее.
Риск развития РЖ в резецированном желудке повышается в 3–4 раза. Наиболее повышен риск через 15–25 лет после операции, если речь идет об операциях по поводу язвенной болезни (эти сроки обычно меньше, если речь идет о резекциях по поводу РЖ). Считается, что желчные кислоты, забрасывающиеся в оставшуюся часть желудка, обладают канцерогенным эффектом, вызывая замещение слизистой желудка на слизистую кишечного типа. Кроме того, фоновое заболевание желудка (чаще всего гастрит) в «культе» желудка остается после резекции, продолжая подвергаться предшествующим факторам (образ питания, инфицированность H. pylori и т.д.). В 70–80-е годы прошлого столетия, в «догеликобактерную» эру, основным методом лечения язвенной болезни 12-перстной кишки и желудка (особенно осложненных форм) являлось хирургическое лечение – резекция желудка. В наши дни подошла, по–видимому, последняя «волна» пациентов, леченных оперативно по поводу язвенной болезни.
Болезнь Менетрие является редким заболеванием и характеризуется наличием гипертрофических складок слизистой, напоминающей извилины мозга, снижением кислотопродуцирующей функцией, энтеропатией с потерей белка. Само по себе заболевание является редким, с неизвестной этиологией и лечится симптоматически. Предполагается участие в этиопатогенезе HP. Риск развития РЖ у больных с болезнью Менетрие считается повышенным.
Клиническая картина
Клиническая картина, казалось бы, описана детально во многих руководствах и учебниках по онкологии. Проблема состоит в том, клиническая картина раннего РЖ скудна и симптомы не являются патогномоничными. Ранним раком называется опухоль, локализующаяся в слизистой (m, mucosa) и подслизистой основе (sm, submucosa), независимо от наличия отдаленных метастазов или метастазов в регионарные лимфоузлы. Синдром «малых признаков», описанный А.И. Савицким и включающий немотивированную слабость, утомляемость, отвращение к мясной пище, анемию, похудание, «желудочный дискомфорт», больше характерен для больных с распространенными формами РЖ. Признаками запущенности болезни являются доступные осмотру и пальпации метастазы следующей локализации:
1) метастаз Вирхова – в надкл