Молекулярные механизмы передачи импульса в мембранах нейронов. Ионные каналы, рецепторы
Молекулярные механизмы передачи импульса в мембранах нейронов. Ионные каналы, рецепторы
1. БИОЭЛЕКТРИЧЕСКИЕ ЯВЛЕНИЯ В НЕРВНЫХ КЛЕТКАХ
На каждом этапе рассмотрения биохимии нервной системы приходится вновь обращать внимание читателя на то обстоятельство, что нейроны способны выполнять свои функции только благодаря особым свойствам их наружной мембраны. Мембрана нейрона имеет специальные молекулярные устройства, которые позволяют ей генерировать, проводить и воспринимать нервный импульс, практически мгновенно изменять ионную проницаемость и создавать за счет этого трансмембранный ионный ток. Этот комплекс молекулярных событий приводит к направленному распространению нервного импульса по аксону на очень большие расстояния.
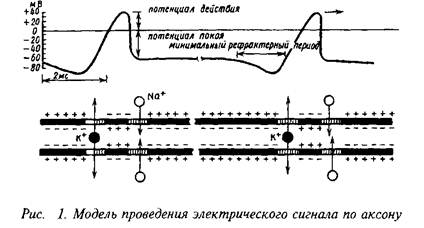
Способность к проведению нервного импульса в аксонах обусловлена, с одной стороны, наличием в его мембранах специфических белковых комплексов, которые представляют собой ионные каналы, управляемые электрическими потенциалами, с другой стороны, наличием белковых структур, поддерживающих ионные градиенты в мембранах, — так называемых ионных насосов.
Насосы расходуют метаболическую энергию для перемещения ионов против концентрационных градиентов между вне- и внутриклеточной средой. Особенно важны различия в концентрациях ионов Na, К и Са. Наружная среда приблизительно в десять раз богаче ионами Na, чем внутренняя > а внутренняя среда в десятки раз богаче ионами К, чем наружная. Внеклеточные концентрации Са+ в сотни-тысячи раз выше внутриклеточных.
Ионы Na и К могут медленно проникать через поры в клеточной мембране по градиенту, поэтому ионные насосы непрерывно производят обмен вошедших в клетку ионов натрия на ионы калия из внешней среды, такое откачивание ионов натрия осуществляется внутренним мембранным белком — Na+, К+-АТФазой или Na-насосом. Существуют и другие типы ионных насосов, преимущественно называемых по типу ионов, которые они транспортируют, например Са-насосы, К-насосы и т.д..
Модель генерации нервного импульса, созданная А. Ходжкиным и А. Хаксли применительно к аксону, описывает проведение электрического сигнала путем изменения проницаемости для ионов натрия и калия. Эта модель, ставшая классической, принесла авторам известность и Нобелевскую премию в 1956 г. Основная идея модели генерации нервного импульса сводится к следующему: механизмы ионной проницаемости натрия и калия работают независимо друг от друга и описываются с помощью констант скоростей реакции, зависящих от единственной переменной — мембранного потенциала. С помощью экспериментальных подходов эта теоретическая модель была успешно подтверждена.
Поскольку концентрация ионов натрия и калия по ту и другую сторону мембраны различаются, внутренняя область аксона имеет значительный отрицательный потенциал по отношению к наружной среде. Когда нервный импульс возникает в основании аксона, трансмембранная разность потенциалов в этом месте локально понижается. Это ведет к тому, что непосредственно за этой зоной с измененным потенциалом вдоль аксона открываются ионные каналы для входа ионов Na. Процесс является самоусиливающимся: поток ионов натрия через мембрану приводит к открыванию все большего числа ионных каналов. Затем натриевые каналы закрываются, но вслед за этим открывается другая группа каналов — для ионов К, которые выходят наружу. Этот поток восстанавливает потенциал внутри аксона до потенциала покоя. Резкий скачок потенциала или электрический "спайк" называется потенциалом действия и является электрическим выражением нервного импульса.
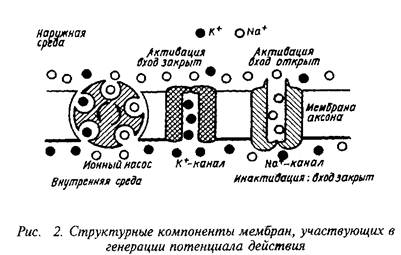
Итак, возникновение быстрых импульсных сигналов связано с работой ионных каналов. Ионные каналы — это макромо-лекулярные комплексы, которые образуют сквозные гидрофильные поры в липидном матриксе и способны регулировать транспорт ионов через мембрану клетки. Другими словами, ионные каналы представляют собой ионселективный фильтр, способный избирательно регулировать проницаемость клетки для ионов. Так, работа одного ионного канала способна изменять ионные токи от 2 до 10 рА, что соответствует транспорту от 12 до 60x10 моновалентных катионов в секунду. Такая величина обменного процесса ионов в клетке превосходит во много раз известные до сих пор ферментные или транспортные механизмы и хорошо согласуется с теоретическими расчетами, сделанными для модельной поры.
Ионные каналы имеют два фундаментальных свойства: они способны избирательно пропускать ионы и имеют механизм контроля за скоростью перемещения ионов — воротные токи. Однако избирательность каналов для определенных ионов не является абсолютной, так как они могут в определенной степени пропускать и "чужие" ионы, сходные по заряду или размерам.
Механизм селективности ионных каналов определяется взаимодействием между ионами и специфическим структурным участком канала, его воротами. Воротные механизмы, регулирующие открывание и закрывание мембранных каналов, представлены двумя типами. Существуют каналы, которые открываются и закрываются в ответ на изменения потенциалов, т.е. управляются электрически. Второй тип воротного механизма связан с работой ионных каналов, открываемых в ответ на химический сигнал, т.е. управляемых химически.
Деполяризация, связанная с потенциалом действия, распространяется вдоль аксона как волна электрической активности. Главное преимущество электрического проведения импульса по аксону состоит в том, что возбуждение быстро распространяется на большие расстояния без какого-либо ослабления сигнала. Для возникновения серии нервных импульсов необходимо сложное взаимодействие разных ионных каналов, включая электроуправляемые и хемоуправляемые ионные каналы. Все нервные импульсы имеют практически одинаковую амплитуду; кодирование информации на этом уровне происходит за счет разной частоты, генерируемой в единицу времени. В общем, чем сильнее сигнал, тем выше частота разрядов.
2. Na-КАНАЛЫ
Потенциал-зависимые Na-каналы — обязательный элемент внешней мембраны нейронов. В последние годы благодаря обнаружению специфических блокаторов электровозбудимых натриевых каналов удалось раскрыть молекулярную структуру каналов и, в частности, выделить составляющий их белок в индивидуальном виде.
Одним из хорошо исследованных блокаторов Na-каналов является тетродотокснн, который необратимо связывается с белком канала и позволяет его маркировать для последующей очистки. Наибольших успехов в исследовании функции и структурной организации натриевых каналов добились японские исследователи Р. Нума и др. Они показали, что этот мембранный белок представляет собой гликопротеид сМг = 250-300 кД, состоящий из нескольких субъединиц, которые образуют на внутренней поверхности гидрофильную трубчатую структуру, при денатурации в восстановительных условиях белок диссоциирует на два основных компонента, которые специфически связывают Н-тетродотоксин в присутствии фосфолипидов. Диаметр поры этого канала колеблется в пределах 0,4-0,6 нм. Через такую пору могут проходить ионы натрия, связанные с молекулами воды. Избирательность для ионов Na существует, но не является абсолютной.
ТТХ-связывающие белки выделены из различных объектов: головного мозга, клеток нейробластомы, нейронов моллюсков, аксонов кальмара и др. С помощью моно- и поликлональных антител «показано наличие общих антигенных детерминант у белков каналов, выделенных с помощью тетродотоксина. Иммунохимические данные наряду с результатами ограниченного протеолиза и химической модификации молекул свидетельствуют в пользу трансмембранной модели потенциал-независимого натриевого канала. Доступность некоторых участков белка для иммуноглобулинов в липидных мембранах или липосомах подтверждает гипотезу о значительных конформационных перестройках молекулы натриевого канала под действием электрического поля.
В настоящее время установлена полная первичная последовательность ТТХ-чувствительных белков и структура гена, кодирующего синтез в нервной клетке Na-каналов.
Изменение конформационного состояния структурных компонентов ионного канала тесно связано с процессами фосфо-рилирования а- и р-пептидных субъединиц. Обнаружено, что Na-каналы мозга млекопитающих содержат одну а-субъедини-цу, ассоциированную с двумя полипептидами: pj и р2. Установлено, чтоа-субъединица является трансмембранным белком, имеющим участки связывания ряда нейротропных веществ на внешней поверхности мембран, и участки связывания для фосфорилирования цАМФ-зависи-мой протеинкиназой. Оказалось, что этого единственного а-полипептида вполне хватает, чтобы сформировать ионный канал, но не достаточно для выполнения его функций.
Функционированию ионного канала способствуют Рр и р2-субъединицы, которые размещены в основном на внешней поверхности мембран и ковалентно связаны с а-субъединицей через дисульфидную связь. Эти р-субъединицы сильно гликозилиро-ваны, приблизительно 30% их массы составляют карбогидраты, большая часть которых приходится на сиаловую кислоту. Последняя и придает ионному белковому комплексу сильный отрицательный заряд, который и позволяет полноценно функционировать каналу. С другой стороны, эти карбогидраты необходимы ддя нормального биосинтеза и точной сборки функционального канала в нейронах. Показано, что если гликозилирование ингибировано, то новый синтез а-субъединицы быстро останавливается, и она не включается в клеточную поверхность мембраны.
Процесс открывания Na-каналов под влиянием изменения потенциала мембраны — активация натриевых каналов — один из наиболее ярких примеров конформационных перестроек белков под влиянием электрического поля. Открывание каждого канала совершается по известному принципу — "все или ничего". Этот процесс может быть остановлен инактивацией, которая опять-таки связана с переходом белков канала в другое конформационое состояние. Полный цикл активации и инактивации охватывает десятки тысяч натриевых каналов.
3. К-КАНАЛЫ
Потенциал-зависимые калиевые каналы так же, как и натриевые, распространены повсеместно в наружных мембранах нервных клеток и играют столь же важную роль в передаче скоростных сигналов. В отличие от ионов натрия, которые вызывают локальную деполяризацию мембраны и генерирование потенциала действия, калиевые каналы приводят к гиперполяризации нейрона и появлению тормозных потенциалов. Система быстрых калиевых каналов играет большую роль в стабилизации ритмической деятельности нейрона, которая является основным способом кодирования и передачи клеткой химических сигналов. Характерной чертой участия калиевых каналов в ритмической активности является резкое замедление нарастания деполяризации мембраны, вызванной предшествующим входом ионов Na.
Калиевые каналы являются более избирательными для ионов: они не пропускают практически ионы Na, проницаемость для ионов Rb, NH4+ сравнительно мала. Полагают, что селективный фильтр калиевого канала имеет размеры порядка 0,26-0,3 нм. Ионы большего размера не проходят через канал по стерическим причинам, ионы меньшего диаметра — в связи с тем, что они не могут успешно взаимодействовать с кислородо-содержащими анионами, находящимися в боковых цепях гидрофильных аминокислот, которые выстилают внутреннюю белковую пору.
Калиевые каналы подразделяются на три подтипа в зависимости от скорости проведения: быстрые, средние и медленные. Первые два подтипа каналов являются зависимыми от ионов Са и блокируются токсином скорпиона, в то время как третий вид калиевого канала блокируется одним из токсинов ада кобры и пчелы — апамином.
Структура К-каналов в принципе сходна со структурой Na-каналов. На основании данных радиационной инактивации замороженных мембран были определены молекулярные массы для целого олигомерного комплекса — от 165 до 400 кД в зависимости от типа клетки. Обнаружено, что у разных организмов сочетание полипептидных компонентов, составляющих макромолекулу ионофора, существенно различается. В отличие от белков других каналов белки калиевых каналов практически не гликозилированы.
Недавно были проведены работы по выделению генов, кодирующих синтез калиевых канальных полипептидов. Специфическая мРНК, выделенная из мозга крыс, была инъецирована в ооциты лягушки. Показано, что в этом случае регистрируются "новые" калиевые каналы. Найдена высокая степень го-мол огичности между нуклеотидными последовательностями, кодирующими синтез калиевых каналов в разных клетках. Особенно это касалось гидрофобных доменов, которые оказались наиболее консервативными в эволюции.
4. Са-КАНАЛЫ
Транспорт Са+ через кальциевые каналы жизненно важен для разнообразных клеточных функций, особенно в нервной ткани. Электровозбудимые кальциевые каналы изучены преимущественно на нейронах моллюсков. Сейчас становится очевидным, что у высших позвоночных они мало отличаются по физико-химическим характеристикам.
Специфичность кальциевых каналов не очень высока, они способны пропускать из наружной среды Na+ и ионы других щелочных металлов, если концентрация Са+ в наружной среде находится ниже микромолекулярного уровня. Кальциевые каналы пропускают также катионы других двухвалентных металлов, например Mg+ и Мп+. Однако эти катионы легко связываются внешней химической группировкой канала и становятся при определенных концентрациях эффективными блокаторами кальциевого канала. Полагают, что эта группировка является карбоксильной группой, находящейся в устье канала.
Общая схема молекулярной организации кальциевых каналов сходна с описанной выше для Na-каналов. Однако главная а-субъединица окружена большим числом субъединиц, служащих модуляторами активности канала. Пока не ясно, какие химические группировки ответственны за трансмембранный перенос кальция, понятно только, что он - существенно зависит от внутриклеточной концентрации Са+ и функционирования системы циклических нуклеотидов.
Несмотря на то, что численность кальциевых каналов значительно меньше, чем натриевых и калиевых ион-транспортных систем, при определенных условиях они могут самостоятельно вызывать деполяризацию нейрона. Однако сейчас очевидно, что главная функция кальциевых каналов состоит в сопряжении электровозбудимости с внутриклеточными процессами. Эта функция кальциевых каналов особенно важна для включения механизма выхода нейромедиатора из нервного окончания.
5. СИСТЕМЫ АКТИВНОГО ТРАНСПОРТА ИОНОВ. Na+/K+ И Na+/Ca+ - НАСОСЫ
Как уже упоминалось, электрическое возбуждение в нервной ткани существенно зависит от механизмов пассивного и активного мембранного транспорта, контролирующего концентрации ионов и молекул внутри клеток и нередко в межклеточном пространстве. Аксоны обладают большим резервом Кононов и дефицитом Na+-noHOB. Миграции ионов, обеспечивающие прохождение импульсов и создающие изменения потенциала мембраны, быстро компенсируются этими резервами. "Выносливость" аксона очень велика — утомление наступает лишь после прохождения 10 — 10 импульсов, тем не менее перемещения ионов при прохождении импульса должны быть компенсированы в стадии покоя. Кроме того, мембрана в стадии покоя не является абсолютным барьером для перемещений ионов и постепенного уменьшения потенциала.
Ряд внутриклеточных процессов требует постоянной регуляции за счет активных ионных потоков через -мембрану. Наконец, особенно велики нарушения градиентов ионных концентраций при функционировании синапсов. Для компенсации всех этих нарушений градиентов служат ионные насосы.
Основной транспортной системой в нейронах, как и в большинстве других эукариотических клеток, является насос, который вытесняет Na+ и постоянно накапливает К+. Этот процесс требует присутствия АТФ и специфически ингибируется кардиоактивными гликозидами типа оуабаина.
Na+, К+-активируемая аденозинтрифосфотяза, или АТФ-фосфогидролаза К.Ф.3.6Л плазматических мембран нервных клеток осуществляет трансмембранный перенос одновалентных катионов против градиентов их электрохимических потенциалов, используя энергию гидролиза АТФ. Работая с максимальной скоростью, этот ферментативный комплекс способен транспортировать через мембрану около 200 ионов Na и 130 ионов К в 1с. Однако фактическая скорость работы фермента определяется потребностями клетки. У большинства нейронов на поверхностной мембране расположено до 200 натриевых насосов на квадратный микрон, причем в некоторых участках этой поверхности их плотность в 10 раз выше.
Молекула фермента состоит из каталитической а-субъединицы и $-гликопротеида, функциональная роль которого до сих пор неизвестна. Молекулярная масса комплекса белковых субъединиц Na+, К+-АТФазы составляет около 275 000, и размеры фермента колеблются в пределах 6-8 нм. Кроме полипептвдов Na+, К+-АТФаза содержит 3 углеводные цепи, которые присоединены к р-субъединице гликозидными связями. Одновременное использование методов генной инженерии и химии белка привело к установлению первичной структуры Na+, К+-АТФазы. С помощью моноклональных антител установлено внутри- и внеклеточное расположение некоторых участков а- и р-субъединиц. Предложена модель полипептидной цепи фермента, согласно которой сс-субъединица 7 раз пересекает бислойную мембрану и локализована главным образом в цитоплазме. свидетельствует в пользу того, что существуют общие функциональные и структурные взаимодействия между Na+, К+-АТФазой и ионными каналами для транспорта К+.
Сходным с Na+, К+-АТФазой является другой ионный насос — Ка+/Са+-АТФаза. Она производит обмен каждого иона Са+ на 3 иона Na+. Значение этой системы особенно велико в нервных окончаниях, где система медиаторов связана с вхождением Са+ в терминаль и необходимостью компенсировать далее эти смещения градиента. Кроме того, ряд событий в постсинапти-ческой зоне тоже сопряжен с временным вхождением Са+.
6. МОЛЕКУЛЯРНЫЕ ОСНОВЫ СИНАПТИЧЕСКОЙ ПЕРЕДАЧИ, РЕЦЕПТОРЫ
Нейрон способен иметь до нескольких десятков тысяч межклеточных контактов, большинство из которых обеспечивается определенными морфологическими структурами — синапсами. Клеточную поверхность нейронов можно рассматривать как приемник разнообразнейших сигналов.
Чем выше степень эволюционной организации нервной системы, тем разнообразнее природа химических синапсов. Особенно это касается головного мозга высших млекопитающих, включая человека. Очевидно, химические синапсы оказались эволюционно более выгодными для передачи дискретных сигналов по сравнению с другими типами межклеточных контактов, поскольку на их 'основе возможна не только передача сигнала, ко и его разнообразная модуляция, в том числе гуморальными факторами. Основой восприятия нейроном химического сигнала в синапсе, а также ряда модулирующих влияний являются рецепторы.
Рецепторы представляют собой надмолекулярные образования, состоящие из белков, а также гликолипидных компонентов. Они способны под действием медиатора либо нашэсредственно изменять потоки ионов через мембрану, либо индуцировать образование вторичш>тх мессенджеров, которые, в свою очередь, меняют ряд свойста лейрона.
Межнейрональные химические синапсы подразделяются на два типа: возбуждающие и тормозные, причем.первые, как известно, способствуют генерации новых импульсов, а вторые приводят к снятию действия приходящих сигналов. Это деление определяется в значительной мере природой рецепторов. Известны случаи, когда один и тот же медиатор оказывает возбуждающее или тормозное действие в зависимости от природы рецептора.
В зависимости от места положения синапсов их можно подразделить на сомато-аксональные, дентрито-аксональные, ден-трит-дентритные и др. Каждый из этих синапсов имеет свои особенности в функционировании. Схематически структура синапса может быть представлена следующим образом.
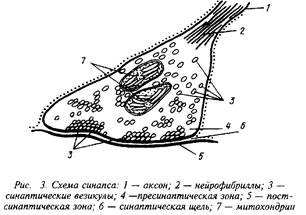
На рисунке хорошо видны утолщения, составляющие пре-синаптическую мембрану подходящего аксона, синаптическая щель и постсинаптическая мембрана. В пресинаптическом окончании находятся синаптические везикулы — хранилища запасов нейромедиатора в пресинаптическом нейроне. Постсинаптическая мембрана является носителем рецепторов. В ряде случаев сами рецепторы могут быть визуализированы при посредстве электронной микроскопии.
При распространении нервного импульса происходит деполяризация пресинаптической мембраны я изменение ионных токов. Наиболее важным событием в нервном окончании является мобилизация ионов Са, которые вызывают миграцию и открывание многочисленных синаптических везикул. Эти везикулы непосредственно связываются с участками пресинапса и открытие их приводит к высвобождению нейромедиатора и диффузии его в синаптическую щель. В терминали аксона сконцентрированы и ферменты синтеза медиатора, митохондрии для энергетического обеспечения этого процесса, системы белков-транспортеров, способствующих узнаванию и обратному захвату молекул нейромедиатора. Этот последний механизм, по-видимому, существенно экономит затраты на синтез готового нейромедиатора и участвует в регуляции срока его действия.
В отличие от биохимических процессов выброса нейроме-диаторов из пресинапса, имеющих общий характер, постсинап-тическое действие нейромедиатора прекращается самыми разнообразными способами: разрушением его определенными ферментами, либо быстрым поглощением из области синапса гли-альными клетками, либо обратным захватом его в пресинаптическую терминаль. В качестве примера существования разных механизмов утилизации нейромедиаторов из синапса можно привести механизмы процессов, происходящих в холинергиче-ском, глутаматергическом и ГАМК-ергическом синапсах.
Механизм разрушения ацетилхолина преимущественно связан с работой фермента — ацетилхолинэстеразы, который располагается на постсинаптической мембране и быстро гидроли-зует медиатор после взаимодействия с рецепторами. В глутаматергическом синапсе механизм удаления нейромедиатора заключается преимущественно в поглощении L-глутамата окружающими глиальными клетками. L-глутамат превращается в глутамин с помощью фермента глутаминазы, находящейся в глиальных клетках. В ГАМК-ергическом синапсе преобладает система обратного захвата медиатора.
7. ОБЩИЕ ВОПРОСЫ НЕЙРОРЕЦЕПТИИ
В биохимии и физиологии нервной системы длительное время доминировала точка зрения, согласно которой местом активных пластических изменений нейронов является пресинапти-ческая мембрана. Были представлены многочисленные свидетельства, касающиеся сдвигов количества квантов нейромедиатора в процессе обучения, памяти, выработки условных рефлексов и др. Постсинаптическим мембранам отводилась либо пассивная роль, либо они вообще не рассматривались в качестве активных участников событий в нервных клетках. Впоследствии стало ясно, что процессы, происходящие в плазматической или синаптической мембране нейрона, являются одними из ключевых для понимания интегративных функций ткани мозга, решения проблем обеспечения эффективного взаимодействия между нервными клетками. В последние десятилетия особое внимание было обращено на изучение структурных компонентов постсинаптических мембран, в частности нейрорецепторов. Исследования тонкой структуры и функции нейрорецепторов показали их важную роль в трансформации химического сигнала в биоэлектрические потенциалы и в передаче информации на внутриклеточные реакции, которые определяют метаболизм нервной ткани.
Следует отметить, что нейрорецепторы расположены как на мембранах нейронов, так и на мембранах глиальных клеток. Однако у последних они имеются в ограниченном наборе и числе. Рецепторные системы, расположенные на глиальных элементах, отличаются от нейрональных весьма важным моментом — они не способны продуцировать ответные реакции клеток в виде оперативных единиц информации. Иными словами, они не генерируют потенциалов действия. Как правило, глиальные клетки реализуют свое действие через внутриклеточные и межклеточные трофические регуляторные реакции, участвуя в метаболизме нейронглия.
Несмотря на огромное разнообразие клеточных рецепторов на мембране нейрона, их можно подразделять на два основных класса, которые различаются по механизмам действия и скорости проведения сигналов. Существуют быстродействующие ионотропные и медленнодействующие метаботропные рецепторы скорость действия первых составляет миллисекунды, в то время как у последних они находятся в секундно-минутном диапазоне. Время действия нейрорецепторов определяется структурной организацией рецепторных компонентов.
Быстродействующие рецепторы содержат в своей структуре ионный канал, открывающийся при контакте с нейромедиатором. Медленнодействующие рецепторы представляют собой комплекс из нескольких белков, которые при воздействии нейромедиатора последовательно меняют конформацию и в конечном счете активируют синтез или выход вторичного, уже внутриклеточного, медиатора. Эти два класса рецепторов обозначают нередко как рецепторы I и II класса. Для правильного восприятия терминологии целесообразно также указать, не рассматривая пока детали, что рецепторы класса II содержат в числе белков, передающих сигнал, так называемые G-белки. Их нередко упоминают, обозначая рецепторы этого класса.
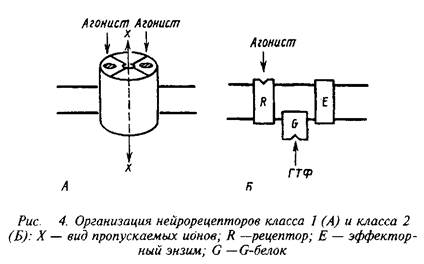
Кроме охарактеризованных выше двух классов рецепторов существуют еще три особые группы рецепторов, которые хотя и присутствуют в нервной системе, но пока представляются не связанными прямо со специфическими функциями последней. К ним относятся рецепторы, переносяшие свои лиганды через мембрану, рецепторы, обладающие собственной тирозинкиназной активностью и, наконец, своеобразная группа, которая при взаимодействии с лигандом претерпевает частичное протеолитическое расщепление. В настоящем руководстве мы не рассматриваем эти группы рецепторов.
К первому классу рецепторов принадлежат никотиновые рецепторы ацетилхолина, рецепторы ГАМКА, глицина, а также часть рецепторов глутамата и аспарагиновой кислоты. Рецепторы катехоламинов, серотонина, ГАМКВ и ряда пептидных соединений, а также мускариновые рецепторы ацетилхолина и некоторые из рецепторов глутамата относят ко второму классу. Последние типы рецепторов через систему вторичных посредников вызывают изменения в активности проте-инкиназ, способных фосфорилировать мембранные белки, включая ионные каналы.
Таблица 1
Структура, общий характер и функции рецепторов класса I
| Тип рецептора | Преимуществен -ная функция | Мг, кД | Субъединицы |
| Холинергический | Возбуждающая | 250 | а 40-50 Р 50-54 у 56-60 6 58-65 |
| ГАМКА | Тормозная | 230-260 | |
| Глутаматный | Возбуждающая | 240-400 | 90-10 |
| Глициновый | Тормозная | 246 | а 48 Р 58 |
Таблица 2
Масса белков рецепторов класса II
| Рецептор | Мг, кД |
| Ад рене р ги чески й | 58-80 |
| Глутаматер гически й | 90-110 |
| Холинергический | 85-105 |
| Дофаминовый | 72-94 |
| Опиатный | 53-65 |
| Серотониновьш | 67 |
Следует отметить, что в последние годы обнаружена группа нейрорецепторов, связь которых с ионными каналами осуществляется через G-белки, не сопряженные с перечисленными выше вторичными мессенджерами. Хотя в такую систему рецепции и не включены протеинкиназы, тем не менее участие G-белка в трансформации сигнала значительно увеличивает время действия по сравнению с нейрорецепторами класса 1.
Фундаментальным свойством всех нейрорецепторов является их лабильность и высокая скорость синтеза самого рецептора. Это свойство рецепторов конрастирует с более жесткой запрограммированностью синтеза белковых компонентов мембран, которая обычно наблюдается у других типов тканей. В нейронах развиты механизмы непрерывного синтеза рецепторов и их быстрой утилизации либо путем интернализации, либо с помощью пиноцитоза. Высокая скорость обновления нейрорецепторов обусловлена, по-видимому, необходимостью изменения "информационной емкости и "пропускной способности" нейрона. В этом случае генетический аппарат клетки способен, интегрируя всю приходящую информацию, "принять решение" путем перестройки синтеза белковых компонентов мембран. В этом скрыта одна из причин уникального свойства нейронов и нервной ткани в целом — пластичности.
Таким образом, основная роль нейрорецепторов сводится к созданию специфических информационных входов, организующих единый функциональный ансамбль нейронов. Именно совокупность рецепторов определяет лицо клетки и ее реакции на поступление разнообразных химических сигналов.
Молекулярные механизмы, лежащие в основе модуляции эффективности синаптической передачи, в которых важную роль играют рецепторные процессы, имеют альтернативу. С одной стороны, это изменение чувствительности к рецептору, с другой — увеличение или снижение количества активных рецепторов на мембране. Заслуживают внимания и гипотезы, касающиеся посттрансляционной модификации нейрорецепторов, которая позволяет изменить количественные параметры их функционирования.
Внимание к проблемам нейрорецептии со стороны биохимиков, фармакологов и физиологов обусловлено еще и тем, что причиной многих дисфункций нервной системы является нарушение целостности мембранных компонентов как нейронов, так и глиальных клеток. Отметим, что существующие успехи в лечении некоторых нервно-психических заболеваний связаны в большей мере с прогрессом в исследовании именно молекулярных свойств ряда рецепторов. Оказалось, что многие нейрорецепторы выполняют роль избирательных мишеней действия известных лекарственных препаратов. Исследования в этой области нейробиологии служат сейчас постоянным источником для целенаправленного поиска и создания новых классов фармакологических средств, обладающих улучшенными терапевтическими свойствами.
8. БИОХИМИЧЕСКИЕ МЕТОДЫ ИЗУЧЕНИЯ МЕХАНИЗМОВ НЕЙРОРЕЦЕПТИИ
Наиболее широко распространенным и разработанным методическим подходом для количественного анализа взаимодействия нейромедиаторов со своими рецепторами на мембране клетки является радиолигандный метод. Суть этого метода заключается в изучении параметров связывания радиоактивного лиганда с мембранно-связанными или изолированными рецепторными белками. В настоящее время существует хорошо развитая кинетическая теория рецептии и методы определения физико-химических параметров процесса образования комплекса лиганд-рецептор. Такой физико-химический анализ позволяет сделать определенные заключения о структуре активных центров нейрорецепторов, в частности, выяснить природу некоторых функциональных групп, которые ответственны за первую стадию взаимодействия лиганда с акцептором.
Для того чтобы кратко ознакомиться с количественной теорией взаимодействия веществ со своими рецепторами, рассмотрим простейшие условия, когда одна молекула лиганда взаимодействует с одним центром связывания:
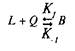
где L — лиганд; Q — центр связывания; В — комплекс лиганда со связывающим центром; К{ и K.j — кинетические константы. При динамическом равновесии скорость реакции образования комплекса В равна его скорости диссоциации, т.е. Vt = V_1? тогда концентрация вычисляется по формуле
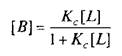
При этом предполагается, что L и Q взаимодействуют между собой по закону действующих масс, т.е. скорости реакций образования комплекса и его диссоциации прямо пропорциональны концентрациям компонентов в системе. Отношение констант прямой и обратной реакции называют константой сродства Кс. Она характеризует соотношение занятых и свободных участков связывания при данной концентрации лиганда. Обычно для описания параметров связывания используют величину, обратную константе сродства,—
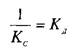
— константу диссоциации. Эта константа соответствует величине, при которой происходит насыщение 50% связывающих участков:
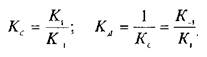
Если вместо константы сродства Кс использовать обратную ей величину Кд, то, подставив это значение в уравнение, характеризующее равновесную реакцию взаимодействия лиганда с рецептором, получим следующее уравнение:
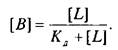
Приняв общее число рецепторов за 1, можно преобразовать уравнение к виду, аналогичному уравнению Михаэлиса, которое используется в энзимологии для описания кинетики обратимых ферментативных реакций:
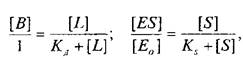
где — концентрация комплекса фермент-субстрат; —
концентрация субстрата и Ks — константа диссоциации комплекса; — исходная концентрация субстрата.
Согласно этим уравнениям зависимость величины эффекта от дозы лиганда или фермента описывается гиперболой. Чаще всего для работы пользуются графическим выражением зависимости эффекта не от концентрации, а от логарифма концентрации лиганда. Графически зависимость результатов может быть представлена разными способами, однако наиболее информативным способом расчета являются координаты Скэтчарда. Действительно, помимо равновесной константы связывания и общей концентрации центров связывания этот метод позволяет определить концентрацию свободного лиганда, соответствующую данной концентрации комплекса В. Константа диссоциации равна котангенсу угла наклона прямой. Отрезок на оси абсцисс от точки пересечения с прямой до начала координат соответствует максимальному уровню насыщения центров связывания.

Таким образом, представление результатов равновесного связывания в координатах Скэтчарда дает информацию о характере протекающего процесса и позволяет определить важные параметры лиганд-рецепторного взаимодействия — константу диссоциации и концентрацию центров, способных образовывать комплексы с нейромедиатором.
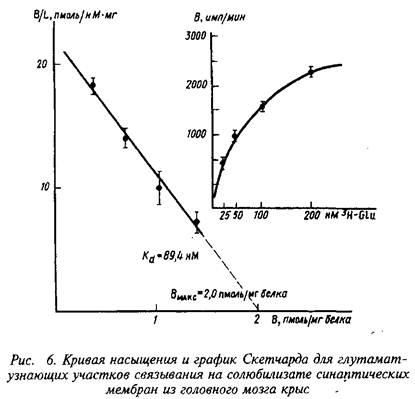
В качестве примера изучения рецепторного связывания нейромедиатора с белковыми компонентами на мембране нейрона приведем экспериментальные исследования глутаматных рецепторов радиолигандным методом. Так, исследования параметров связывания Н-глутамата с синаптическими мембранами, выделенными из коры больших полушарий головного мозга крыс, показали их зависимость от чистоты материала, способов хранения, условий проведения реакции связывания и др. При стандартизации всех указанных условий зависимость специфического связывания Н-глутамата с синаптическими мембранами имеет насыщающий характер. Представление экспериментальных данных в координатах Скэтчарда свидетельствует о наличии на мембранах однородной популяции участков связывания с Кд - 89,4 нМ и Вмакс = 2,0 пмоль/мг белка.
Значение количества центров связывания, выраженное в СРМ, пересчитывается в фмоль/мг белка по следующей формуле:
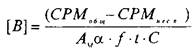 >
>
где А^ — молярная активность радиолиганда, Кю/моль; а — 2,210~ pacn/мин; f — эффективность счета; — разность счета связывания радиолиганда с рецептором в отсутствие и в присутствии немеченого радиолиганда; t — в