Вплив лерканідипіну і бісопрололу на функції ендотелію у хворих на гіпертонічну хворобу, поєднану з ішемічною хворобою серця
МІНІСТЕРСТВО ОХОРОНИ ЗДОРОВ'Я УКРАЇНИ
ІВАНО-ФРАНКІВСЬКИЙ ДЕРЖАВНИЙ МЕДИЧНИЙ УНІВЕРСИТЕТ
ШОРІКОВА Діна Валентинівна
УДК: 616.12-008.331.1: 616.12-005.4) -085.22: 577.1
ВПЛИВ ЛЕРКАНІДИПІНУ І БІСОПРОЛОЛУ НА ФУНКЦІЇ ЕНДОТЕЛІЮ У ХВОРИХ НА ГІПЕРТОНІЧНУ ХВОРОБУ, ПОЄДНАНУ З ІШЕМІЧНОЮ ХВОРОБОЮ СЕРЦЯ
14.01.11. - кардіологія
АВТОРЕФЕРАТ
на здобуття наукового ступеня
кандидата медичних наук
Івано-Франківськ - 2008
Дисертацією є рукопис.
Робота виконана в Буковинському державному медичному університеті МОЗ України
Науковий керівник: доктор медичних наук, професор
ТАЩУК Віктор Корнійович,
Буковинський державний медичний університет МОЗ України,
кафедра кардіології, функціональної діагностики, лікувальної
фізкультури та спортивної медицини, завідувач кафедри
Офіційні опоненти: доктор медичних наук, професор
ЯЦИШИН Роман Іванович,
Івано-Франківський державний медичний університет
МОЗ України, кафедра факультетської терапії,
професор кафедри
доктор медичних наук, професор
БУГАЄНКО Веніамін Вікторович,
Національний науковий центр
“Інститут кардіології ім. акад. М.Д. Стражеска”
АМН України, м. Київ
відділ атеросклерозу та хронічної ішемічної хвороби серця, провідний науковий співробітник
Захист дисертації відбудеться “11” квітня 2008 року о 13 годині на засіданні спеціалізованої вченої ради Д 20.601.01 при Івано-Франківському державному медичному університеті МОЗ України (76018, м. Івано-Франківськ, вул. Галицька 2)
З дисертацією можна ознайомитись у бібліотеці Івано-Франківського державного медичного університету за адресою: 76018, м. Івано-Франківськ, вул. Галицька, 7
Автореферат розісланий “6“ березня 2008 р.
Вчений секретар
спеціалізованої вченої ради Д 20.601.01,
доктор медичних наук, професор О.І. Дєльцова
ЗАГАЛЬНА ХАРАКТЕРИСТИКА РОБОТИ
Актуальність теми. Гіпертонічна хвороба (ГХ) та ішемічна хвороба серця (ІХС) залишаються основною проблемою охорони здоров’я в більшості країн унаслідок їх впливу на показники смертності та захворюваності населення (Горбась І.М. 2005; Коваленко В.М., Сіренко Ю.М. 2005). Прогноз у хворих на ГХ залежить від наявності уражень органів-мішеней (Guidelines for the management of arterial hypertension 2007), зокрема, серця та судин (Гаман С.А. и др. 2005; Bard R. L. et al. 2004). На даний час гіпертрофія лівого шлуночка (ГЛШ) вважається незалежним фактором ризику ГХ та ІХС (Радченко Г.Д., Сіренко Ю.М. 2006; Devereux R. et al. 2004; Harris K. M. et al. 2006). Іншою важливою мішенню, що вражається при ГХ є сонні артерії (СА) (Гуляев С.А. и др. 2004). Одним із механізмів, що впливають на ремоделювання судин є дисфункція ендотелію (Бабак О.Я. и др. 2006; Deanfield J. et al. 2005), тому поширюється зацікавленість у вивченні його функціонального стану, як маркера ураження серцево-судинної системи (Нейко Є.М. 2005; Яцишин Р.І. 2003; Pollock 2005; Becker R. C. 2005; Gössl M. et al. 2006).
Також постає питання про можливість підвищення ефективності лікування ІХС у хворих на ГХ шляхом застосування антигіпертензивних препаратів, які мають органопротекторні та ендотеліопротекторні властивості (Амосова К.М. 2004; Лутай М.И. и др. 2004). Ефективність застосування β-адреноблокаторів та блокаторів кальцієвих каналів (БКК) у хворих на ГХ та ІХС доведено в чисельних багатоцентрових дослідженнях (COPERNICUS, SENIORS, CIBIS I-III, INVEST, ELSA та ін.). У трайлах CIBIS I-III продемонстровано ефективність бісопрололу щодо зменшення смертності, частоти госпіталізації у хворих із хронічною серцевою недостатністю (ХСН) через вплив на параметри ремоделювання ЛШ. Проте вплив препарату на показники судинного ремоделювання та ендотеліальної дисфункції практично не досліджувався. У трайлах INSIGHT та ELSA доведено антиатерогенну дію БКК дигідропіридинового ряду, водночас дослідження відповідного ефекту лерканідипіну та вивчення його впливу на функцію ендотелію, параметри ремоделювання ЛШ не проводились.
Таким чином, розширення діагностичного підходу щодо ГХ, поєднаної з ІХС, дослідження додаткових ефектів лерканідипіну та бісопрололу зумовлює актуальність даної роботи.
Зв'язок роботи з науковими програмами, планами, темами. Дисертація є фрагментом науково-дослідної роботи кафедри кардіології, функціональної діагностики, ЛФК та спортивної медицини Буковинського державного медичного університету (БДМУ) на тему “Клініко-патогенетичні та нейромесенджерні механізми розвитку та реалізації серцевої недостатності в умовах гострого коронарного синдрому та стабільної стенокардії (СС) з оптимізацією лікувальної тактики та визначенням прогностичних предикторів” (№ держреєстрації 0107U004053).
Мета і задачі дослідження. Визначити особливості дисфункції ендотелію, ремоделювання серця та сонних артерій у хворих на ГХ за поєднаного перебігу зі стабільною стенокардією (СС), а також оцінити ефективність лерканідипіну та бісопрололу щодо корекції виявлених порушень.
Для досягнення даної мети були сформульовані наступні задачі:
Визначити особливості ремоделювання ЛШ та СА, а також ступінь впливу ГХ та СС на параметри ремоделювання, встановити взаємозв’язки між структурними змінами серця та судин.
Дослідити зміни проліферативної, антикоагулянтної, фібринолітичної функцій ендотелію в пацієнтів із поєднаним перебігом ГХ та СС.
Оцінити стан протеолітичної системи плазми крові, ліпідної ланки гомеостазу та морфофункціональних властивостей еритроцитів у хворих на ГХ за поєднаного перебігу зі СС.
Дослідити вплив та оцінити вірогідність ефектів лерканідипіну та бісопрололу на процеси судинного та серцевого ремоделювання, а також функціональний стан ендотелію у хворих на ГХ за поєднаного перебігу зі СС.
Об’єкт дослідження – функціональний стан ендотелію, ремоделювання лівого шлуночка та сонних артерій у хворих на ГХ зі стабільною стенокардією напруження.
Предмет дослідження - показники, які характеризують функціональний стан ендотелію, параметри ремоделювання лівого шлуночка та сонних артерій, їх динаміка на тлі лікування лерканідипіном та бісопрололом.
Методи дослідження – клініко-лабораторні, функціональні, біохімічні, імуноферментні.
Наукова новизна отриманих результатів. У роботі вперше встановлено, що у хворих на ГХ за поєднаного перебігу зі СС визначається вірогідно нижчий рівень фактора ангіогенезу відносно практично здорових осіб, доведено більш істотне зниження антикоагулянтної та фібринолітичної функцій ендотелію в пацієнтів із ГХ та СС на відміну від хворих на ГХ без СС. Встановлено, що раннім проявом ремоделювання внутрішніх СА (ВСА) у хворих на ГХ є збільшення діаметра судин, а більш значне потовщення комплексу інтима-медіа (КІМ) СА встановлено в осіб із поєднаним перебігом ГХ та СС.
Уперше встановлено, що через 12 тижнів антигіпертензивної терапії лерканідипіном та бісопрололом вірогідно підвищився рівень фактора ангіогенезу, лерканідипін перевищував бісопролол за здатністю підсилювати антикоагулянтний потенціал ендотелію та інтенсивністю впливу на зворотній розвиток ремоделювання внутрішніх СА (патент України №25030), водночас, бісопролол більш істотно сприяв регресу ГЛШ та підсилював фібринолітичну активність ендотелію.
Уперше проведено оцінку міри впливу ГХ та СС, за умов їх поєднаного перебігу, на показники структурних змін ЛШ та внутрішніх СА шляхом моделювання за методом Снедекора кількісних показників – маси міокарда (ММ), відносної товщини стінок лівого шлуночка (ВТСЛШ), діаметрів СА та величини КІМ.
Практичне значення одержаних результатів. Робота є комплексним дослідженням, в якому патогенетично обгрунтовано необхідність застосування дуплексного сканування СА та ехокардіографії (ЕхоКГ) для підвищення якості діагностики уражень серця та судин у хворих на ГХ за поєднаного перебігу зі СС. Водночас, застосування цих методів дозволило встановити органопротективні властивості лерканідипіну та бісопрололу та підвищити ефективність лікування хворих на ГХ. Доведено, що вміст судинного ендотеліального фактора росту в сироватці крові, показники агрегаційної здатності тромбоцитів, активність протеїну С та потенційна активність плазміногену є вірогідними маркерами для оцінки ступеня дисфункції ендотелію. Розроблено підхід до диференційованого застосування лерканідипіну та бісопрололу у хворих на ГХ за поєднаного перебігу зі СС.
Основні результати дисертації використовуються в навчальному процесі на кафедрах терапевтичного профілю Буковинського та Івано-Франківського державних медичних університетів, впроваджено в практику профільних відділень міської клінічної лікарні №3 м. Винниці, Хотинської, Сокирянської, Кельменецької ЦРЛ, Закарпатського обласного кардіологічного диспансеру, лікарні швидкої медичної допомоги та госпіталю інвалідів Великої Вітчизняної війни м. Чернівці.
Особистий внесок здобувача. Особистий внесок автора в отриманні наукових результатів є основним. Дисертант особисто проаналізувала наукову літературу, що дозволило визначити напрямок дослідження. Самостійно проводила підбір та обстеження хворих, призначала лікування. Сформувала базу даних дисертації. Статистичну обробку отриманих результатів і написання всіх розділів дисертаційної роботи автор провела самостійно. Висновки та практичні рекомендації сформульовані разом із керівником.
Апробація результатів дисертації. Матеріали дисертації доповідались та обговорювались на спільних засіданнях терапевтичних кафедр Буковинського державного медичного університету, ХІ конгресі світової федерації Українських лікарських товариств (Полтава, 28-30 серпня 2006), ІV міжнародній науково-практичній конференції студентів та молодих вчених (Ужгород, 18-20 квітня 2006), ІІІ Міжнародній медико-фармацевтичній конференції студентів та молодих вчених (Чернівці, 2006), Міжнародній науковій конференції студентів та молодих вчених “Молодь – медицині майбутнього” (м. Одеса, 20-21 квітня 2006), Всеукраїнській науково-практичній конференції “Здобутки та перспективи внутрішньої медицини” (Тернопіль, 19-20 жовтня, 2006), науково-практичній конференції молодих вчених, присвяченій 145-річчу Харківського медичного товариства “Медична наука: сучасні досягнення та інновації”(Харків, 23 листопада 2006), 18th European Students’ Conference (Berlin, 7th-11th October, 2007).
Публікації. За матеріалами дисертаційної роботи опубліковано 14 наукових праць, із них 5 статей - у фахових виданнях, рекомендованих ВАК України (2 - одноосібні), 9 тез у матеріалах наукових конгресів, пленумів, конференцій, отримані один деклараційний патент України на корисну модель та посвідчення на раціоналізаторську пропозицію.
Структура та обсяг дисертації. Дисертація викладена на 161 сторінці основного тексту і складається зі вступу, огляду літератури, матеріалів і методів дослідження, результатів власних досліджень, викладених у чотирьох розділах, аналізу та узагальнення результатів, висновків та практичних рекомендацій. Роботу ілюстровано 72 таблицями та 18 рисунками. Бібліографічний вказівник містить 322 джерела, із них 75 – кирилицею та 247 - латиною.
ОСНОВНИЙ ЗМІСТ РОБОТИ
Матеріал та методи дослідження. Відповідно до завдань дослідження під спостереженням знаходились 158 пацієнтів на ГХ, які були поділені на п’ять груп: 1 група – хворі на ГХІ ст. (15 осіб), 2 група – хворі на ГХ ІІ ст. (16 осіб), 3 група – пацієнти з ГХІІ ст. та стабільною стенокардією ІІ функціонального класу (ГХІІССІІФК - 50 осіб), 4 група – хворі на ГХІІ ст. та стабільну стенокардію ІІІ ФК (ГХІІССІІІФК - 39 осіб), 5 група – пацієнти з ГХІІІ ст. та стабільною стенокардією ІІІ ФК (ГХІІІССІІІФК - 38 осіб).
Дослідження проводилось в умовах кафедри кардіології, функціональної діагностики, ЛФК та спортивної медицини БДМУ, обласного кардіологічного диспансеру, поліклініки профоглядів та обласного діагностичного центру м. Чернівців. Контрольну групу склали 25 осіб, репрезентативні за віковим та статевим розподілом основній групі. Верифікацію діагнозу СС та визначення стадії ГХ проводили з використанням критеріїв, рекомендованих Українською асоціацією кардіологів (2004) та Європейським товариством гіпертензії та кардіології. Залежно від антигіпертензивної терапії в усіх групах виділяли дві підгрупи: хворі, які отримували бісопролол (“Конкор”, Nycomed, № 3364 від 25.01. 2005) та пацієнти, що отримували лерканідипін (“Леркамен”, Berlin-Chemie, № UA/0583/01/01 від 20.02. 2004); титрування доз препаратів проводилось згідно консенсусу по застосуванню β-адреноблокаторів (2004) та Європейських рекомендацій по лікуванню артеріальної гіпертензії (2003). Незалежно від антигіпертензивного препарату всі хворі на ГХ та СС отримували стандартне лікування згідно рекомендацій Європейського товариства кардіологів по лікуванню стабільної стенокардії (2006). Загальна тривалість контрольованого лікування складала 12 тижнів.
Ехокардіографія (ЕхоКГ) проводилась за стандарною методикою на ультразвукових сканерах “INTERSPEС XL”(USA) та “EnVisor HD” (Philips Ultrasound System, USA), маса міокарда (ММ) ЛШ визначалась за формулою R. Devereux та N. Reicheck у модифікації ASE: (ММ = 0.8 х {1.04 х ((КДР + ТЗСд + ТМПд) 3 - (КДР) 3) }+ 0,6 (г)). Стан загальних, зовнішніх та внутрішніх СА досліджувався системою “EnVisor HD” (Philips, USA) обласного діагностичного центру м. Чернівці за методикою В.Г. Лелюк (2003). Для встановлення функціонального класу СС проводилась велоергометрична проба.
Рівень холестерину (ХС) та β-ліпопротеїнів (β-ЛП) визначали методом Златкіс-Зака (“Danish Ltd. ”, Україна). Для дослідження проліферативної активності ендотелію визначали вміст у крові фактора ангіогенезу (твердофазний імуноферментний метод, реактив BioSource International (USA), аналізатор Rayto-2100C (China)), агрегаційні властивості тромбоцитів досліджувались на агрегометрі АР-2110 (Solar, Беларусь) турбідиметричним методом за J. Born (1962). Рівень фібриногену в плазмі крові, активність антитромбіну III (АТ III), інтенсивність Хагеманзалежного фібринолізу (ХЗФ), вміст XIII фактора (ХІІІФ), потенційну активність плазміногену (ПАП), сумарну фібринолітичну активність (СФА), ферментативний (ФФА), неферментативний фібриноліз (НФА) та протеолітичну активність за лізисом азоальбуміну, азоказеїну, азоколу визначали за допомогою реактивів “Danish Ltd. ” (Україна) та фотоелектроколориметру КФК-3. Активність протеїну С встановлювали коагулометричним методом (НПО “РЕНАМ”, Москва). Морфофункціональний стан еритроцитів оцінювали методом З.Д. Федорової, М.О. Котовщикової (1989).
Для статистичного аналізу використовували пакет програм Statistica for Windows версії 6.0 (Stat Soft inc., США) та EpiInfo 2000, версія 3.3.2. Вірогідність різниці визначали t-критерієм Стьюдента та F-критерієм Фішера для параметричних даних. При непараметричному розподілі використовували для множинного порівняння – Н-критерій Краскела-Уоліса, для парного – ранговий U-критерій Манна-Уітні (у випадку незалежних вибірок) та Т-критерій Вілкоксона (у випадку залежних груп). Для оцінки міри залежності між перемінними використовували кореляційний аналіз за Пірсоном та коефіціент рангової кореляції Спірмена. Для оцінки ступеня факторного впливу використовували метод Снедекора. Оцінка ефективності лікування проводилась із урахуванням виходів лікування, абсолютного (АЕ,%) та відносного (ВЕ) терапевтичних ефектів, терапевтичної користі (різниця АЕ), а також відношення шансів (ВШ) препаратів, із розрахунком довірчих інтервалів та критерію вірогідності щодо ВЕ та ВШ. При р<0,05 розбіжності вважали статистично вірогідними.
Результати дослідження та їх обговорення. За аналізу кардіогемодинаміки було встановлено, що у хворих на ГХ зі СС більш суттєво зменшуються показники систолічної функції ЛШ: фракція викиду (ФВ), ударний об’єм, ударний індекс, хвилинний об’єм крові, серцевий індекс порівняно з хворими на ГХ без СС (р<0,05). Маса міокарда (ММ), індекс маси міокарда (ІММ) та відносна товщина стінок лівого шлуночка (ВТСЛШ) у хворих із поєднаним перебігом ГХ та СС перевищували відповідні показники у хворих на ГХ без СС (р1-3<0,05). Враховуючи таку тенденцію, у пацієнтів із ГХ та СС частіше, ніж у хворих на ГХ без СС, визначались патологічні типи геометрії ЛШ, із переважанням концентричної гіпертрофії міокарда. За результатами кореляційного аналізу встановлено вірогідний (p=0,02) зворотній кореляційний зв’язок середньої сили (r=-0,27) між ММ та ФВ ЛШ. При визначенні міри факторного впливу ГХ та СС на параметри ремоделювання ЛШ встановлено, що зміна ММ та ІММ залежить більшою мірою від ГХ (37,9%, p<0,001), ніж від СС (28,4%, p<0,001), а зміни ВТСЛШ обумовлені асоційованим впливом ГХ та СС (55,7%, p<0,001).
За результатами ультразвукового дослідження ЗСА було встановлено, що величина КІМ ЗСА у хворих на ГХІІ без СС не відрізнялась від контролю (p>0,05), однак мала місце асиметрія КІМ правої та лівої ЗСА (22,0%, р<0,05). У хворих із поєднаним перебігом ГХ та СС відмічається збільшення величини та ступеня асиметрії КІМ ЗСА відносно групи хворих на ГХ без СС (р1-3<0,05). У ВСА величина КІМ у хворих на ГХ без СС вірогідно збільшувалась відносно контролю лише справа (p<0,05), у хворих із поєднаним перебігом ГХ та СС дані зміни реєструвались з обох сторін (p<0,05), при чому товщина КІМ у ВСА та ступінь асиметрії залежали від стадії ГХ та ФК стенокардії (рис.1).


Рис.1. Величина комплексу інтима-медіа (%) внутрішніх сонних артерій у хворих на неускладнену гіпертонічну хворобу та гіпертонічну хворобу зі стабільною стенокардією.
При моделюванні міри факторного впливу встановлено, що ступінь впливу стенокардії на величину КІМ переважав ступінь впливу ГХ у ЗСА (41,3 проти 24,5% справа, 38,3% проти 23,0% зліва), ВСА (38,0 проти 21,6% справа та 42,1 проти 27,0% зліва) та Зов. СА (46,1 проти 21,6% справа та 40,7 проти 29,7% зліва) СА.
Діаметри ЗСА у хворих на ГХ без СС не відрізнялись від контролю (p>0,05), проте вірогідно перевищували норму при поєднаному перебігу ГХ та СС (р<0,05). Водночас, як у пацієнтів з ГХ без СС, так і за поєднаного перебігу ГХ та СС (p<0,05) діаметр ВСА вірогідно перевищував контроль, причому збільшення діаметру ВСА виявлялось навіть за незміненого КІМ. У всіх випадках був встановлений прямий кореляційний зв’язок між ММ ЛШ, діаметром та КІМ СА (табл.1).
Таблиця 1. Кореляційний зв’язок між масою міокарда лівого шлуночка, діаметром та комплексом інтима-медіа зовнішніх і внутрішніх сонних артерій
| Права ЗСА | Ліва ЗСА | Права ВСА | Ліва ВСА | |||||
| КІМ | діаметр | КІМ | діаметр | КІМ | діаметр | КІМ | діаметр | |
| ММЛШ | r=0,36* | r=0,50* | r=0,24 | r=0,45* | r=0,36* | r=0,43* | r=0,40* | r=0,30* |
* – вірогідний кореляційний зв’язок.
При дослідженні функціонального стану ендотелію, зокрема, судинно-тромбоцитарного гемостазу було встановлено, що у хворих на ГХ без СС та ГХ зі СС спостерігається зростання ступеня спонтанної агрегації тромбоцитів відносно такої в практично здорових осіб (p<0,05), із більш значними змінами за наявності ГХ зі СС (p1-3<0,05), у той час, як АДФ-індукована агрегація вірогідно підвищувалась лише у хворих на ГХ зі СС (p<0,05). Час агрегації тромбоцитів та швидкість агрегації вірогідно не відрізнялись у хворих на ГХІ, ГХІІ, ГХІІССІІФК та контролем, проте змінювались (час скорочувався, швидкість зростала) у хворих на ГХІІССІІІФК та ГХІІІССІІІФК (p<0,05). Окрім того, у хворих із ГЛШ зареєстрований більш високий рівень АДФ-індукованої (р=0,051) агрегації тромбоцитів та вірогідне зменшення часу агрегації (p<0,05) відносно пацієнтів без ГЛШ, причому за наявності концентричної ГЛШ ці зміни були більш значними (p<0,05), ніж у хворих із іншими типами ремоделювання міокарда. Також встановлено пряму кореляційну залежність між величиною КІМ ЗСА (r=0,38, p<0,05) та ВСА (r=0,44, p<0,05) та ступенем АДФ-індукованої агрегації тромбоцитів.
Оцінку стану антикоагулянтної активності за рівнем протеїну С (PtC) проводили шляхом кластерного аналізу, у результаті чого було отримано 3 кластери з достовірною різницею між ними (p<0,05), що дозволило розподілити хворих на три групи: із незначним зниженням рівня протеїну С (група 1–72 осіб), із суттєвим зниженням протеїну С (група 2–20 осіб) та з вірогідним підвищенням рівня протеїну С (група 3– 23 осіб) у порівнянні з контролем. При аналізі нозологічної структури встановлено, що в більшості хворих на ГХІ, ГХІІ та ГХІІССІІФК є незначне зниження (р<0,05) рівня протеїну С, у хворих на ГХІІССІІІФК встановлено його суттєве зниження (р<0,01), а у хворих на ГХІІІСІІІФК – його підвищення (р<0,05) щодо контролю.
За аналізу результатів дослідження фібринолітичної активності крові було відмічено вірогідне зниження ПАП (р<0,05) у хворих на ГХ без СС та ГХ зі СС відносно контролю. Спостерігалось також вірогідне зниження СФА (р<0,05) у пацієнтів зі структурними змінами СА. У хворих із ГЛШ встановлено вірогідне підвищення інтенсивності лізису азоказеїна (p<0,01), а у хворих зі структурними змінами СА – зростання інтенсивності лізису азоальбуміна (р<0,05).
Розвиток коронарних колатералей та здатність ендотелію до проліферації залежить від співвідношення між стимуляторами та інгібіторами ангіогенезу, із них найбільше значення має судинний ендотеліальний фактор росту – VEGF. У хворих на ГХ зі СС рівень VEGF складав 35,0 (7,6-68,7) пг/мл, що є вірогідно нижчим (р<0,01), ніж у групі практично здорових осіб – 89,3 (65-126) пг/мл. У хворих на ГХІІССІІФК рівень VEGF-165 становив 59,4 (52,8-79,5) пг/мл (р<0,05), за наявності ГХІІССІІІФК – 8,3 (1,0-42,9) пг/мл (р<0,01), ГХІІІССІІІФК – 13,8(6,9-27,1) пг/мл (р<0,05).
Встановлено підвищення рівня загального ХС та β-ЛП у хворих на ГХ зі СС та ГХ без СС відносно контролю (p<0,01) та залежність вмісту ХС від структурних змін СА (p<0,01). Також у хворих на ГХ з супутньою СС та ГХ без СС спостерігалось зменшення індексу деформабельності еритроцитів (ІДЕ, р<0,001) та зростання коефіцієнту в’язкості еритроцитарної суспензії (КВЕС, p<0,05) відносно практично здорових осіб.
Зміни показників, що характеризують функцію ендотелію та параметри ремоделювання ЛШ та СА аналізувались в динаміці лікування у хворих на ГХІІССІІІФК.
При застосуванні бісопрололу відбувалось зниження спонтанної (на 38,3%, р=0,01) та АДФ-індукованої агрегації тромбоцитів (у 2,9 рази, р=0,07), подовження часу агрегації на (у 2,1 рази, р=0,03) та зниження швидкості агрегації тромбоцитів (на 47,1%, р=0,06). На фоні застосування лерканідипіну рівень спонтанної тромбоцитарної агрегації знижувався на 6,6% (р=0,1), АДФ-індукованої – в 2,1 рази (р<0,01), час агрегації тромбоцитів подовжувався на 18,0% (р=0,1), швидкість агрегації уповільнювалась у 2,3 рази (р<0,01). За кожним параметром обчислювали абсолютну кількість хворих, в яких було досягнуто бажаного ефекту та кількість хворих, де бажаний ефект не досягався. Рівень спонтанної агрегації на фоні 12-тижневого прийому бісопрололу знижувався в 94,1% хворих, на фоні лерканідипіну – у 88,2%, терапевтична користь бісопололу становила 5,9%, ВЕ - 1,07 (0,86-1,32), ВШ – 2,13 (0,13-6,71). Вплив на АДФ-індуковану агрегацію переважав у лерканідипіну (94,1%) у порівнянні з бісопрололом (75,0%), із терапевтичною користю 19,1%, ВЕ - 0,80 (0,59-1,08) та ВШ - 0,19 (0,01-2,25). Швидкість агрегації після застосування лерканідипіну знижувалась у 94,1% пацієнтів та у 64,7% хворих, що отримували бісопролол, тобто терапевтична користь лерканідипіну склала 29,4%, ВЕ - 0,69(0,49-1,0), ВШ - 0,11(0,03-1,24) (рис.2).
У хворих на ГХІІССІІІФК спостерігалось збільшення вмісту фактора ангіогенезу на фоні 12-тижневого лікування як бісопрололом (р<0,05), так і лерканідипіном (р<0,05). Для оцінки вірогідності ефекту позитивним виходом лікування вважали всі випадки збільшення вмісту в крові VEGF, негативним – його зниження або збереження вихідного рівня. Було встановлено більш виражений АЕ лерканідипіну (77,8%) з терапевтичною користю відносно бісопрололу 17,8%.
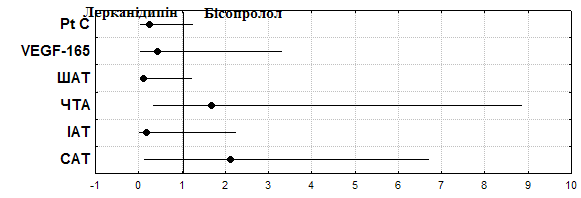
Рис.2. Відношення шансів лерканідипіну та бісопрололу щодо впливу на функції ендотелію у хворих на гіпертонічну хворобу зі стабільною стенокардією.
За оцінки змін антикоагулянтної функції ендотелію в динаміці лікування бісопрололом у хворих на ГХІІССІІІФК спостерігалось збільшення рівня протеїну С на 44,4%, (р=0,03) та 24,7% (р=0,07) при призначенні лерканідипіну, хоча АЕ щодо рівня протеїну С був вищим у лерканідипіну (85,7%) відносно бісопрололу (61,3%), з терапевтичною користю 24,4%, ВЕ 0,72 (0,51-0,99), ВШ 0,26 (0,05-1,26). АЕ бісопрололу щодо ПАП складав 72,3%, з терапевтичною користю 21,1%, ВЕ 1,40(0,93-2,09), ВШ - 2,43(0,81-7,37).
Таким чином, вірогідність впливу на показники судинно-тромбоцитарного гемостазу, антикоагулянтну активність ендотелію та рівень фактора ангіогенезу за виходами лікування в лерканідипіну є більшою (рис.2), хоча не можна заперечувати також вірогідність впливу бісопрололу на ці показники – про що свідчить величина довірчих інтервалів (95%ДІ), тобто обидва препарати мають певний рівень ендотеліопротекторного впливу.
На фоні бісопрололу та лерканідипіну спостерігалась тенденція до зниження рівня ХС (2,7 та 2,4%, p>0,05) та β-ЛП (11,9 та 10,9%, p>0,05), проте вірогідність даного ефекту (АЕ,%) щодо ХС склала 69% для бісопрололу та 66,7% для лерканідипіну, ВЕ 1,04 (0,74-1,45), ВШ - 1,12 (0,35-3,54), для β-ЛП АЕ бісопрололу - 70,7%, лерканідипіну – 59,3%, ВЕ - 1,19 (0,82-1,73), ВШ – 1,66 (0,53-5,22). Вплив препаратів на морфофункціональні властивості еритроцитів виражався у вірогідному збільшенні ІДЕ на фоні як бісопрололу (31,7%, р<0,01), так і лерканідипіну (27,5%, р<0,01) та зниженні КВЕС – 12,1 та 21,4% відповідно (р<0,05). АЕ лерканідипіну щодо КВЕС на 25% переважав АЕ бісопрололу, ВЕ – 0,73 (0,50-1,05), ВШ – 0,18 (0,01-2,05).
За оцінки впливу препаратів на кардіогемодинаміку було виявлено незначне збільшення ФВ ЛШ на фоні бісопрололу (3,5%, р=0,07) без суттєвих змін КДО та КСО (р>0,05). У групі, що отримувала лерканідипін, встановлено вірогідне зменшення КДО ЛШ (на 5,9%, р<0,05) та незначне зменшення КСО (5,94%, р=0,1).
За застосування бісопрололу впродовж 12 тижнів у хворих на ГХІІССІІІФК відмічено зменшення ММ на 7,8%, (р=0,1), ІММ на 6,9% (р=0,1) та ВТСЛШ – на 4,4% (р=0,1), така ж тенденція спостерігалась на фоні лікування лерканідипіном щодо ММ ЛШ, ІММ ЛШ (р=0,051) та ВТСЛШ (р=0,1). За оцінки терапевтичної ефективності бісопрололу АЕ відносно ММ та ІММ склав 78,7%, який переважав відповідний ефект лерканідипіну на 12,0%, ВЕ визначений як 1,18 (0,84-1,65), ВШ – 1,85 (0,51-6,72). АЕ бісопрололу щодо зменшення ВТСЛШ дорівнював 68,0%, що на 6,1% більше ніж у лерканідипіну, ВЕ – 1,10 (0,75-1,62), ВШ – 1,31 (0,39-4,37).
Антигіпертензивна терапія бісопрололом впродовж 12 тижнів у хворих на ГХІІССІІІФК сприяла зменшенню величини КІМ у ЗСА (справа - 7,8%, p>0,05, зліва - 22,4%, р=0,06) та ВСА (відповідно 14,9%, р=0,04 та 18,3%, p>0,05), у Зов. СА вірогідний вплив виявлено лише зліва – на 11,32% (р=0,05). За призначення лерканідипіну такі ж тенденції відносно величини КІМ встановлено в обох ЗСА (7,0%, р=0,07 – права, 32,4%, р=0,062 - ліва) та ВСА (у правій – 25,9%, р=0,1, у лівій – 15,7%, p>0,05), а також у лівій Зов. СА (11,53%, р=0,07). Для оцінки вірогідності ефектів проаналізовано абсолютну кількість випадків за правою та лівою СА, де впродовж лікування відмічалось зменшення КІМ. АЕ лерканідипіну на КІМ ЗСА склав 36,7%, із терапевтичною користю відносно бісопрололу 10,7%, ВЕ – 0,71 (0,37-1,38), ВШ – 0,61 (0, 20-1,79) (рис.3).
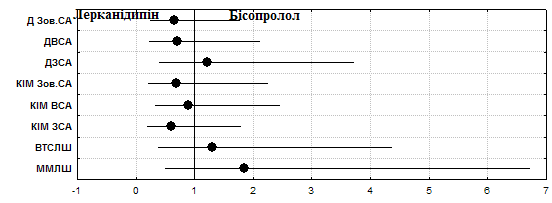
Рис.3. Відношення шансів впливу лерканідипіну та бісопрололу на показники серцевого та судинного ремоделювання у хворих на гіпертонічну хворобу зі стабільною стенокардією.
У ВСА АЕ лерканідипіну склав 56,7%, що перевищило АЕ бісопрололу на 2,7%, ВЕ – 0,95 (0,64-1,43), ВШ – 0,90 (0,33-2,46). У Зов. СА АЕ склав 20,0% у бісопрололу та 26,7% у лерканідипіну. Також підраховувалась кількість випадків, де відмічалося зменшення діаметру СА до кількості випадків, коли діаметр не змінювався. Підрахунок проводився за правою та лівою артеріями диференційовано для ЗСА, ВСА та Зов. СА. У ЗСА переважав АЕ бісопрололу (74,0%), із терапевтичною користю відносно лерканідипіну 4,0%, ВЕ – 1,06 (0,79-1,41), ВШ – 1,22 (0,40-3,73). У ВСА переважав АЕ лерканідипіну (73,3%), із терапевтичною користю 7,3%, ВЕ - 0,90 (0,67-1,21), ВШ – 0,71 (0,23-2,13). У Зов. СА вірогідність впливу препаратів була найменшою (АЕ лерканідипіну – 56,7%, бісопрололу – 46,0%), ВЕ – 0,81 (0,53-1,25), ВШ – 0,65 (0,24-1,78).
Тобто слід відміти переважання ефекту бісопрололу відносно зменшення ММ та ВТСЛШ, проте лерканідипіну властивий більш вірогідний вплив на величину КІМ та діаметри СА (ДЗСА, ДВСА, ДЗов. СА). З іншого боку обидва препарати мають позитивний вплив на ММ та ВТСЛШ, діаметри та величину КІМ СА (рис.3).
ВИСНОВКИ
У дисертаційній роботі вирішене актуальне завдання кардіології щодо оптимізації лікування хворих на ГХ за поєднаного перебігу зі стабільною стенокардією з урахуванням особливостей ендотеліальної дисфункції, наявності гіпертрофії лівого шлуночка та атеросклеротичних уражень сонних артерій шляхом диференційованого застосування блокатора кальцієвих каналів лерканідипіну та β-блокатора бісопрололу.
Встановлено, що за поєднаного перебігу ГХ та стабільної стенокардії в порівнянні з аналогічними групами хворих без стабільної стенокардії зміни маси міокарда (p<0,01), індексу маси міокарда (p<0,01) та відносної товщини стінок лівого шлуночка (p<0,01) є більш вираженими. Гіпертрофія лівого шлуночка є не лише адаптивним механізмом, але й фактором несприятливого прогнозу у хворих на гіпертонічну хворобу за поєднаного перебігу зі стабільною стенокардією, про що свідчить зворотня кореляційна залежність фракції викиду та маси міокарда лівого шлуночка (r=-0,27, p=0,02).
У хворих на ГХ зі стабільною стенокардією спостерігається більш значне ураження стінки судин, що виявляється в потовщенні комплексу інтима-медіа загальних (р1-3<0,05), внутрішніх (p<0,05) та зовнішніх сонних артерій (р1-3<0,05). Збільшення діаметру внутрішніх сонних артерій у пацієнтів із асоційованим перебігом ГХ та стенокардії (р<0,05) та у хворих на неускладнену ГХ (р<0,05) можна вважати ранньою ознакою судинного ремоделювання. У пацієнтів із ГХ, асоційованою зі стабільною стенокардією та у хворих на ГХ без стенокардії спостерігається прямий кореляційний зв’язок між масою міокарда лівого шлуночка, величиною комплексу інтима-медіа та діаметрами загальних та внутрішніх СА (r=0,24-0,50, p<0,05). Маса міокарда ЛШ переважно залежить від наявності ГХ (37,9%, p<0,001), а структурні зміни сонних артерій - від супутньої стабільної стенокардії (38,0-46,1%, p<0,001).
Негемодинамічними механізмами прогресування гіпертонічної хвороби з супутньою стабільною стенокардією є зміни функціонального стану ендотелію: погіршення здатності ендотеліальних клітин до регенерації та утворення нових судин (зниження рівня фактора росту судинного ендотелію, p<0,05), зниження антикоагулянтної та фібринолітичної активності (підвищення агрегаційної здатності тромбоцитів, скорочення часу агрегації, порушення в системі протеїну С, зниження потенційної активності плазміногену, p<0,05).
Суттєвими факторами, що несприятливо впливають на перебіг гіпертонічної хвороби зі стенокардією напруження є неконтрольоване підсилення протеолізу (зростання інтенсивності лізису високо-, низькодисперсних білків та колагену), порушення ліпідного обміну (збільшення вмісту в крові холестерину та β-ліпопротеїнів) та зміни морфофункціональних властивостей еритроцитів (зниження індексу деформабельності еритроцитів та зростання коефіцієнту в’язкості еритроцитарної суспензії).
У хворих на гіпертонічну хворобу зі стабільною стенокардією за застосування лерканідипіну та бісопрололу спостерігається зворотний розвиток ремоделювання лівого шлуночка (зменшення маси міокарда та відносної товщини стінок лівого шлуночка), атеросклеротичного ураження сонних артерій (зменшення комплексу інтима-медіа), покращення функціонального стану ендотелію (підвищення рівня фактора ангіогенезу, потенційної активності плазміногену, рівня протеїну С, зниження здатності тромбоцитів до агрегації – спонтанної та АДФ-індукованої, подовження часу агрегації та зменшення швидкості), покращення морфофункціональних властивостей еритроцитів (підвищення індексу деформабельності еритроцитів, зниження коефіцієнту в’язкості еритроцитарної суспензії) та метаболічого профілю крові (зниження рівня холестерину та β-ліпопротеїнів).
Бісопролол, у порівнянні з лерканідипіном, при гіпертонічній хворобі зі стабільною стенокардією більш інтенсивно сприяє зворотньому розвитку ремоделювання лівого шлуночка (зменшення маси міокарда та відносної товщини стінок лівого шлуночка), однак лерканідипін ефективніше впливає на структурні зміни сонних артерій (зменшення величини комплексу інтима-медіа та діаметру судин).
Застосування лерканідипіну, в порівнянні з бісопрололом, супроводжується більш вірогідним впливом на проліферативну (підвищення вмісту в крові фактора ангіогенезу) та антикоагулянтну (збільшення рівня протеїну С та зниження агрегаційної здатності тромбоцитів) функції ендотелію, проте бісопролол вираженіше покращує фібринолітичну активність (підвищення потенційної активності плазміногену), тому вибір препаратів для лікування хворих на гіпертонічну хворобу з супутньою стенокардією напруження необхідно проводити індивідуально, з урахуванням впливу лікарських засобів на функціональний стан ендотелію, структурні зміни сонних артерій, параметри ремоделювання лівого шлуночка.
ПРАКТИЧНІ РЕКОМЕНДАЦІІ
Для визначення прогнозу гіпертонічної хвороби та гіпертонічної хвороби за поєднаного перебігу зі стабільною стенокардією у схемі обстеження доцільно включати ЕхоКГ та кольорове дуплексне сканування екстракраніальних судин і при виборі терапії надавати перевагу препаратам із органопротекторними властивостями.
Збільшення діаметрів внутрішніх сонних артерій слід вважати ранньою ознакою судинного ремоделювання.
Прогностично несприятливими критеріями прогресування уражень органів-мішеней у хворих на гіпертонічну хворобу зі стабільною стенокардією слід вважати наступні прояви ендотеліальної дисфункції: зниження рівня фактора ангіогенезу, потенційної активності плазміногену, підвищення АДФ-індукованої агрегації тромбоцитів та зсуви в системі протеїну С.
У хворих на ГХ зі стабільною стенокардією рекомендовано використовувати бісопролол за схемою титрування 2,5-5-10 мг упродовж 12 тижнів із метою досягнення антигіпертензивного та антиішемічного ефектів, зменшення маси міокарда ЛШ та покращення функціонального стану ендотелію.
Призначення лерканідипіну в дозі 5-10-20 мг на добу впродовж 12 тижнів за умов досягнення цільового рівня АТ має позитивний вплив на структурні зміни СА, підсилює здатність ендотелію до регенерації та його антикоагулянтний потенціал у хворих на ГХ за поєднаного перебігу зі стабільною стенокардією.
ДРУКОВАНІ РОБОТИ ЗА ТЕМОЮ ДИСЕРТАЦІЇ
1. Тащук В.К., Шорікова Д.В., Гінгуляк М.О., Шоріков Є.І. Стан згортаючої, протизгортаючої, фібринолітичної систем крові, показники системного протеолізу на тлі структурних змін сонних артерій у хворих на гіпертонічну хворобу в поєднанні з ішемічною хворобою серця // Кровообіг та гемостаз. -2006. -№4. -С.39-42. (Здобувач здійснила підбір хворих та огляд літератури, підготувала статтю до друку. Співавтори: проф. Тащук В.К. надавав консультативну допомогу, лікар Гінгуляк М.О. проводила сонографічне дослідження, доц. Шоріков Є.І. здійснив статистичну обробку матеріалу).
2. Тащук В.К., Шорікова Д.В., Шоріков Є.І., Борейко Л.Д., Каленюк В.І. Вплив лерканідипіну та бісопрололу на проліферативну функцію ендотелію та процеси судинного ремоделювання у хворих на гіпертонічну хворобу при поєднаному перебігу з ішемічною хворобою серця // Клін. та експер. патологія. -2007. -№1. -С.109-112. (Здобувач провела клінічне обстеження хворих та оформила статтю. Співавтори: проф. Тащук В.К. редагував статтю, доц. Шоріков Є.І. надавав консультативну допомогу, доц. Борейко Л.Д. здійснила огляд літератури, доц. Каленюк В.І. сформулював висновки).
3. Шорікова Д.В. Ремоделювання сонних артерій за даними кольорового дуплексного сканування та проліферативна функція ендотелію у хворих на гіпертонічну хворобу при поєднаному перебігу з ішемічною хворобою серця // Бук. мед. вісник. –2007. -№2. -С.95-98.
4. Шорікова Д.В. Стан судинно-тромбоцитарного гемостазу за застосування лерканідипіну та бісопрололу у хворих на гіпертонічну хворобу зі стабільною стенокардією // Клін. та експер. патологія. -2007. -№3. -C.110-113.
5. Шорікова Д.В.,