Аденилатциклазный сигнальный механизм
АДЕНИЛАТЦИКЛАЗНЫЙ СИГНАЛЬНЫЙ МЕХАНИЗМ ДЕЙСТВИЯ ПЕПТИДОВ ИНСУЛИНОВОГО СУПЕРСЕМЕЙСТВА У ПОЗВОНОЧНЫХ И БЕСПОЗВОНОЧНЫХ
Автореферат
диссертации на соискание ученой степени
доктора биологических наук
Санкт-Петербург 2007
Актуальность проблемы
Изучение гормональных сигнальных систем, участвующих в регуляции жизненно важных для организма клеточных процессов, является одной из актуальных проблем современной молекулярной эндокринологии и биохимии. К числу систем, осуществляющих реализацию регуляторного действия веществ гормональной и негормональной природы, относится аденилатциклазная сигнальная система (АЦС), которая представлена в клетке сложным трансмембранным комплексом, состоящим, по крайней мере, из трех молекулярных блоков. Необходимыми компонентами АЦС являются: рецепторы, способные воспринимать внеклеточные сигналы, гетеротримерные ГТФ-связывающие белки (G-белки) стимулирующего (Gs) или ингибирующего (Gi) типа, состоящие из трех субъединиц – α, b, γ и обеспечивающие сопряжение между рецептором и третьим компонентом системы - ферментом аденилатциклазой (АЦ), катализирующей образование универсального внутриклеточного посредника – циклического аденозинмонофосфата (цАМФ). При его участии осуществляется реализация целого ряда регуляторных эффектов в клетке (пролиферация, дифференцировка, апоптоз, синтез белка и др.).
К настоящему времени в литературе накоплен значительный объем данных, свидетельствующих об участии АЦС и цАМФ в трансдукции сигналов группы гормонов не пептидной природы (серотонин, адреналин, норадреналин и др.), осуществляющих свой эффект на клетку через рецепторы серпантинного типа, семь раз пронизывающие мембрану. В рамках настоящего исследования мы предприняли попытку выяснить возможность участия АЦС в реализации действия пептидов инсулинового суперсемейства, обладающих рецепторами тирозинкиназного типа, один раз пронизывающими мембрану клетки. До исследований, проведенных нами, участие системы АЦС-цАМФ в реализации действия гормонов инсулиновой природы практически отрицалось. В литературе имелись лишь отдельные сведения о влиянии инсулина, бомбиксина, релаксина на активность АЦ (Pertseva et al., 2003; Patel, 2004). Несмотря на успехи, достигнутые за последние десятилетия в изучении молекулярных механизмов действия инсулина и инсулиноподобных пептидов, многие аспекты плейотропного действия этого гормона и родственных ему пептидов до сих пор остаются невыясненными (Pertseva et al., 2003; Телкова, 2005). В связи с этим изучение ранее неизвестных молекулярных механизмов действия пептидов инсулинового суперсемейства, насчитывающего в настоящее время около 50 представителей, относится к числу актуальных проблем современной эндокринологии. Согласно современным представлениям, инсулин и родственные ему пептиды играют ключевую роль в регуляции ряда клеточных процессов – клеточный рост, апоптоз, метаболизм. Эти пептиды имеют общее эволюционное происхождение, так как возникли в ходе эволюции из общего анцестрального гена в результате дупликации и последующей дивергенции образовавшихся генетических линий, сохранив при этом структурное и функциональное сходство (Murray-Rust et al., 1992; Chan et al., 1992).
К изучению участия АЦС в реализации действия гормонов и ростовых факторов инсулиновой природы лаборатория приступила в начале 90-х годов. Отправной точкой послужили данные, впервые полученные нами, о способности инсулина и родственных пептидов активировать ГТФ-зависимым образом АЦ в мышечных тканях млекопитающих и моллюсков (Plesneva et al., 1994). Мы использовали эволюционный подход, предложенный Л.А. Орбели (1958) применительно к эволюционной биохимии, который включал исследования в филогенезе, онтогенезе и при патологии. Было изучено: 1) влияние на АЦС инсулина, инсулиноподобного фактора роста 1 (ИФР-1) позвоночных и инсулиноподобного пептида (ИПП) беспозвоночных (моллюск Anodonta cygnea; 2) влияние на АЦС пептидов в тканях-мишенях животных разного филогенетического уровня (позвоночные – крысы, птицы и беспозвоночные – моллюски); 3) действие пептидов инсулинового суперсемейства на АЦС в онтогенезе (в тканях куриных эмбрионов разного возраста и у цыплят); 4) действие пептидов инсулинового суперсемейства на АЦС при экспериментальном диабете у позвоночных и беспозвоночных.
Цель работы. Доказать участие аденилатциклазной сигнальной системы в реализации регуляторных эффектов инсулина, ИФР-1, ИПП моллюска в клетке и расшифровать структурно-функциональную организацию АЦ сигнального механизма их действия в тканях позвоночных и беспозвоночных, а также установить роль АЦ сигнального механизма в регуляции фундаментальных клеточных процессов – клеточный рост, апоптоз.
Задачи исследования
1. Исследовать действие инсулина, ИФР-1 и ИПП, выделенного из висцеральных органов моллюска Anodonta cygnea (Русаков и др., 1991), на АЦС в мышечных тканях позвоночных и беспозвоночных. Охарактеризовать зависимость эффекта от времени и концентрации исследуемых пептидов, а также от присутствия гуаниновых нуклеотидов для подтверждения вовлеченности в АЦ сигнальный механизм гетеротримерных G-белков.
2. Исследовать структурно-функциональную организацию АЦ сигнального механизма, опосредующего эффекты пептидов инсулинового суперсемейства у позвоночных и беспозвоночных и выяснить последовательность этапов передачи регуляторных сигналов этих пептидов на АЦС.С этой целью: а) установить тип рецепторов и G-белков, вовлеченных в АЦ сигнальный механизм действия пептидов, используя ингибиторы рецепторных тирозинкиназ и метод АДФ-рибозилирования бактериальными токсинами; б) выявить участие фосфатидилинозитол-3 киназы (ФИ-3-К), используя специфичный ингибитор вортманнин; в) идентифицировать изоформу протеинкиназы «С» (ПКС); используя ингибиторы ПКС и моноклональные антитела к изоформам ПКС.
3. Исследовать участие АЦ сигнального механизма действия инсулина и ИФР-1 в регуляции процессов клеточного роста и апоптоза, исходя из гипотезы о важной роли цАМФ в регуляции фундаментальных процессов в клетке (Перцева, 2000).
4. Исследовать функциональные нарушения в АЦ сигнальном механизме действия пептидов инсулинового суперсемейства при эндокринной патологии – сахарный диабет 1-го и 2-го типов.
Научная новизна
Впервые обнаружено стимулирующее действие инсулина, ИФР-1 и ИПП моллюска A.cygnea на активность АЦ. Показано участие рецепторной тирозинкиназы и установлена вовлеченность G-белков (Gi) и (Gs) типа в реализацию активирующего действия этих пептидов на АЦ. Впервые показано, что в проявлении АЦ стимулирующих эффектов инсулина и ИФР-1 участвуют ФИ-3-К и изоформы ПКС - ПКСz и возможно ПКСε.
В мышечных тканях позвоночных и беспозвоночных животных обнаружен ранее неизвестный АЦ сигнальный механизм действия инсулина и ИФР-1 и установлена его структурно-функциональная организация, представленная в клетке следующей сигнальной цепью: рецептор тирозинкиназного типа Þ Gi-белок (bγ-димер) Þ ФИ-3-К Þ ПКСz (позвоночные) или ПКСε (беспозвоночные) Þ Gs-белок Þ АЦ Þ цАМФ Þ протеинкиназа «А» (ПКА) Þ эффекторные системы. Этот механизм отличается по числу сигнальных блоков от известного АЦ сигнального механизма действия гормонов, обладающих рецепторами серпантинного типа, представленного в клетке следующей цепью: рецептор серпантинного типа Þ G-белок (Gi или Gs) Þ АЦ Þ цАМФ Þ ПКА Þ эффекторные системы.
Следует отметить, что действие пептидов инсулиновой природы на АЦ в мышечной ткани моллюска осуществляется через АЦ сигнальный механизм, сходный с таковым позвоночных, но имеющий на пострецепторных этапах трансдукции гормонального сигнала отличие на уровне ПКС. Исходя из результатов нашего исследования, в АЦ сигнальном механизме действия пептидов инсулинового суперсемейства у позвоночных принимает участие ПКСζ, а у беспозвоночных (моллюски), как предполагается, – ПКСε.
Экспериментально подтверждена, выдвинутая нами гипотеза, о важной роли АЦ-цАМФ в реализации регуляторного действия инсулина и ИФР-1 на фундаментальные процессы в клетке. Показано участие АЦ-цАМФ системы в способности ИФР-1 и инсулина стимулировать клеточный рост и ингибировать апоптоз в культурах фибробластоподобных клеток.
Обнаружены нарушения в АЦ сигнальном механизме действия инсулина при патологии (сахарный диабет 1-го и 2-го типов).
Теоретическое и практическое значение работы
Теоретическое и практическое значение работы определяется важной ролью инсулина и других пептидов инсулинового суперсемейства в организме высших и низших животных. Обнаружение новых сигнальных механизмов действия пептидов этой группы, в частности инсулина и ИФР-1, расширяет современные представления о спектре сигнальных систем, участвующих в регуляторном действии пептидов инсулинового суперсемейства.
Применение эволюционного подхода (изучение ряда эволюционно-родственных пептидов и использование представителей позвоночных и беспозвоночных) позволило выявить консервативность обнаруженного АЦ сигнального механизма действия пептидов инсулиновой природы.
Данные, полученные на беспозвоночных, могут быть полезны для понимания сигнальных механизмов действия пептидов инсулинового суперсемейства у позвоночных и для разработки моделей эндокринной патологии у человека (сахарный диабет) в рамках нового направления - «эволюционная биомедицина» (Перцева, 2006).
Полученные данные о молекулярных механизмах действия инсулина и ИФР-1 имеют фундаментальное значение и могут применяться при чтении курса лекций в университетах и медицинских ВУЗах как в России, так и за рубежом.
Результаты исследования имеют важное практическое значение в плане выявления молекулярных основ этиологии и патогенеза сахарного диабета, а также в создании новых подходов для диагностики этого заболевания. Обнаруженный нами АЦ сигнальный механизм действия инсулина, может служить основой для разработки биохимического теста, позволяющего проводить диагностику нарушения отдельных звеньев в молекулярном механизме действия инсулина.
Положения, выносимые на защиту
1. Впервые установлено, что пептиды инсулинового суперсемейства (инсулин, ИФР-1 и ИПП моллюска Anodonta cygnea) ГТФ-зависимым образом активируют АЦ в тканях позвоночных (млекопитающие, птицы) и беспозвоночных (моллюски) животных.
2. Реализация АЦ активирующего действия пептидов инсулиновой природы осуществляется через обнаруженный нами АЦ сигнальный механизм, включающий следующую сигнальную цепь: рецептор-тирозинкиназа Þ Gi-белок (βγ-димер) Þ ФИ-3-К Þ ПКСz Þ Gs-белок Þ АЦ.
3. С участием АЦ сигнального механизма, генерирующего цАМФ, осуществляется регуляторное действие пептидов инсулиновой природы на фундаментальные клеточные процессы - стимулируется клеточный рост и ингибируется апоптоз.
4. При эндокринной патологии (сахарном диабете 1-го и 2-го типов) нарушается функционирование АЦ сигнального механизма действия гормонов инсулиновой природы в основном на уровне Gs-белка и его сопряжения с АЦ.
5. Сходство структурно-функциональной организации АЦ сигнального механизма действия пептидов инсулинового суперсемейства у позвоночных и беспозвоночных животных свидетельствует об его эволюционной консервативности.
Апробация работы
Основные результаты и положения работы были представлены и доложены на следующих конференциях и съездах: 17-я, 19-я, 20-я, 21-я Конференции Европейского Общества Эндокринологов (Кордова, Испания, 1994; Нидерланды, 1998; Фаро, Португалия, 2000; Бонн, Германия, 2002); 4-й Симпозиум по нейробиологии моллюсков (Амстердам, Нидерланды, 1994); Симпозиум по инсулину, ИФР-1 и инсулиноподобным пептидам (Испания, Барселона, 1997); XXXIII Международный конгресс физиологов (Санкт-Петербург, 1997); 2-й съезд Биохимического Общества РАН (Москва, 1997); XVII съезд физиологов России (Ростов-на-Дону, 1998); конференция “Рецепция и внутриклеточная сигнализация” (Пущино, 1998); Съезд Биохимического общества Университета Глазго (Глазго, Великобритания, 1999); 18-ый Международный конгресс биохимиков и молекулярных биологов (Бирмингем, Англия, 2000); 3-я и 4-я Международные конференция по релаксину и родственным пептидам (Брум, Австралия, 2000; Виоминг, США, 2004); XVIII Съезд Физиологического Общества имени И.П. Павлова, Казань, 2001); XI, XII и XIII Международные совещания по эволюционной физиологии (Санкт-Петербург, 1996; 2001; 2006); Международная Европейская конференция (Люксембург, 2002); Вторая конференция “Эндокринная регуляция физиологических функций в норме и патологии”, посвященная 80-летию со дня рождения М.Г. Колпакова. (Новосибирск. Октябрь, 2002); 1-й съезд Общества Клеточных Биологов (Санкт-Петербург, 2003); Физиологический съезд (Екатеринбург, 2004); 1-й Съезд физиологов СНГ (Сочи, Дагомыс, 2005);
Публикации. По теме диссертации опубликовано 75 работ, в том числе 36 статей в рецензируемых отечественных и международных изданиях.
Личный вкладавтора – Экспериментальные данные получены лично автором или при его непосредственном участии.
Структура и объем диссертации.Диссертация изложена на 259страницах, состоит из введения, обзора литературы, описания материалов и методов,изложения результатов их обсуждения, заключения, выводов и списка литературы, включающего 285 источников. Работа иллюстрирована 43рисунками и 35 таблицами.
Основное содержание работы
Объекты и методы исследования. Объектами исследования служили: 1) представители позвоночных - крысы Ratus norvegicus линии Wistar; 2) куры породы русская белая «Леггорн»; 3) представители беспозвоночных - пресноводный двустворчатый моллюск Anodonta cygnea; 4) культура клеток миобластов куриных эмбрионов; 5) фибробластоподобная культура клеток линии Swiss 3T3; 6) культура клеток, трансформированная из нормальных фибробластов линии Е1А+сНа-ras (клетки, впадающие в апоптоз) и E1A+E1B (клетки, не впадающие в апоптоз).
Методы. В работе использован широкий спектр физиологических, биохимических и фармакологических методов:
- выделение фракций плазматических мембран мышечной ткани позвоночных и беспозвоночных животных с использованием метода дифференциального центрифугирования (Kidwai et. al., 1973 с нашими модификациями);
- выделение частично очищенных мембранных фракций культуры клеток миобластов куриных эмбрионов, фибробластоподобных клеток линии Swiss 3T3, E1A+cHa-ras, E1A+E1B (Плеснёва и др., 1999; 2003);
- выделение фракции, содержащей примембранную форму цАМФ-ФДЭ (Houslay, 1985).
- определение активности АЦ с использованием радиоактивного субстрата АЦ реакции - (α32P)АТФ (Salomon et al., 1974 с некоторыми модификациями);
- определение активности цАМФ-ФДЭ, с использованием радиоактивного субстрата (3H)цАМФ (Ткачук и др., 1978);
- АДФ-рибозилирование гетеротримерных G-белков холерным и коклюшным токсинами (Pertseva et al., 1992);
- электрофорез в ПААГ
- иммуноблотинг с использованием моноклональных антител для идентификации изоформы ПКСζ;
- определение ростстимулирующей активности действия инсулина, ИФР-1, ЭФР и цАМФ по включению (14C) тимидина в ДНК культуры клеток Swiss3T3 (Баркан и др. 1992; Плеснёва и др., 1997; 1999);
- использование модели апоптоза на трансформированных клетках, полученных из нормальных эмбриональных фибробластов введением пары комплементирующих онкогенов E1A+cHa-ras, обладающих высокой проапототической чувствительностью к удалению ростовых факторов (Bulavin et.al., 1999) и ее характеристика (Плеснёва и др., 2003);
- оценка антиапоптотического действия инсулина, ИФР-1 и цАМФ с использованием метода клоногенной выживаемости культуры клеток E1A+cHa-ras (Плеснёва и др., 2003);
- определение активности ферментов углеводного метаболизма – гликогенсинтетазы и глюкозо-6-фосфат-дегидрогеназы (Кузнецова, 1998; Кузнецова и др., 2004);
- определения содержания белков методом Лоури;
- создания моделей экспериментального диабета 1-го и 2-го типов у позвоночных (Ping et al., 1999 с нашими модификациями) и диабетоподобного состояния у беспозвоночных (Плеснева и др., 2006; Кузнецова и др., 2007) с использованием стрептозотоцина.
- статистические методы обработки данных по программам (Statgraph и Anova).
Результаты исследования и их обсуждение
В работе представлены экспериментальные доказательства активирующего действия инсулина, ИФР-1 и ИПП на АЦ, установлена структурно-функциональная организация АЦ сигнального механизма в клетке и его роль в регуляции пептидами инсулиновой природы клеточного роста и апоптоза.
Основные этапы работы состояли в исследовании:
- действия пептидов инсулиновой природы на активность АЦ при разном времени и разной концентрации invitro и invivo
- участия примембранной цАМФ-ФДЭ в функционировании АЦ сигнального механизма действия инсулиноподобных пептидов;
- звеньев АЦ сигнального механизма (от рецептора до эффекторных систем);
- роли АЦ сигнального механизма, как в регуляции клеточных процессов, так и его функционального применения в условиях патологии;
Влияние in vitro инсулина, ИФР-1 и ИПП на активность АЦ в тканях позвоночных и беспозвоночных и в культурах клеток в разные временные сроки
Проведено исследование in vitro динамики во времени АЦ активирующего эффекта инсулина, ИФР-1 и ИПП моллюска при концентрации пептидов 10-8М и для сравнения эпидермального ростового фактора (ЭФР), пептида не инсулиновой природы, обладающего рецептором тирозинкиназного типа (Никольский и др., 1987). Показано, что в мембранной фракции скелетных мышц крыс наибольшее выраженное активирующее действие исследованных пептидов на АЦ проявляется через 2.5 мин. Активирующий АЦ эффект инсулина составляет +236%. Эффект менее выражен при действии ИФР-1 (+201%), ЭФР (+186%) и ИПП моллюска +124% (Рис. 1; Таблица 1).

Рис. 1. Концентрация пептидов – 10-8М Активация АЦ пептидами (в%) по сравнению с базальной активностью фермента, принятой за 100%, приведена в тексте. Различия достоверны (р<0.05)
Таблица 1.Динамика во времени действия ИФР-1 на активность АЦ в мембранной фракции скелетных мышц крыс
| Воздействия | Активность АЦ (пкмоль цАМФ/мин/мг белка) | ||
| 2.5 мин | 5 мин | 10 мин | |
| Без ИФР-1 | 71.2±4.8 (100%) | 85.11±3.3 (100%) | 101.20±9.24 (100%) |
| + ИФР-1 | 214.31±12.1 (301%) | 136.16±5.2 (160%) | 96.14±4.6 (95%) |
Примечание: В скобках - базальная активность АЦ (без воздействий), принятая за 100% и активность АЦ (в%) при действии ИФР-1
В мембранной фракции культуры куриных миобластов показано (рис. 2), что стимулирующий АЦ эффект инсулина через 2.5 мин составляет +256%, по сравнению с базальной активностью, принятой за 100% и имеет сходство с данными, полученными на мембранной фракции скелетных мышц крыс (+236%) (рис. 1).
В тканях моллюска A.cygnea, ИПП, выделенный из висцеральных органов этого моллюска, оказывает наиболее выраженное активирующее действие на АЦ (+422%), по сравнению с ЭФР (+221%), ИФР-1 (+169%) и инсулином (+133%) (Рис. 3; Таблица 2). Следует отметить, что активирующий АЦ эффект исследуемых пептидов в наибольшей степени проявляется через 2,5 мин, через 5 мин снижается, а через 10 минут практически отсутствует (Таблица 2; Рис. 3).
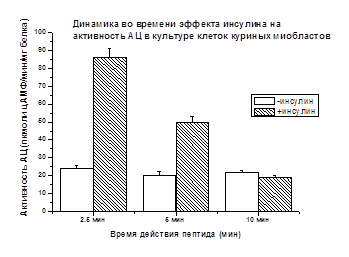
Рис. 2. Концентрация инсулина 10-8М. Различия достоверны (р<0.05)
Таблица 2.Динамика во времени действия ИФР-1 на активность АЦ в мембранной фракции гладких мышц моллюска
| Воздействия | Активность АЦ (пкмоль цАМФ/мин/мг белка) | ||
| 2.5 мин | 5 мин | 10 мин | |
| Без ИФР-1 | 110.21±10.8 (100%) | 125.31±9.3 (100%) | 106.04±6.6 (100%) |
| + ИФР-1 | 259.92±11.4 (269%) | 229.31±5.2 (183%) | 103.81±5.8 (98%) |
Примечание – как в таблице 1.
Таким образом, в мембранных фракциях, выделенных из мышечных тканей исследуемых животных и культуры клеток куриных миобластов, наблюдается закономерность проявления эффекта пептидов в зависимости от времени действия. Инсулин, ИФР-1, ИПП и ЭФР оказывают активирующее действие на АЦ в течение 2,5 и 5 мин с максимальным эффектом через 2.5 мин. АЦ активирующий эффект исследуемых пептидов видоспецифичен. В скелетных мышцах крыс ряд эффективности пептидов по их влиянию на АЦ имеет следующий порядок: инсулин > ИФР-1 > ЭФР > ИПП, а в мышечных тканях моллюска - ИПП > ЭФР > ИФР-1 > инсулин.

Рис. 3. Концентрация пептидов – 10-8 М Активация АЦ пептидами (в %) по сравнению с базальной активностью фермента, принятой за 100%, приведена в тексте. Различия достоверны (р<0.05)
Влияние in vivo разных доз инсулина на активность АЦ в тканях позвоночных и беспозвоночных в разные временные сроки
Обнаружив в опытах in vitro стимулирующее влияние пептидов инсулинового суперсемейства на активность АЦ, мы исследовали влияние инсулина, основного представителя инсулинового суперсемейства, на активность АЦ в разных дозах и при разном времени действия в условиях in vivo. Эксперименты проведены на фракциях мышечных мембран крыс, куриных эмбрионов и моллюсков после введения инсулина (внутрибрюшинно или внутрижелточно) в дозах 0.05 нг/г-10 нг/г веса тела (вес крысы или куриного эмбриона, вес моллюска без раковины). Доза, вводимого in vivo инсулина рассчитывалась с учетом концентрации инсулина, используемой в опытах in vitro. Основанием для выбора дозы служили данные литературы и результаты наших опытов in vitro. Было показано, что в скелетных мышцах крыс стимулирующий АЦ эффект инсулина (+222%) выявляется через 5 мин после введения гормона (1 нг/г), а через 15 мин он снижается почти в три раза (67%) (Рис. 4). При более высокой дозе инсулина (10 нг/г), стимулирующий АЦ эффект гормона через 5 мин выражен слабее (+124%), а через 15 мин отсутствовал.
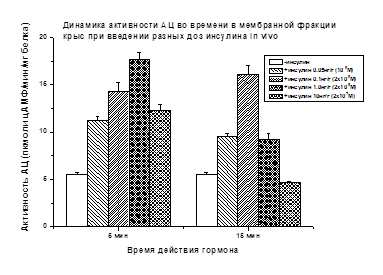
Рис. 4. Активация АЦ пептидами (в %) по сравнению с базальной активностью АЦ, принятой за 100%, приведена в тексте. Различия достоверны (р<0.05)
В экспериментах in vivo в мембранных фракциях мышц куриных эмбрионов разного возраста обнаружен АЦ активирующий эффект инсулина. У 10-дневных куриных эмбрионов он выявлялся уже через 5 мин, более четко выражен через 15 мин, а через 30 мин не проявлялся (рис. 5).

Рис. 5. Различия достоверны (р<0.05)
У 17-дневных куриных эмбрионов выявлено дозозависимое активирующее действие инсулина на активность АЦ через 5 минут (Рис. 6), которое ослабевает через 15 и 30 мин после введения гормона.

Рис. 6. Различия достоверны (р<0.05)
При введении моллюскам инсулина (0.5 нг/г и 5.0 нг/г) активность АЦ возрастала через 5 мин после введения гормона на +49% и +381%, соответственно, по сравнению с контролем, принятым за 100%. Через 20 мин влияние гормона (0.5 нг/г) на активность АЦ снижается (+22%) и практически исчезает (+6%) через 40 мин (Рис. 7). При введении инсулина (5 нг/г) моллюскам АЦ стимулирующий эффект гормона через 20 мин составлял +110%, а через 40 мин +50% (рис. 7).

Рис. 7. Светлые столбики - базальная активность АЦ. Заштрихованные столбики - инсулин-стимулированная активность АЦ при разных дозах гормона. Различия достоверны (р<0.05)
Из полученных нами данных следует, что отчетливое влияние инсулина на активность АЦ в мышечных мембранах моллюска (Рис. 7) выявляется при более высокой дозе инсулина, чем у млекопитающих и птиц. Это можно объяснить тем, что у моллюска A.cygnea рецепторы к инсулину не обнаружены (Лейбуш, Чистякова, 2003), а эффект инсулина может реализовываться через ИФР-1 - подобные рецепторы или рецепторы ИПП моллюска, которые способны опосредовать активирующее влияние инсулина на АЦ (Шпаков и др., 2005).
Следует отметить, что проявление АЦ стимулирующего влияния инсулина и инсулиноподобных пептидов во времени имеет сходство в опытах in vitro и in vivo. АЦ активирующий эффект пептидов отчетливо выявляется при коротких сроках влияния пептида (2,5 и 5 мин) при физиологических концентрациях (10-9-10-8М), с увеличением времени действия эффект пептидов ослабевает или отсутствует.
АЦ активирующий эффект инсулина, ИФР-1 и ИПП при разных концентрациях в условиях in vitro
Установив оптимальное время действия пептидов инсулинового суперсемейства, при котором происходит активация АЦС (2.5 мин), необходимо было выявить при каких концентрациях АЦ стимулирующий эффект пептидов наиболее выражен. В разных тканях стимулирующий эффект пептидов инсулиновой природы осуществляется через специфичные рецепторы, отличающиеся по сродству к пептиду в гомологичных и негомологичных пептиду тканях.
Проведено исследование влияния инсулина, ИФР-1, ИПП моллюска и ЭФР в течение 2.5 мин при разных концентрациях (10-12-10-6М) в мембранных фракциях крыс, кур, моллюсков, а также во фракции, выделенной из культуры клеток куриных миобластов.
В мембранной фракции скелетных мышц крыс стимулирующий АЦ эффект инсулина, ИФР-1, ИПП обнаруживается при концентрациях - 10-11-10-7М (Рис. 8). Наиболее выраженный АЦ стимулирующий эффект составляет: для инсулина +250% при 10-8М; для ИФР-1 +91% при 10-9М; для ИПП +111% при 10-8М; для ЭФР +190% при 10-10М. (Рис. 8).
Можно отметить, что в диапазоне концентраций 10-10-10-7М наиболее четко выражен активирующий АЦ эффект инсулина, эффекты других исследованных пептидов инсулиновой природы проявлялись слабее. АЦ стимулирующий эффект ЭФР проявлялся при более низких концентрациях (10-11-10-10М).
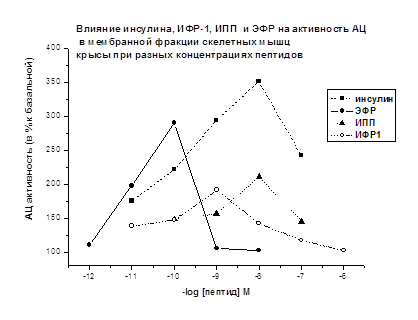
Рис. 8. Базальная активность АЦ принята за 100%. Время действия пептидов 2.5 мин
Таблица 3.Влияние in vitro разных концентраций инсулина на активность АЦ во фракциях мышечных мембран куриных эмбрионов разного возраста и цыплят
| Объекты (возраст) | 10-сут Эмбрионы | 13-сут Эмбрионы | 16-сут Эмбрионы | Цыплята 3-сут |
| Воздействия | Активность АЦ (пмоль цАМФ/мин/мг белка) В скобках – Активность АЦ (в%) в присутствии инсулина, по отношению к базальной активности, принятой за 100%. | |||
Без Инсулина | 14.02±1.10 (100%) | 3.90±0.45 (100%) | 2.01±0.09 (100%) | 8.52±0.41 (100%) |
+инсулин 10-11 М | 16.34±1.35 (117%) | 4.21±0.34 (108%) | 4.81±0.46 (239%) | 10.11±0.55 (119%) |
+ инсулин 10-10 М | 39.14±1.93 (279%) | 10.33±0.89 (265%) | 5.28±0.30 (263%) | 11.24±0.48 (132%) |
+ инсулин 10-9 М | 48.25±2.21 (344%) | 15.92±1.24 (408%) | 10.24±0.62 (509%) | 14.54±0.82 (171%) |
+ инсулин 10-8 М | 19.87±1.44 (142%) | 9.84±0.56 (252%) | 9.92±0.47 (494%) | 19.55±1.13 (238%) |
+ инсулин 10-7 М | 17.13±0.98 (122%) | 4.93±0.45 (126%) | 7.51±0.33 (374%) | 22.21±1.37 (261%) |
+ инсулин 10-6 М | 17.90±1.12 (128%) | 5.12±0.21 (131%) | 1.95±0.22 (97%) | 24.39±1.62 (286%) |
Изучение АЦ стимулирующего эффекта пептидов инсулинового суперсемейства и ЭФР в онтогенезе позволило выявить следующие факты. Наиболее выраженный АЦ активирующий эффект инсулина (10-11М-10-6М обнаруживается у куриных эмбрионов (10, 13, 16 суток) и цыплят (3 суток) при концентрации гормона 10-9М, и составляет у 10-суточных эмбрионов +244%, у 13-суточных +308%, у 16-суточных +409% (Таблица 3), а у 3-х суточных цыплят (+186%) при более высокой концентрации 10-6М, что может быть связано с переходом эмбрионов в постэмбриональный период, когда процессы роста и дифференцировки заканчиваются.
Проведенные нами исследования действия инсулина и ИФР-1 на активность АЦ в мембранной фракции, выделенной из культуры клеток куриных миобластов (4-й день развития) показали, что наибольший АЦ стимулирующий эффект инсулина (+352%) выявляется при концентрации 10-9М, а ИФР-1 (+289%) при концентрации 10-10М (данные в диссертации).
В мембранной фракции мышц моллюска АЦ стимулирующий эффект инсулина, ИФР-1, ИПП и ЭФР выявляется при концентрациях - 10-11-10-8М (Рис. 9). Инсулин и ИФР-1 оказывают наиболее выраженное стимулирующее действие на активность АЦ при концентрации 10-8М (+63% и +54%, соответственно), а ИПП и ЭФР при 10-9М (+415% и +223%, соответственно).
Таким образом, определен диапазон концентраций, при которых проявляется АЦ активирующий эффект исследуемых пептидов. Следует отметить видоспецифичность действия пептидов. Действие ИПП, выделенного из висцеральных ганглиев моллюска A.cygnea, является более эффективным в ткани моллюска и менее эффективным в тканях позвоночных.

Рис. 9. Базальная активность АЦ принята за 100%. Время действия пептидов – 2.5 мин.
Участие ц-АМФ-зависимой ФДЭ в механизме действия пептидов инсулинового суперсемейства
Уровень цАМФ в клетке зависит не только от АЦ – фермента, осуществляющего его синтез, но и от фосфодиэстеразы (ФДЭ) - фермента, обеспечивающего его деградацию. Исследована динамика во времени активности примембранной формы цАМФ-ФДЭ во фракции скелетных мышц кур. Эта изоформа ФДЭ локализована на внутренней стороне мембраны и способна активироваться инсулином (Houslay, 1985). Нами показано, что активность примембранной цАМФ-ФДЭ не изменяется через 2.5 и 5.0 мин после действия инсулина, увеличивается на +115% через 10 мин и на +179% через 20 мин, по сравнению с базальной активностью фермента, принятой за 100% (Таблица 4).
Таблица 4.Влияниеинсулина (10-8М) на активность примембранной цАМФ-ФДЭ в скелетных мышц кур в зависимости от времени
| Воздействия | Активность цАМФ-ФДЭ (нмоль АМФ/мин/мг белка) | |||
| 2.5 мин | 5.0 мин | 10.0 мин | 20.0 мин | |
| Без инсулина | 3.37±0.5 (100%) | 3.70±0.33 (100%) | 3.56±0.61 (100%) | 3.21±0.28 (100%) |
| + инсулин | 3.06±0.21 (91%) | 4.07±0.18 (110%) | 7.65±0.23 (215%) | 8.95±0.44 (279%) |
Примечание: в скобках представлена активность цАМФ-ФДЭ (в%) в присутствии инсулина и базальная активность фермента, принятая за 100%
При исследовании действия разных концентраций инсулина (10-9М-10-7М) обнаружено, что наиболее выраженное действие гормона (+115%) на активность цАМФ-ФДЭ выявляется через 10 мин при концентрации 10-8М (данные в диссертации).
Соотношение активности систем АЦ-цАМФ и цАМФ-ФДЭ в реализации действия инсулина на клетку является важным моментом в понимании внутриклеточных механизмов функционирования пептидов инсулиновой природы.
При активации АЦ гормонами скорость синтеза цАМФ начинает превышать скорость его деградации. Повышение уровня цАМФ приводит к активации мишени его действия - ПКА. Сродство ПКА к цАМФ в 100-1000 раз больше, чем у ФДЭ. При усилении синтеза цАМФ происходит сначала насыщение цАМФ-регуляторных центров ПКА, и лишь затем гидролиз цАМФ с участием ФДЭ.
Исходя из представленных нами данных, активирующие эффекты инсулина на АЦ и цАМФ-ФДЭ четко разделены во времени. АЦ активирующий эффект инсулина проявляется через 2.5 и 5 мин и отсутствует через 10 мин. Между тем, цАМФ-ФДЭ активируется инсулином только через 10 минут инкубации с гормоном. Таким образом, активация цАМФ-ФДЭ наступает лишь тогда, когда цАМФ как вторичный посредник выполнит свою функцию, достигнет порогового уровня и осуществит свое активирующее действие на ПКА, а затем и на эффекторные системы (Ткачук, 1983), что согласуется с нашими данными о действии инсулина на активность АЦ и цАМФ-ФДЭ и данными литературы.
В связи с этим основное внимание будет уделено исследованию АЦС, участвующей в осуществлении регуляторного действия пептидов инсулинового суперсемейства на клеточные процессы.
Использование антиинсулиновой сыворотки для доказательства специфичности АЦ стимулирующего эффекта инсулина
Для доказательства АЦ стимулирующего действие инсулина, а не других пептидных гормонов, не относящихся к гормонам инсулинового суперсемейства, была использована анти-инсулиновая сыворотка (АИС), выработанная в лаборатории на инсулин млекопитающих, которая нейтрализует действие инсулина и, как установлено нами подавляет стимулирующее действие инсулина на АЦ. При добавлении нормальной сыворотки (без инсулина) к фракции скелетных мышц крыс и гладких мышц моллюска, активирующий АЦ эффект инсулина составляет +68% у крыс и +41% у моллюсков. При использовании АИС стимулирующий АЦ эффект инсулина отсутствует у крыс (+7%) и моллюсков (-5%) (Табл. 5).
Полученные данные свидетельствуют о том, что обнаруженное нами активирующее действие инсулина на АЦ в мышечных тканях исследуемых объектов осуществляется именно инсулином и является специфичным при действии этого гормона.
Таблица 5. Нейтрализация АЦ стимулирующего эффекта инсулина в мембранных фракциях скелетных мышц крыс и гладких мышц моллюска в присутствии антиинсулиновой сыворотки
| Воздействия | Активность АЦ (пкмоль цАМФ/мин/мг белка) | |
| Нормальная сыворотка | Анти-инсулиновая сыворотка | |
| Гладкие мышцы моллюска Anodonta cygnea | ||
| Без инсулина | 111.18±6.13 (100%) | 148.29±4.31 (100%) |
Инсулин 10-8М | 156.76±8.54* (141%) | 158.67±8.16 (107%) |
| Скелетные мышцы крысы | ||
| Без инсулина | 97.34±4.58 (100%) | 115.82±6.49 (100%) |
Инсулин 10-8М | 163.49±6.17* (168%) | 110.03±7.12 (95%) |
Примечание: приведены данные из трех независимых экспериментов, повторенных три раза. Значения представлены в виде среднего арифметического с учетом ошибки среднего. Различия достоверны (р< 0.05 (*). В скобках – активность АЦ в %. Базальная активность принята за 100%.
Следующая часть работы посвящена расшифровке структурно-функциональной организации механизма АЦ активирующего действия инсулина и ИФР-1.
В этой части работы мы поэтапно исследовали звенья, которые могут быть вовлечены в реализацию действия инсулиноподобных пептидов, начиная от рецептора и заканчивая эффекторными системами, которые являются конечным звеном реализации сигнала.
Участие рецептора тирозинкиназного типа в реализации АЦ стимулирующего эффекта пептидов инсулинового суперсемейства
Для доказательства участия рецептора