Термодинамическая оптимизация процессов разделения
МОСКОВСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ИНЖЕНЕРНОЙ ЭКОЛОГИИ
Кафедра: ТКА
Реферат на тему:
«Термодинамическая оптимизация процессов разделения».
Выполнил: Барбот А.В.
Москва, 2004 г.
Содержание:
1. Введение. 3
2. Классификация процессов разделения. 4
3. Термодинамическое описание систем разделения. 5
4. Постановка задач оптимизации. 11
5. Заключение. 13
6. Список литературы.. 14
1. Введение
Процессы разделения являются едва ли не самыми энергоемкими и очень разнообразными по своему конструктивному исполнению: мембранные, абсорбционно- и адсорбционно-десорбционные процессы, ректификация, центрифугирование, выпарка, вымораживание, и пр. Оценка минимальной энергии, потребной для разделения смеси того или иного состава, представляет большой интерес. Такую оценку работы разделения дают методы обратимой термодинамики, однако обратимые оценки очень грубы, поэтому важно приблизить оценки к реальности за счет учета конечной продолжительности процессов или заданной интенсивности, что позволяет учесть значения коэффициентов тепло- и массопереноса и связанные с из увеличением затраты. При этом желательно сохранить то преимущество обратимых оценок, что они не зависят от конструктивного оформления процесса (1).
Способом решения задачи оптимизации технологического процесса в режиме реального времени является её разбиение на два уровня. На первом (верхнем) проводится статическая оптимизация в соответствии с выбранным критерием по его математической модели, а на втором (нижнем) - нахождение оптимальных настроек управляющих устройств (например, ПИ-регуляторов) на основе линеаризованной в окрестности рабочей точки динамической модели. Взаимодействие между уровнями заключается в выдаче верхним уровнем оптимальных режимных параметров в качестве задания нижнему уровню.
Для построения такой системы необходимо знать предельные возможности процесса и соответствующий им режим при тех или иных значениях изменяющихся факторов. В качестве предельных возможностей ниже понимается максимальная производительность оптимизируемого процесса разделения при заданных составах потоков и затратах энергии или, что то же самое минимум расхода энергии для заданной производительности и составах.
С этой точки зрения представляет большой интерес оценка минимальной энергии, требуемой для разделения смеси того или иного состава. Если она известна, то можно оценить совершенство существующих технологий и конструкций аппаратов, используемых для разделения смесей.
Такую оценку дают методы обратимой термодинамики. В частности, для смесей, близких по своим свойствам к идеальным газам, в изотермических процессах такую оценку дает обратимая работа разделения.
В одних процессах разделения потребляемая энергия представляет собой механическую работу (например, в мембранных), в других используют тепловую энергию (например, в ректификации). Обратимая оценка для затрат тепла в этом процессе может быть найдена через обратимую оценку для работы разделения и КПД Карно.
Недостатком обратимых оценок является то, что они очень занижены, реальные затраты энергии могут оказаться существенно большими. Обратимые оценки соответствуют сколь угодно малой интенсивности процессов, значит и сколь угодно малой производительности. Они не учитывают кинетических факторов (коэффициентов тепло- и массопереноса, зависящих от конструкции и размеров аппарата). Более того, зависимость реальных затрат энергии для разделения исходной смеси на смеси с фиксированными составами от состава исходной смеси может иметь качественно иной вид, чем обратимая оценка. Например, при разделении двухкомпонентной смеси на чистые компоненты при малой концентрации одного из них обратимая оценка работы разделения будет стремиться к нулю, в то время как реальные затраты энергии могут быть весьма значительны. Поэтому важно приблизить оценки к реальности за счет учета конечной продолжительности процессов или заданной их интенсивности, что позволит учесть значения коэффициентов тепло- и массопереноса и связанные с их изменением затраты.
При нахождении оценок, учитывающих заданную интенсивность процесса, желательно сохранить то преимущество обратимых оценок, что они лишь косвенно зависят от конструктивного оформления процесса. Такая задача характерна для термодинамики конечного времени, исследующей предельные возможности термодинамических процессов с учетом ограничений на их продолжительность.
Получение оценок предельных возможностей процессов разделения с ненулевой производительностью позволяет:
· cвязать эффективность процесса с его режимными и конструктивными параметрами;
· выяснить какой из способов разделения с той или иной точки зрения предпочтительнее;
· найти максимально возможную производительность процесса и режим, ей соответствующий;
· синтезировать систему автоматического управления, поддерживающую показатели эффективности процесса (производительность, удельные затраты энергии) на уровне выбранных оптимальных значений.
2. Классификация процессов разделения
Процессы разделения являются процессами химической технологии. Также как и в процессах химической технологии среди них можно выделить пять основных групп (2).
Первая группа - гидромеханические процессы, скорость которых определяется законами гидродинамики. К ним относятся осаждение взвешенных в жидкой или газообразной среде частиц под действием силы тяжести, центробежной силы или сил электрического поля, фильтрование жидкостей или газов под действием разности давлений.
Вторая группа – тепловые процессы, скорость которых определяется законами теплопередачи. В эту группу входят процессы выпаривания, конденсации и др.
Третья группа – массообменные (диффузионные) процессы. Скорость этих процессов определяется скоростью перехода веществ из одной фазы в другую, т.е. законами массопередачи. К диффузионным процессам относятся абсорбция, адсорбция, ректификация, экстракция, сушка и др.
Четвертая группа – химические процессы, связанные с превращением веществ и изменением их химических свойств. Скорость этих процессов определяется закономерностями химической кинетики.
Пятая группа – механические процессы – включает классификацию сыпучих материалов.
Рассмотрим описанные выше процессы разделения.
1. Осаждение. К важнейшим техническим способам осаждения относятся: осаждение под действием силы тяжести (отстаивание), осаждение под действием центробежной силы и осаждение по действием сил электрического поля.
2. Фильтрование – разделение суспензий или пылей с помощью пористой перегородки – фильтра, способной задержать взвешенные частицы, находящиеся в жидкости или газе. Различают фильтрование под действием перепада давления и центробежное фильтрование (центрифугирование).
3. Конденсация – ожижение паров различных веществ путем отвода от них тепла. Различают поверхностную конденсацию и конденсацию смешением.
4. Выпаривание – процесс концентрирования растворов твердых нелетучих веществ путем удаления жидкого летучего растворителя в виде паров.
5. Абсорбция – поглощение газов или паров из газовых или паровых смесей жидкими поглотителями, называемыми абсорбентами. Десорбция – выделение абсорбированных компонентов из жидкости. Различают физическую абсорбцию и хемосорбцию.
6. Ректификация – разделение жидких однородных смесей на составляющие вещества или группы веществ в результате противоточного взаимодействия паровой смеси и жидкой смеси.
7. Экстракция – извлечение одного или нескольких растворенных веществ из одной жидкости другой жидкостью, практически не смешивающейся (или частично смешивающейся) с первой. Один из основных (наряду с ректификацией) способов разделения жидких однородных смесей.
8. Сублимация – перенос вещества из твердой фазы в паровую, миную жидкую. Для сублимации характерна обратимость процесса. Благодаря этому возможно выделение сублимацией из смеси твердых веществ одного или нескольких компонентов, а затем в других условиях десублимация их, т.е. выделение нужного компонента из паровой фазы в чистом виде.
9. Адсорбция – поглощение газов или паров из газовых смесей или растворенных веществ из растворов твердыми поглотителями, называемыми адсорбентами. Особенностью процессов адсорбции являются избирательность и обратимость.
10. Сушка – процесс удаления влаги из твердых влажных материалов путем ее испарения и отвода образующихся паров.
11. Процессы мембранного разделения смесей, или мембранные процессы - процессы разделения смесей посредством полупроницаемых мембран (обратный осмос, ультрафильтрацию, испарение через мембрану, диализ, электродиализ, диффузионное разделение газов).
12. Классификация – процесс разделения однородного сыпучего материала по размерам кусков (частиц).
По виду затрачиваемой энергии процессы разделения можно на:
1. Механические процессы разделения - затрачивается только механическая работа (мембранное разделение, фильтрование, осаждение);
2. Термические процессы разделение (ректификация, выпаривание, сублимация, конденсация);
3. Электрические процессы разделения (некоторые процессы мембранного разделения, осаждение под действием электрического поля);
В установках центрифугирования, мембранного разделения, в циклах адсорбции-десорбции, работающих за счет изменения давления, затрачивается только работа (механическое разделение), в процессах абсорбционно-десорбционных, ректификации и др. - только тепло (термическое разделение). В некоторых случаях число отводимых и подводимых потоков может быть больше (равно m), однако в этих случаях можно, как правило, представить систему разделения как соединение отдельных блоков, каждый из которых имеет структуру, представленную на рис. 1.
3. Термодинамическое описание систем разделения
Термодинамика при конечном времени (ТВК) используется для анализа, оценки предельных возможностей и выявления направлений совершенствования различных технологических процессов.
К типовым задачам ТВК относится составление балансовых уравнений для вещества, энергии и энтропии внешних по отношению к процессу потоков.
Уравнения термодинамических балансов – материальных, энергетического и энтропийного - связывают между собой параметры входных и выходных потоков в стационарном режиме. Балансовые уравнения позволяют выявить зависимость между параметрами внешних потоков (расходами, концентрациями, температурами, давлениями и т.д.) и количеством производимой в процессе энтропии. В обратимых процессах производство энтропии равно нулю, в необратимых – больше нуля. Отсюда следуют ограничения, накладываемые на входные потоки – выделяется множество достижимости в пространстве параметров входных и выходных потоков. Если же на систему наложить дополнительное условие заданной средней интенсивности или конечной продолжительности, то можно найти минимально возможное при данных ограничениях производство энтропии (рассеяние энергии). В реальных системах производство энтропии меньше минимально возможного, что сужает область достижимости.
Основываясь на балансовых уравнениях, можно исследовать характер зависимостей между традиционными показателями эффективности технологического процесса (производительность, КПД, и т.д.) и термодинамическими – количеством рассеянной (диссипированной) энергии и производимой энтропией. Как правило, эти зависимости монотонно ухудшаются с ростом диссипации и достигают своих предельных значений в обратимом процессе, что позволяет получить оценки, аналогичные КПД Карно для процессов самой разной природы.
Производство энтропии является мерой степени потери полезной энергии при её преобразовании. Поэтому уменьшение производства энтропии приводит к улучшению процесса и повышению показателей его эффективности – повышению КПД, уменьшению энергетических затрат, повышению производительности и т.д., при сохранении остальных показателей неизменными. Кроме того, при помощи балансовых уравнений может быть исследована чувствительность показателей эффективности процесса к производству энтропии или связь между различными характеристиками процесса.
Составление балансовых уравнений.
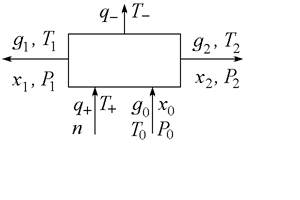 В систему могут поступать вещества конвективно (с потоками) и диффузионно (вследствие диффузии). Обозначим мольный расход веществ в конвективных потоках как
В систему могут поступать вещества конвективно (с потоками) и диффузионно (вследствие диффузии). Обозначим мольный расход веществ в конвективных потоках как ![]() , а в диффузионных как
, а в диффузионных как ![]() где j - номер потока. Кроме того, в системе могут происходить химические реакции со скоростями
где j - номер потока. Кроме того, в системе могут происходить химические реакции со скоростями ![]() (n=1,2,…), совершаться механическая работа мощностью
(n=1,2,…), совершаться механическая работа мощностью ![]() . Потоки тепла, поступающего в систему, обозначим как
. Потоки тепла, поступающего в систему, обозначим как ![]() .
.
Рис. 1. Расчетная схема процесса разделения.
Для определённости будем считать потоки положительными, если они входят в систему и отрицательными, если выходят. Работа считается положительной, если совершается системой над окружающей средой.
Приведём общий вид балансовых уравнений.
Материальный баланс.
Обозначим число молей i-того компонента в системе через ![]() . Изменение числа молей i-того компонента в системе за единицу времени определяется потоками вещества и протекающими в системе химическими реакциями:
. Изменение числа молей i-того компонента в системе за единицу времени определяется потоками вещества и протекающими в системе химическими реакциями:
![]()
Здесь ![]() - мольная доля i-того компонента в j-том потоке,
- мольная доля i-того компонента в j-том потоке, ![]() - стехиометрический коэффициент, с которым k-тый компонент входит в уравнение n-той реакции (
- стехиометрический коэффициент, с которым k-тый компонент входит в уравнение n-той реакции (![]() для расходующихся веществ),
для расходующихся веществ), ![]() - скорость n-той реакции.
- скорость n-той реакции.
Энергетический баланс.
Изменение энергии системы ![]() за единицу времени определяется потоками энергии вносимой и уносимой вместе с конвекционными потоками вещества, изменением энергии за счёт диффузионного обмена веществом, потоками тепла (за счёт теплопроводности, переноса излучением, хим. реакции):
за единицу времени определяется потоками энергии вносимой и уносимой вместе с конвекционными потоками вещества, изменением энергии за счёт диффузионного обмена веществом, потоками тепла (за счёт теплопроводности, переноса излучением, хим. реакции):
![]()
Здесь: ![]() - удельная энтальпия j-того материального потока,
- удельная энтальпия j-того материального потока, ![]() - поток энергии, приносимый вместе с молем вещества, поступающего диффузно.
- поток энергии, приносимый вместе с молем вещества, поступающего диффузно.
Энтропийный баланс.
Изменение энтропии системы S происходит вследствие притока энтропии вместе с веществами, поступающими конвективно и диффузионно, притока и отвода тепла и производства энтропии ![]() вследствие неравновесности процессов, происходящих внутри самой системы:
вследствие неравновесности процессов, происходящих внутри самой системы:
![]() ,
,
где ![]() - изменение энтропии под влиянием j-того потока тепла с температурой
- изменение энтропии под влиянием j-того потока тепла с температурой ![]() .
.
Производство энтропии (диссипация энергии) заведомо неотрицательно. Отметим, что если рассматривается стационарный режим процесса, когда ![]() , то эти уравнения из дифференциальных превращаются в алгебраические.
, то эти уравнения из дифференциальных превращаются в алгебраические.
При рассмотрении циклического процесса балансы можно записать не для каждого момента времени, а за цикл работы установки. Так как в начале и конце цикла состояние системы одинаково, то общее изменение энергии, количества вещества и энтропии за цикл равно нулю. Балансы в этом случае также сводятся к системе соотношений, связывающих средние за цикл значения слагаемых, стоящих в правых частях уравнений.
Для закрытых систем, состоящих из нескольких равновесных подсистем, термодинамические балансы имеют форму
![]() ;
; ![]() ;
; ![]()
где i - номер подсистемы, а индекс «0» относится к системе в целом. В свою очередь ![]() ,
, ![]() ,
, ![]() определяются соотношениями термодинамических балансов.
определяются соотношениями термодинамических балансов.
Производство энтропии в различных типовых процессах
Поскольку в балансовые уравнения входит производство энтропии, то, исходя из них, можно получить выражения, позволяющие рассчитать производство энтропии. Рассмотрим несколько конкретных примеров выражений для производства энтропии в стационарном режиме.
Статический режим обмена между двумя термодинамическими подсистемами возможен, если в процессе обмена интенсивные переменные подсистем неизменны.
Подсистемы, интенсивные переменные которых не изменяются при обмене веществом и энергией, называются термодинамическими резервуарами (источниками бесконечной ёмкости). Каждая из подсистем является равновесной. Именно такие системы будут рассмотрены ниже. Везде предполагается, что смеси веществ представляют собой идеальные растворы. Давление (если специально не оговорено иное) в ходе взаимодействия не изменяется и во всех взаимодействующих подсистемах одинаково.
Теплообмен.
Пусть происходит обмен теплом между двумя резервуарами с температурами ![]() и
и ![]() (рис. 2).
(рис. 2).
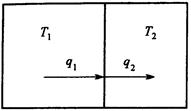
Рис.2. Схема потоков в процессе теплообмена
Энергетический и энтропийный балансы в этом случае имеют вид:
![]() ,
, ![]() .
.
Отсюда получим выражение для производства энтропии:
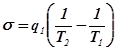
Изотермический массообмен
Пусть два резервуара обмениваются потоками вещества, состоящего из нескольких компонентов. Векторы химических потенциалов в подсистемах равны ![]() и
и ![]() (рис.3).
(рис.3).
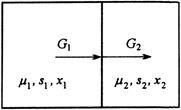
Рис.3. Схема потоков в процессе изотермического массобмена
![]()
Подсистемы обмениваются компонентами, причём температуры подсистем различаются (рис.4).
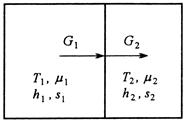
Рис.4. Схема потоков в процессе неизотермического массобмена
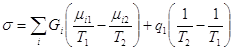 ,
,
где ![]() - приток энергии с потоком подводимого вещества.
- приток энергии с потоком подводимого вещества.
Изотермический химический процесс
Пусть в открытой подсистеме при постоянной температуре происходит несколько химических реакций вида
![]() ,
,
со скоростями ![]() . Для поддержания стационарного режима исходные вещества подаются в подсистему, а получаемые отводятся в требуемых количествах равновесно, т.е. при тех же значениях химических потенциалов (рис.5).
. Для поддержания стационарного режима исходные вещества подаются в подсистему, а получаемые отводятся в требуемых количествах равновесно, т.е. при тех же значениях химических потенциалов (рис.5).
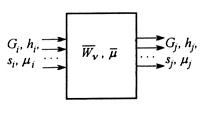
Рис.5. Схема потоков в системе с химическими превращениями
![]() ,
,
где ![]() - химическое сродство n-той химической реакции.
- химическое сродство n-той химической реакции.
Тепломассообмен с химическими превращениями
Пусть к подсистеме подводятся тепло от источника с температурой ![]() и исходные вещества при температуре
и исходные вещества при температуре ![]() , а отводятся продукты реакции при температуре подсистемы
, а отводятся продукты реакции при температуре подсистемы ![]() (рис.6).
(рис.6).
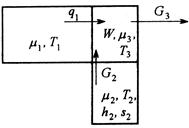
Рис.6. Схема потоков в процессе тепломассообмена с химическими превращениями
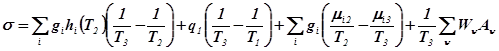
Необходимо определить условия организации процесса на каждой из его стадий, когда при заданной интенсивности процесса минимизируется количество производимой энтропии, нахождение минимально возможных значений производства энтропии и соответствующих им функций изменения параметров процесса (концентраций, температур, давлений).
Поскольку производство энтропии обладает свойством аддитивности, то для процесса, идущего в несколько стадий, общее производство энтропии равно сумме производства энтропии на каждой из стадий. Для каждой стадии находят минимальное производство энтропии при тех или иных условиях, внешних для данной стадии. Суммируя найденные значения и оптимальным образом подбирая условия на границах стадий, получим минимально-возможное количество произведённой энтропии ![]() во всём процессе в целом.
во всём процессе в целом.
Определение предельно возможных значений показателей эффективности. Оценка степени термодинамического совершенства организации процесса.
Подставив в уравнения балансов минимально возможное количество произведённой энтропии ![]() , можно найти предельные значения традиционных показателей эффективности.
, можно найти предельные значения традиционных показателей эффективности.
Отношение минимально возможного (при заданной интенсивности процесса) количества производимой энтропии ![]() к фактическому (производимому в реальном процессе)
к фактическому (производимому в реальном процессе) ![]() определяет коэффициент термодинамического совершенства организации процесса
определяет коэффициент термодинамического совершенства организации процесса
![]() .
.
Отношение предельно-возможного значения обычного показателя эффективности процесса (энергетических и сырьевых затрат, производительности и т.д.) ![]() к фактическому
к фактическому ![]()
![]() ,
,
также может использоваться для оценки степени совершенства организации процесса. Это позволяет оценить возможность и целесообразность его дальнейшего улучшения.
Также можно сравнить изменение температуры, концентрации, давления в режиме, при котором минимизируется производимая энтропия, с их фактическим изменением в реальном процессе. В ряде случаев это позволяет выявить новые способы совершенствования организации процесса (путём изменения конструкции аппаратов, добавления новых точек подвода или отвода веществ, и т.п.).
Если параметры одной подсистемы меняются, как следует изменять параметры другой, чтобы обеспечить максимальную среднюю интенсивность целевого потока (если ставится задача о предельной производительности, а не о предельной экономичности при заданной производительности)?
4. Постановка задач оптимизации.
Термическое разделение.
Для системы термического разделения (p=0) поток затрачиваемого на разделения тепла
![]() .
.
Первое из слагаемых зависит только от параметров внешних потоков и представляет собой обратимые затраты тепла, а второе отражает кинетику процесса и связанную с ней диссипацию энергии.
Используя обозначение идеального цикла Карно ![]() , предыдущее условие можно переписать как
, предыдущее условие можно переписать как
![]() .
.
Здесь ![]() - эквивалентная обратимая работа, а
- эквивалентная обратимая работа, а ![]() - производство энтропии.
- производство энтропии.
Механическое разделение.
Рассмотрим систему разделения, использующую работу с интенсивностью p без подвода и отвода тепла (![]() ), при этом входные и выходные потоки имеют одинаковые температуры и давления.
), при этом входные и выходные потоки имеют одинаковые температуры и давления.
Подводимая для разделения мощность
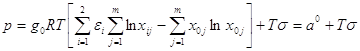 .
.
Первое слагаемое в этом выражении представляет минимальную мощность разделения, которая соответствует обратимому процессу (![]() ). Эта работа равна разности обратимой работы полного разделения исходного потока
). Эта работа равна разности обратимой работы полного разделения исходного потока ![]() и суммарной обратимой работы полного разделения выходных потоков
и суммарной обратимой работы полного разделения выходных потоков ![]() и
и![]()
Обратимые оценки сильно занижены, реальная работа разделения может оказаться существенно большей. Поэтому важно приблизить оценки к реальности за счет учета конечной продолжительности процесса или заданной интенсивности потоков. При этом оценки должны включать коэффициенты массопереноса и зависеть от продолжительности процесса ![]() .
.
Для получения подобных оценок нужно выбрать такое изменение потоков массопереноса во времени или по длине аппарата, при котором работа разделения минимальна. Однако в большинстве аппаратов возможности изменения профиля концентраций ограничены. Изменять можно лишь краевые условия и расходы потоков. Схема Вант-Гоффа обладает большими возможностями управления. Поэтому естественно использовать ее для получения оценки минимальной работы разделения при конечном времени.
Во всех рассмотренных примерах из уравнений термодинамических балансов,
вытекало, что показатель эффективности использования энергии в термодинамических системах (технический КПД) монотонно уменьшался с ростом производства энтропии ![]() , то есть с ростом необратимых потерь энергии. Величина
, то есть с ростом необратимых потерь энергии. Величина ![]() зависит от кинетики тепло- и массообменных процессов, а также кинетики химических реакций. Уравнения кинетики связывают диссипативные потоки энергии и вещества с интенсивными переменными
зависит от кинетики тепло- и массообменных процессов, а также кинетики химических реакций. Уравнения кинетики связывают диссипативные потоки энергии и вещества с интенсивными переменными
взаимодействующих подсистем.
Задача оптимальной в термодинамическом смысле организации процесса состоит
в том, чтобы выбором температур, давлений, химических потенциалов взаимодействующих подсистем, а также коэффициентов в уравнениях кинетики добиться минимума производства энтропии при заданной интенсивности потоков. В распределенных стационарных системах (трубчатых теплообменниках, реакторах, колонных аппаратах и пр.) интенсивные переменные меняются по длине, и требуется найти оптимальный закон изменения этих переменных вдоль аппарата, в нестационарных процессах требуется найти закон изменения интенсивных переменных во времени.
Важным свойством производства энтропии в системе является ее аддитивность, что позволяет на первом этапе разбить сложную систему на отдельные подсистемы, оптимизировать каждую из подсистем при тех или иных параметрах поступающих и выходящих из нее потоков. На следующем этапе требуется так согласовать средние интенсивности потоков, чтобы удовлетворить системным связям и минимизировать суммарное производство энтропии.
Как правило, для реализации найденных законов изменения температур, давлений, химических потенциалов мы можем изменять объемы подсистем, коэффициенты тепло- и массообмена. Самым простым и самым распространенным способом изменения коэффициентов тепло- и массообмена является установление и разрыв контактов между подсистемами. В тех случаях, когда перечисленные способы управления не позволяют реализовать оптимального решения, величина ![]() , соответствующая этому решению, дает оценку снизу для производства энтропии. Таким образом, при заданной интенсивности процесса нельзя получить производство энтропии меньшее, чем
, соответствующая этому решению, дает оценку снизу для производства энтропии. Таким образом, при заданной интенсивности процесса нельзя получить производство энтропии меньшее, чем ![]() . Подстановка
. Подстановка ![]() в выражение для термического КПД или другого показателя эффективности, монотонно зависящего от
в выражение для термического КПД или другого показателя эффективности, монотонно зависящего от ![]() , позволяет получить верхнюю оценку, которую при заданной интенсивности нельзя превзойти. Естественно, что эта оценка ниже обратимой.
, позволяет получить верхнюю оценку, которую при заданной интенсивности нельзя превзойти. Естественно, что эта оценка ниже обратимой.
В работе (9) предлагается конструкция ректификационной колонны с промежуточным подводом и отводом тепла. При этом предлагается использовать такой профиль подвода тепла по высоте колонны, который минимизирует производство энтропии при теплопереносе. Указанный профиль найден при помощи метода ETD (Equal Thermodynamic Distance) и численного метода. Полученные профили оказались схожими, и заметно отличаются от температурного профиля общепринятой колонны.
5. Заключение.
Математические методы термодинамики при конечном времени нашли применение во многих областях, при этом достигнуты высокие результаты. Например, математические методы термодинамики при конечном времени используются для оптимизации процессов разделения в ректификационных колоннах (9). С другой стороны в ряде областей, например посвященных проблематике топливных элементов сделано немного. Таким образом, представляется весьма перспективных использование математических методов термодинамики при конечном времени для решения задач по созданию и оптимизации топливных элементов.
6. Список литературы
1. В.А.Миронова, С.А.Амелькин, А.М.Цирлин. "Математические методы термодинамики при конечном времени" М.: Химия, 2000
2. Плановский А.Н., Николаев П.И. Процессы и аппараты химической и нефтехимической технологии: Учебник для вузов. – 3-е изд., перераб. и доп. – М.: Химия, 1987. – 496 с.
3. Автоматическое управление в химической промышленности: Учебник для вузов. Под ред. Е.Г.Дудникова. - М.; Химия, 1987
4. Амелькин С.А., Андресен Б., Саламон П., Цирлин А.М., Юмагужина В.Н. Предельные возможности тепломеханических систем. Процессы с одним источником. // Известия РАН, Энергетика, - 1998 - №2.
5. Амелькин С.А., Андресен Б., Саламон П., Цирлин А.М., Юмагужина В.Н. Предельные возможности тепломеханических систем с несколькими источниками // Известия Академии наук. Энергетика, - 1999 - №1.
6. Балакирев В.С., Володин В.М., Цирлин А.М. Оптимальное управление процессами химической технологии. - М.: Химия, - 1978.
7. Бошнякович Ф. Техническая термодинамика. - М.:ГЭИ, - 1955.
8. Пригожин И., Дефей Р. Химическая термодинамика. -М.: Наука, -- 1966.
9. Анисимов И.В., Бодров В.И., Покровский В.Б.} Математическое моделирование и оптимизация ректификационных установок. - М.: Химия. - 1975.