Лекции по химии
Самарский Государственный
Аэрокосмический Университет
им. ак. С.П. Королева
Факультет Производства двигателей летательных аппаратов
Лектор доц.
Расщупкина И.Ю.
Самара 2001г
Химическая т/д.
1) Основные понятия.
Соврем хим т/д разрабатывает наиболее рациональные методы рассчета тепловых балансов при протекании хим и физ-хим процессов. Раскрывает закономерности наблюдаемые при равновесии, определяет наиболее благоприятные условия для т/д-ски возможного процесса, поясняет направление и пределы протекания процессов.
Система т/д – совокупность макротел, взаимод и обменивающ энергией как друг с другом так и с внеш средой.
По характеру взаимод с окр средой делятся на:
- изолированные (без обмена с внеш средой V=const)
- закрытые (обмен энергией с окр средой m=const)
- открытые (m,V<>const)
Система может быть гомогенной и гетерогенной (однородной и неоднородной)
Совокупность физ и хим свойств системы наз состоянием.
Физ величины, характеризующие состояние системы наз т/д параметрами. Они не зависят от массы системы, их можно измерить напрямую. Их также называют интенсивными свойствами: р, Т, μ – хим потенциал. Экстенсивные св-ва системы зависят от массы системы, их нельзя измерить напрямую, они рассматр как ф-ия параметра состояния и поэтому наз ф-ями состояния: U(вн энер), Н (энтальпия), S (энтропия).
Изменение св-в системы во времени наз процессом.
- сомопроизвольные (протекает без затрат энергии из вне)
- несамопроизвольные(наоборот)
- обратимые (при котором система проходит ряд обращений без изменений в окр среде)
- необратимые (наоборот)
Внутр энерг характеризует общий запас энергии системы и включает все виды энергии движения и взаимод частиц, но не включает кинет энергию вцелом и пот энергию.
Т/д пользуется понятием изменения внутр энергии.
ΔU=Uкон-Uнач dU
Энтальпияхарактеризует запас энергии системы при р=const она числено равна: H=U+pV
ΔH=ΔU+pΔV dH
ΔH=Hкон-Hнач
Энергия передается от одной системы к другой в виде теплоты и работы. Теплота (Q) не явл ф-ией состояния системы, т.к. ее вел-на зависит от пути перехода системы из нач положения в кон.
Q→δQ, A→δA
Передача теплоты осущ засчет хаотич движения мол-л, а при совершении работы передача энергии идет путем упорядоченного движения мол-л под действием внеш сил
2) 1нач т/д:
В любом процессе приращение внутр энергии системы = кол-ву теплоты, сообщаемой системе за вычетом работы, совершаемой системой.
dU=δQ-δA
δA – сумма всех видов работ, совершаемых системой
δA=pdV+δA’
pdV – работа против внешних сил; δA’ – полезная работа, соверш сист при протекании какого либо процесса
рdV(работу расширения) можно вычислить, если знать у-ия состояния системы
Теплоту процесса подсчитывают, зная истинную теплоемкость системы.
c=δQ/dT
Теплоемкость – отношение б/м кол-ва теплоты, переданного системе к б/м изменению тем-ры им вызываемой.
Следствие 1 нач т/д при p=const
δA=pdV A=pΔV
Q=ΔU+pΔV δQ=dU+pdV=dU+d(pV)=d(U+pV)=dH
Qp=const=ΔH
3)Термохимия – раздел химии, в к-ом изучают тепловые эффекты хим реакции.
При хим реакции происходит изменение внутр энергии путем выделения или поглощения теплоты. В хим процессах работа очень часто незначительна и ей можно пренебречь.
Закон Гесса:
Тепловой эффект х.р. зависит только от вида и состояния исходных в-в и кон продуктов. При термохим рассчетах использ термохим у-ия. Т.х. у-ия обязательно должны содержать молярные кол-ва в-в, в правой части должен быть приведен тепловой эффект, должны быть указаны агрегатные состояния в-в, с т.х. у-иями можно производить все алгебраические действия.
З-н Гесса применим как к хим реакциям так и к физ-хим превращениям (процессам плавления, кристаллизации, испарения, сублимации, конденсации, растворения и т.д.)
При записи з-на Гесса используется два вида тепл эффектов:
1) Энтальпия образования в-в – ΔfH˚ - (тепл эффект реакции образования одного моля данного соединения из простых в-в, взятых в устойчивых стандартных состояниях)
ΔrH˚=ΣконΔfH˚*ni- ΣисхΔfH˚*ni
ΔrH˚ - тепл эффект реакции
ni – стехиометрический коэф
2) Энтальпия сгорания - ΔHсгор - (тепл эффект реакции окисления одного моля данного соединения с кислородом с образованием высших оксидов соответствующих элементов)
ΔrH˚=ΣисхΔHсгор*ni- ΣконΔHсгор*ni
Рассмотрим зависимость теплового эффекта реакции от температуры
Пусть реакция А→В происходит при p=constТепл эффект реакции по з-ну Гесса: ΔrH=HB-HA
Продифференцируем данное у-ие по тем-ре
(dΔrH/dT)p= (dHB/dT)p-(dHA/dT)p
ΔH=Qp
(dΔrH/dT)p=Cp,B-Cp,A – диффер ур-е Кирхгоффа.
Изменение тепл эффекта процесса с температурой = изменению теплоемкости системы, происходящее в результате процесса.
В небольшом интервале температур теплоемкость системы можно считать не зависящей от тем-ры, тогда при p=const, интегрируя дифференциальную формулу (от Т1 до Т2):
ΔHT2=ΔHT1+ΔCP(T2-T1) - интегральное ур-е Кирхгоффа
Т1=298˚К
ΔHT2=ΔH298+ΔCP(T2-298)
По следствию из закона Гесса, изменение теплоемкости находится по следующему соотношению
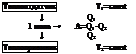 ΔCP=ΣконCP*ni- ΣисхCP*ni
ΔCP=ΣконCP*ni- ΣисхCP*ni
4) (2) нач т/д устанавливает направление и условие протекания естественных процессов, для рассчетов наиболее удобной явл формулировка (2) нач т/д, связанная с ростом энтропии.
Вывод (2) нач т/д сделано на основе анализа работы идеальной тепловой машины
η=A/Q1=(Q1-Q2)/Q1=(T1-T2)/T1
Q1/T1-Q2/T2=<0
δQ1/T1-δQ2/T2=<0
dS=δQ/T - приведенная теплота, отражает измен некот фун-ии состояния
(2) нач т/д:
существует некоторое экстенсивное св-во системы S, называемое энтропией, к-ое связано с поглощаемой теплотой и тем-рой системы следующим образом
а) обр dS=δQ/T
б) необр dS>δQ/T
Все самопроизвольные процессы протекают с увеличением энтропии.
Изменение энтропии (ΔS) не зависит от пути перехода из нач состояния в кон, следовательно не зависит от того какой процесс обратимый или необратимый.
При расчетах реальных систем необр процессы можно представл как совокупность множества обратимых.
ΔS=1∫2(δQ/T)обр
Изотермические процессы Т=const
К ним относится фазовое превращение (испарение, конд и т.д.)
ΔS=S2-S1=∫δQ/T=1/T*∫δQ=Q/T
ΔSфаз перех= Qфп/Tфп
Изобарные процессы p=const
Cp= δQ/dT
ΔS=S2-S1=T1∫T2δQ/T=T1∫T2Cp*dT/T=Cp*ln(T2/T1)
ΔSфаз перех= Qфп/Tфп
Энтропия и ее изменение зависят от тем-ры. Нернст пришел к выводу, что вблизи абс 0 изменение энтропии (ΔS) пренебрежимо мало.
Планк сформулировал (3) нач т/д – Постулат Планка:
Энтропия индивидуального кристаллического в-ва при абс 0 = 0
Модель идеального кристалла
Предположим, что тем-ра 1 моля в-ва при p=const увелич от абс 0, где в-во находится в состоянии идеального кристалла, до некоторой тем-ры Т, где в-во находится в состоянии идеального газа. При этом превращение:
| 0˚К | нагрев | плавл | Нагрев | кипение | Нагрев | Т |
→ | Tпл | → | Tкипен | → | ||
| p=const | T=const | p=const | T=const | p=const | ||
ΔS1 | ΔS2 | ΔS3 | ΔS4 | ΔS5 |
ΔS=ΔST-ΔS0=0˚K∫Tпл(Сp,тв/T)dT+Qпл/Tпл+Tпл∫Tкип(Сp,жид/T)dT+Qкип/Tкип+ Tкип∫T(Сp,газ/T)dT
Величина энтропии Sт, найденное по этому у-ию назыв абс энтропией чистого в-ва при тем-ре Т и атм давлении.
T=298˚К, p=1 атм (стандартные условия) S˚298 из справочника
В хим процессах изменение энтропии подчиняется следствию из з-на Гесса:
ΔrS˚=ΣконS˚*ni-ΣисхS˚*ni
На практике в качестве критерия направленности процесса более удобно использовать другие ф-ии, к-ые назыв т/д потенциалами:
1) изобарно-изотерм пот-л: свободная энергия Гиббса G=H-TS; dG=dH-TdS
2) изохорно-изотрм пот-л: свободная энергия Гельмгольца F=U-TS; dF=dU-TdS
Рассмотрим закрытую систему, в к-ой процесс осущ при T=const.
Согласно (2) нач т/д в такой системе разрешено протекание 2 видов процесса (обр и необр)
T=const
Обратимый
ΔS=Qобр/T
Qобр-TΔS=0; p=const
ΔH-TΔS=0;
ΔG=0 критерий равновесного состояния системы
Подобные работы: