Два типа фазовых переходов и третье начало термодинамики
РЕФЕРАТ По ___________________ ФИЗИКЕ____________________
НА ТЕМУ:
Два типа фазовых переходов, И Третье начало термодинамики ____________________________________________________ Курс :__1__ Группа __1__ Специальность __2104__ Ф. И. О. МАГАРАМОВ СУЛТАН Студента ____________________________________________ ГЕОРГИЕВСК 2003 |
3 Использованная литература...........................................................7
Два типа фазовых переходовСуществует два типа фазовых переходов - первого и второго рода. Обычные фазовые переходы, подобные кипению, плавлению или возгонке, сопровождаются скачкообразными изменениями внутренней энергии и объема (поглощением или выделением скрытого тепла перехода). Поскольку энергия и объем являются первыми производными от свободной энергии по температуре и давлению, то при этих фазовых переходах первые производные свободной энергии являются разрывной функцией. Это послужило основанием назвать такие превращения фазовыми переходами первого рода.
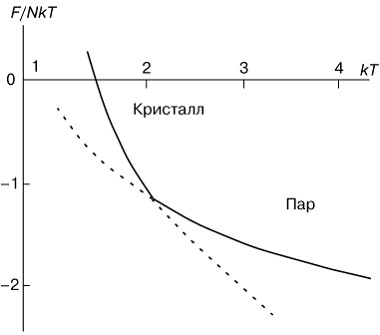
Переходы первого рода характеризуются бесконечно большим возрастанием теплоемкости в очень узкой области вокруг точки перехода. Физическая причина этого состоит в том, что добавление теплоты к системе в точке фазового перехода не повышает температуру системы, а расходуется на перестройку системы. В качестве примера на рисунке 1 показана температурная зависимость свободной энергии F, приходящейся на одну молекулу кристалла, при его превращении в пар. Верхняя ветвь отвечает кристаллическому состоянию, а нижняя ветвь представляет свободную энергию парообразной фазы. При низких температурах свободная энергия кристалла меньше, чем пара, и, следовательно, кристаллическое состояние выгоднее. При высоких температурах, наоборот, выгоднее существование парообразного состояния. Штриховыми линиями показаны области метастабильных, термодинамически неустойчивых состояний системы.
|
Рис. 1. Температурная зависимость свободной энергии F при фазовом переходе первого рода "пар-кристалл". |
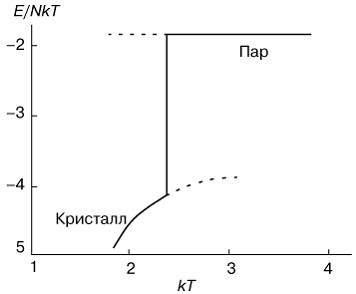
Поведение внутренней энергии системы, приходящейся на одну молекулу, изображено на рисунке 2. Нижняя ветвь относится к кристаллическому состоянию, а верхняя к парообразному. Скачок энергии в точке перехода представляет собой поглощаемую скрытую теплоту. Соответственно теплоемкость в точке фазового перехода первого рода имеет "всплеск".
|
Рис. 2. Изменение энергии E в зависимости от температуры T при фазовом переходе первого рода "пар-кристалл". |
При теоретическом описании фазовых переходов первого рода каждую из фаз обычно описывают отдельно. Так, кристаллическую ветвь рассматривают, пользуясь моделью идеального кристалла, то есть предполагая регулярное расположение всех атомов. Парообразную же ветвь получают, используя модель идеального газа, предполагающую полный беспорядок в системе. Зависимости, полученные для различных моделей, накладывают друг на друга и исследуют, какая из возможностей реализуется в данных условиях. Получить описание фазового перехода первого рода, одновременно учитывая все состояния системы, до настоящего времени не удается из-за огромных математических трудностей.
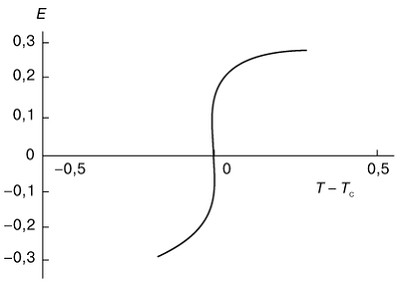
При переходах второго рода внутренняя энергия вещества и его объем не изменяются в точке перехода и, следовательно, не происходит выделения или поглощения скрытой теплоты. Однако свободная энергия системы при фазовых переходах второго рода имеет некоторую особенность, которая проявляется в том, что вторые производные - теплоемкость и сжимаемость - становятся бесконечными. Выявление характера этой особенности - одна из наиболее трудных задач статистической физики. Существует всего несколько систем, для которых эта особенность была выяснена. Одной из таких систем является двумерная модель Изинга (модель двумерного ферромагнетика), рассмотренная Л. Онсагером ). Изменение энергии ферромагнетика в двумерной модели Изинга происходит хотя и резко, но без скачков (рис. 3). При этом теплоемкость системы обращается в бесконечность по логарифмическому закону:
|
Рис. 3. Изменение энергии E в зависимости от температуры T при фазовом переходе второго рода в двумерной модели Изинга. |
| (1) |
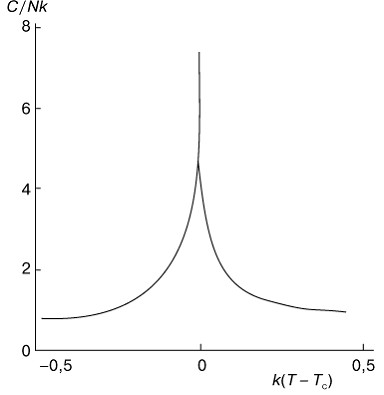
Ход теплоемкости показан на рисунке 4. Форма кривой теплоемкости напоминает греческую букву ![]() , поэтому такие переходы иногда называют
, поэтому такие переходы иногда называют ![]() -переходами. Быстрый, но непрерывный подъем теплоемкости показывает, что система начинает процесс своей реорганизации задолго до достижения точки перехода.
-переходами. Быстрый, но непрерывный подъем теплоемкости показывает, что система начинает процесс своей реорганизации задолго до достижения точки перехода.
|
Рис. 4. Ход теплоемкости C в зависимости от температуры T при фазовом переходе второго рода в двумерной модели Изинга. |
ТРЕТЬЕ НАЧАЛО ТЕРМОДИНАМИКИ.
Открытие третьего начала термодинамики связано с нахождением химического средства - величины , характеризующих способность различных веществ химически реагировать друг с другом . Эта величина определяется работой W химических сил при реакции . Первое и второе начало термодинамики позволяют вычислить химическое средство W только с точностью до некоторой неопределенной функции . Чтобы определить эту функцию нужны в дополнении к обоим началам термодинамики новые опытные данные о свойствах тел . Поэтому Нернстоном были предприняты широкие экспериментальные исследования поведение веществ при низкой температуре .
В результате этих исследований и было сформулировано третье начало термодинамики : по мере приближения температуры к 0 К энтропия всякой равновесной системы при изотермических процессах перестает зависить от каких-либо термодинамических параметров состояния и в пределе ( Т= 0 К) принимает одну и туже для всех систем универсальную постоянную величину , которую можно принять равной нулю .
Общность этого утверждения состоит в том , что , во-первых , оно относится к любой равновесной системе и , во-вторых , что при Т стремящемуся к 0 К энтропия не зависит от значения любого параметра системы. Таким образом по третьему началу,
lin ( S (T,X2) - S (T,X1) ) = 0 (1.12)
или
lim ( dS/dX )T = 0 при Т → 0 (1.13)
где Х - любой термодинамический параметр (аi или Аi).
Предельно значение энтропии , поскольку оно одно и тоже для всех систем , не имеет никакого физического смысла и поэтому полагается равным нулю (постулат Планка). Как показывает статическое рассмотрение этого вопроса , энтропия по своему существу определена с точностью до некоторой постоянной (подобно, например, электростатическому потенциалу системы зарядов в какой либо точке поля). Таким образом , нет смысла вводить некую «абсолютную энтропию», как это делал Планк и некоторые другие ученые.
Использованная литература
В данном реферате
Использовались статьи
Из следующих официальных сайтов :
- Сайт издательства «Открытые системы Профессионалам » (www.osp.ru) .
- Сайт журнала «Кругосвет» . (www.krugosvet.ru).
- Сайт Научная сеть, (www.nature.ru).
- Все сайты были найдены, благодаря поисковой системы YANDEX