Вторая группа периодической системы
Вторая группа периодической системыВторая группа отличается от других одинаковостью структуры внешнего электронного слоя у атомов всех входящих в неё элементов. С другой стороны, второй снаружи слой, оставаясь законченным, у отдельных представителей различен. Обстоятельство это налагает свой отпечаток на свойства соответствующих атомов и ионов и обусловливает разделение следующих за магнием элементов на две подгруппы: кальция и цинка.
Наличие во внешнем слое всех рассматриваемых атомов только двух электронов говорит за отсутствие тенденции к их дальнейшему присоединению. Напротив, сравнительно легко должна происходить отдача электрона с образованием максимально двухвалентных положительных ионов.
Подобно паре В-Si, бериллий в некоторых отношениях проявляет большое сходство со вторым элементом соседней группы — алюминием.
Бериллий и магний.
Первый из этих элементов принадлежит к числу довольно распространённых: на долю бериллия приходится около 0,001 % общего числа атомов земной коры. Содержание в ней магния составляет 1,4 %, и элемент этот является одним из наиболее распространённых. Кроме различных минералов и горных пород, соединения магния постоянно содержатся в водах океана, а также в растительных и животных организмах.
Элементарный бериллий впервые получен в 1828 г., магний — в 1808 г. Первый является “чистым” элементом (9Ве), а второй слагается из трёх изотопов — 24 (78,6), 25 (10,1) и 26 (11,3 %).
Строение внешних электронных оболочек атомов Ве (2s2) Mg (3s2) соответствует их нульвалентному состоянию. Возбуждение до обычного двухвалентного (2s12p1 и 3s13p1) требует затраты соответственно 263 и 259 кДж/моль.
Живое вещество содержит магний в количествах порядка сотых долей процента, а в состав хлорофилла входит до 2 % Mg. Общее содержание этого элемента в живом веществе оценивается величиной порядка 1011 т. Ещё несравненно больше находится его в океане: приблизительно 6·1016 т. При недостатке магния приостанавливается рост и развитие растений. Накапливается он преимущественно в семенах. Введение магниевых соединений в почву заметно повышает урожайность некоторых культурных растений (в частности сахарной свеклы), а в пищу кур — прочность яичных скорлуп. Для человека (особенно пожилого возраста) соединения магния важны главным образом тем, что предотвращают спазмы сосудов). Относительно велико их содержание в сушеных фруктах.
Помимо многочисленных силикатов, магний встречается на земной поверхности главным образом в виде углекислых минералов доломита СаСО3·МgCO3 и магнезита MgCO3. Первый иногда образует целые горные хребты, второй также встречается в очень больших количествах. Под слоями различных наносных пород совместно с залежами каменной соли иногда находятся и легкорастворимые минералы Mg, из которых наиболее важен карналит KCl·MgCl2·6H2O, служащий обычным исходным сырьём для получения металлического магния. Колоссальные запасы карналита имеются в Солекамске, где этот минерал залегает пластами мощностью до 100 м. Значительно реже встречается в природе минералы бериллия, важнейшим из которых является берилл Be3Al3(SiO3)6 или 3BeO·Al2O3·6SiO2.
В большинстве своих первичных минералов магний тесно связан с кремнеземом. Таковы, например, оливин (Mg, Fe)2SiO4 и реже встречающийся форстерит Mg2SiO4. На поверхности Земли он легко образует водные силикаты, примером которых может служить серпентин 3MgO·2SiO2·2H2O.
Богатые месторождения берилла (т. пл. 1650 °С) встречаются очень редко (но в одном из них были найдены отдельные кристаллы с массой до 16 г). Ещё реже встречаются минералы хрилоберилл Be(AlO2)2 и фенакит Be2SiO4. Бульшая часть бериллия земной коры распылена в качестве примесей к минералам ряда других элементов, особенно алюминия. Бериллий содержится также в глубинных осадках морей и золе некоторых каменных углей.
Различно окрашенные примесями прозрачные разновидности берилла известны как драгоценные камни. Сюда относятся тёмно-зелёные (от примеси соединений хрома) изумруды, голубые аквамарины и др. Хорошие изумруды очень редки и считались самыми дорогими из всех драгоценных камней. Как и рубины, их можно получить искусственно, но это гораздо труднее (требуется 1550 °С под давлением 150 тыс. атм). Крупнейший естественный изумруд весил 1795 карат. Кристаллы аквамарина достигают иногда гигантских размеров: самый крупный из них весил 100 кг.
В элементарной состоянии Be и Mg могут быть получены электролизом их расплавленных солей. При получении бериллия обычно пользуются смесью BeCl2 и NaCl, при получении магния — обезвоженным карналитом или хлористым магнием.
Металлический магний получают следующим образом: расплавленная соль помещается в железном сосуде, одновременно являющимся катодом. Анодом служит графитовый стержень, заключенный в мелкопористой керамической трубке, по которой удаляется получающийся при электролизе хлор. Во избежании окисления собирающегося в верхней части сосуда жидкого магния над ним пропускают медленный ток водорода. Получение 1 т металла требует затраты около 20 тыс. кВт·ч электроэнергии.
Наряду с обычным электролитическим большой интерес представляют электротермические методы получения магния, значение которых с каждым годом возрастает. Первый из них основан на обратимости реакции:
MgO + C + 640 кДж ⇔ CO + Mg,
равновесие которой при очень высоких температурах (выше 2000 °С) смещено вправо.
Практически процесс проводят, накаливая тесную смесь MgO (получаемую обжигом природного магнезита) с измельченным антрацитом в дуговой электрической печи. Выделяющиеся пары тотчас по выходе из печи разбавляют большим объёмом сильно охлаждённого водорода, благодаря чему температура их сразу снижается до 150-200 °С и равновесие не успевает сместиться влево. Осаждающийся в виде пыли металлический магний (содержащий примеси MgO и C) затем переплавляют. Полученный подобным образом металл характеризуется высокой чистотой (99,97 %).
При другом электротермическом методе получение магния в качестве восстановителя используется не углерод, а кремний (обычно применяют ферросилиций с содержанием не менее 75 % Si). Сырьём служит обожженный доломит, смесь которого с кремнием прокаливают под сильно уменьшенным давлением выше 120 °С. Реакция в этих условиях идёт по уравнению:
2(CaO·MgO) + Si + 518 кДж = Ca2SiO4 + 2 Mg,
причём единственным её летучим продуктом являются пары магния.
Эквимолярная смесь BeCl2 с NaCl плавится при 224 °С. Помимо электролиза, для получения металлического бериллия широко используется проводимая при постепенном нагревании до 1300 °С реакция по схеме:
BeF2 + Mg = MgF2 + Be + 184 кДж.
Такой путь рентабельнее электролитического.
Бериллий и магний представляют собой блестящие металлы, на воздухе покрывающиеся тонкой оксидной плёнкой, предающей им матовый вид и предохраняющей их от дальнейшего окисления. Важнейшие константы обоих элементов сопоставлены ниже:
Плотность, г/см3 | Температура плавления, °С | Температура кипения, °С | Электропроводность (Hg = 1) | |
Be | 1,85 | 1283 | 2470 | 23 |
Mg | 1,74 | 650 | 1103 | 22 |
Светло-серый бериллий довольно твёрд и хрупок, серебристо-белый магний значительно мягче и пластичнее. Оба элемента (особенно Mg) находят значительное практическое применение.
В парах бериллий, по-видимому, одноатомен, а пары магния содержат и молекулы Mg2 (энергия диссоциации которых оценивается в 29 кДж/моль). Аллотропические модификации обоих элементов неизвестны.
Непосредственное использование металлического магния довольно ограниченно (по объёму). Он расходуется в качестве отрицательного электрода при электрохимической защите от коррозии морских судов и трубопроводов, применяется в металлургии (как раскислитель), для конструирования некоторых гальванических элементов и т. д.
Из сплавов магния чаще всего применяется “магналий” и “электрон”. Первый представляет собой сплав Al с 5-30 % Mg. Магналий твёрже и прочнее чистого алюминия, легче последнего обрабатывается и полируется. Под техническим названием “электрон” понимаются сплавы вообще, в которых магналий является главной составной частью. Обычно подобные сплавы содержат Al (до 10,5), Zn (до 4,5) и Mn (до 1,7 %). Иногда в них вводят также Cu, Be, Ti и др. Обладая прекрасными механическими свойствами, “электрон” по плотности (около 1,8 г/см3) лишь немногим превышает чистый Mg. Как “магналий”, так и “электрон” на воздухе покрываются защитной оксидной плёнкой, предохраняющей их от дальнейшего окисления. Введение 0,05 % Mg в чугун резко повышает его ковкость и сопротивление разрыву. Интересно, что из сплава магния с небольшим количеством индия был получен монокристалл, способный под действием прилагаемой по определенному направлению внешней силы уже при сравнительно низких температурах в несколько раз увеличивать свою длину без разрыва. Ежегодная мировая выплавка магния составляет около 150 тыс. т.
Основным потребителем металлического бериллия, как такового, является в настоящее время ядерная энергетика. Так как бериллий меньше всех остальных устойчивых на воздухе металлов (например, в 17 раз меньше Al) задерживает рентгеновские лучи, он является незаменимым материалом для изготовления тех частей рентгеновских трубок, сквозь которые происходит выпускание лучей наружу). Для этой цели применяются пластинки из Ве толщиной 1-2 мм. Интересной особенностью металлического бериллия является исключительно большая скорость распространения в неё звука — 12,6 км/с. В жидком состоянии бериллий смешивается со многими металлами (Al, Zn, Cu, Fe, Ni и др.), но не смешивается с магнием. Обусловлено это, по-видимому, большим различием атомных радиусов Be (113) и Mg (160 пм).
Добавка бериллия и меди сильно повышает её твёрдость, прочность и химическую стойкость. У содержащего 3 % бериллия сплава сопротивление на разрыв в 4 раза больше, чем у чистой меди. Сплав последней с 2 % Ве вдвое твёрже нержавеющей стали и очень устойчив по отношению к механическим и химическим воздействиям. При содержании 0,5-1,3 % бериллия его сплав с медью имеет прекрасный золотистый цвет и отличается большой звучностью при ударе. Добавка 0,01-0,02 % бериллия к меди повышает её электропроводность. Подобным же образом малая добавка бериллия (0,005 %) к магниевым сплавал повышает их сопротивление окислению. Очень хорошие результаты даёт аналогичная алитированию обработка бериллием поверхности изделий из чугуна и стали. Присадка 1 % Ве к рессорной стали сильно повышает прочность и долговечность вырабатываемых из неё изделий. В частности, пружины из такой стали не теряют упругости даже при красном калении.
При нагревании на воздухе Be и Mg сгорают с образованием оксидов ЭО. Оба элемента легко соединяются с галогенами, а при нагревании также с серой и азотом. Реакции сопровождаются большим выделением тепла, причём магний реагирует, как правило, энергичнее бериллия. С водородом непосредственно соединяется лишь магний (при нагревании под давлением).
В компактном состоянии магний воспламеняется на воздухе около 650, бериллий — около 900 °С. Помимо оксидов ЭО, при сгорании обоих элементов на воздухе образуются нитриды Э3N2. На очень сильном выделении света при горении магния основано его применение для изготовления осветительных ракет и в фотографии (“магниевая вспышка”). В обоих случаях магний обычно смешивается с веществами, легко отдающими кислород. Ракетный осветительный состав может содержать, например, 45 % Mg, 48 — NaNO3 и 7 — связующего органического вещества.
Ниже сопоставлены теплоты образования некоторых соединений бериллия и магния, рассчитанные в кДж на моль металла:
F | Cl | Br | I | O | S | N | |
Ве | 506 | 247 | 184 | 84 | 301 | 117 | 96 |
Mg | 560 | 322 | 259 | 180 | 301 | 176 | 80 |
Отношение Be/Mg | 0,90 | 0,77 | 0,71 | 0,47 | 1 | 0,47 | 1,21 |
Из приведённых данных видно, что теплоты образования аналогичных производных бериллия и магния близки при сравнительно малых объёмах металлоидных атомов (F, O, N) и сильно расходятся при больших (Cl, Br, I, S), Так как сам атом бериллия гораздо меньше атома магния, это свидетельствует о значительной роли объёмных соотношений при образовании рассматриваемых соединений.
Вода на бериллий не действует. Магний почти не взаимодействует с холодной водой, но медленно выделяет из неё водород при кипячении. Разбавленные кислоты легко растворяются не только магний, но и бериллий. В своих соединениях оба элемента двухвалентны.
Оба элементы в соответствии со своими электродными потенциалами должны были бы разлагать воду. Однако при обычных температуре (а для Ве и при нагревании) такое разложение практически не происходит.
Обусловлено это малой растворимостью оксидов обоих элементов, образующих защитный слой на поверхности металлов. По характеру и толщине оксидной плёнки бериллий подобен алюминию. Оксидная плёнка на поверхности магния толще и рыхлее, а её защитное действие выражено гораздо слабее.
И бериллий и магний легко растворимы в разбавленных кислотах, не являющихся окислителями (HСl, H2SO4 и др.), но с HNO3 бериллий реагирует только при нагревании. В HF бериллий легко растворяется, тогда как магний практически нерастворим в ней (из-за образования на его поверхности защитного слоя малорастворимого MgF2).
Растворы сильных щелочей практически не действуют на магний, но растворяют бериллий (разбавленные при нагревании, а концентрированные уже на холоду) с образованием соответствующих бериллатов, например, по схеме:
2 NaOH + Be = Na2BeO2 + H2↑.
С водным раствором аммиака бериллий не реагирует. Магний с ним также почти не реагирует, но постепенно растворяется в растворе солей аммиака по схеме:
2 NH4• + Mg = Mg•• + H2↑ + 2 NH3↑.
Бериллий из солей аммония растворяется лишь в крепком растворе фторида по схеме:
Be + 4 NH4F = (NH4)2BeF4 + H2↑ + 2 NH3↑
или в растворе бифторида. Как видно из приведённых схем, химизм растворения обоих металлов различен (магний образует гидратированные катионы, а бериллий — комплексные анионы). Для ядерной энергетики существенно то обстоятельство, что бериллий не взаимодействует с расплавленным металлическим натрием.
Оксиды бериллия и магния представляют собой весьма тугоплавкие порошки. В кислотах они легко растворимы. Оксид бериллия растворим также в сильных щелочах. С водой он соединяются образуя гидроксиды Э(ОН)2.
Оксиды BeO (т. пл. 2580) и MgO (2850 °С)в парах сильно диссоциированы на элементы. Их энергии диссоциации равны 443 (Be) и 393 (Мg) кДж/моль. В отличие от MgO пар оксида вериллия содержит не только молекулы BeO и продукты их термической диссоциации, но также полимерные молекулы (BeO)n, где n = 2-6. Предполагается, что полимеры со значением n > 2 обладают циклическим строением. Сплав обоих оксидов имеет минимальную температуру плавления 1838 °С при 69 мол. % BeO.
Оба оксида растворимы в кислотах тем труднее, чем сильнее они были предварительно прокалены. Такое снижение реакционной способности обусловлено в данном случае только укрупнением кристаллов. При хранении на воздухе оксид магния постепенно поглощает влагу и CO2 переходя в Mg(OH)2 и MgCO3.
Сплавленный оксид бериллия хорошо проводит тепло и устойчив к температурным колебаниям (в меньшей степени то же относится к MgO). Он обладает большим электрическим сопротивлением даже при высоких температурах. Сделанные из него тигли выдерживают нагревание до 2000 °С и химически стойки по отношению почти ко всем металлам, кислотам (кроме HF) и растворам щелочей. Широкое применение находим BeO в ядерной энергетике. По-видимому, перспективно использование оксида бериллия (или керамических материалов на его основе) для изготовления некоторых деталей реактивных двигателей и газовых турбин.
Оксид магния изредка встречается в природе (минерал периклаз). Подучаемый прокаливанием природного магнезита MgO является исходным продуктом для изготовления различных огнеупорных изделий и искусственных строительных материалов (“ксилолит”и др.). Чистый оксид магния (“жженая магнезия”) находит применение в медицине как средство от изжоги и лёгкое слабительное. Кашица из замешенной на очищенном бензине оксиде магния может быть использована для снятия с бумаги жировых и маслянных пятен: ею смазывают пятно и дают бензину испаритося, после чего удаляют сорбировавший жир оксид магния.
В основе ксилолита лежит магнезиальный цемент, получаемый смешиванием предварительно прокалйнного при 800 °С оксида магния с 30 %-ным водным раствором MgCl2 (на 2 вес. ч. MgO лучше всего брать 1 вес. ч. безводного MgCl2). Вследствие образования полимерной структуры из атомов магния, связанных друг с другом посредством гидроксильных групп или атомов хлора, смесь через несколько часов даёт белую, очень прочную и легко порирующуюся массу.
При изготовлении ксилолита к исходной смеси примешивают опилки и т. п. Кроме ксилолита, используемого главным образом для покрытия полов, на основе магнезиального цемента готорят жернова, точильные камни и т. д.
Белые аморфные гидроксиды бериллия и магния очень малорастворимы в воде. растворенная часть Mg(OH)2 диссоциирована по типу основания, а Be(OH)2 имеет амфотерный характер и диссоциирует по суммарной схеме:
Be2+ + 2 OH- ⇔ Be(OH)2 ≡ H2BeO2 ⇔ 2 H+ + BeO22+.
Ввиду слабости кислотных свойств Be(OH)2 соли с анионом BeO22- (бериллаты) в водном растворе очень сильно гидролизованы. Основные свойства Be(OH)2 выражены гораздо отчетливее кислотных, но всё же значительно менее, чем у Mg(OH)2, являющимся основанием средней силы. В соответствии со своим химическим характером Be(OH)2 растворяется и в сильных щелочах, и в кислотах, а гидроксид магния — только в кислотах.
Осаждение Ве(ОН)2 в процессе нейтрализации кислого раствора наступает около рН = 5,7, а Mg(OH)2 — при рН = 10,5. Наиболее надёжные значенияпроизведений растворимости этих гидроксидов в свежеосаждённом (аморфном) или окристаллизованном состояниях при 25 °С равны, по-видимому, 2·10-21 или 3·10-22 (Be) и 6·10-10 или 1·10-11 (Mg). Их вторые константы диссоциации по основному типу характеризуются значениями 3·10-8 (BeOH•) и 3·10-3 (MgOH•).
Гидрокисд магния встречается в природе (минерал брусит). Помимо кислот он растворим в растворах солей аммония (что имеет значение в аналитической химии). Растворение, например, в NH4Cl протекает по схеме:
Mg(OH)2 + 2 NH4Cl ⇔ MgCl2 + 2 NH4OH
и обусловлено образованием сравнительно малодиссоциированного (особенно в присутствии избытка NH4Cl) гидроксида аммония. Подобно Mg(OH)2 ведут себя и многие другие гидроксиды, хотя и мало, но всё же заметно растворимые в воде (например,Mn(OH)2). Напротив, практически нерастворимые в воде гидроксиды, например Be(OH)2, нерастворимы и в растворах солей аммония. Однако в растворах этилендиамина гидроксид бериллия растворяется.
Для технологии бериллия важно то обстоятельство, что его гидроксид, в противоположность Al(OH)3 хорошо растворим в растворе (NH4)2CO3 (или в насыщенном растворе NaHCO3). Этим иногда пользуются для отделения Be от Al при переработке берилла. Последний первоначально сплавляют с K2CO3, и полученный сплав для осаждения кремневой кислоты обрабатывают при нагревании разбавленной H2SO4. Бульшую часть алюминия выделяют в виде кальевых квасцов, а остаток его (и примеси Fe) осаждаются раствором (NH4)2CO3. Из подкисленного HСl фильтрата кипячением удаляют CO2 и затем осаждают Be(OH)2 углекислым аммонием или перекристаллизацией и возгонкой основного ацетата бериллия.
При нагревании гидроксида бериллия на воздухе он начинает терять воду уже выше 230 °С (но полное обезвоживание достигается лишь при 500 °С. Однако при очень высоких температурах молекулы Be(OH)2 устойчивы. Поэтому прокаливание ВеО в струе водяного пара выше 1000 °С сопровождается зхаметным образованием и последующим распадом Be(OH)2, что практически сводится к возгонке оксида бериллия. В случае MgO такая летучесть с водяным паром не наблюдается.
Полная константа диссоциации H2BeO2 (на 2H• + BeO2”) оценивается значением 2·10-30. Свежеосаждённый Be(OH)2 растворяется в избытке разбавленного раствора щёлочи, но при стоянии такого раствора вновь выделяется его кристаллическая форма, которая растворима только в очень крепких (10 н.) растворах щёлочи. Выделение бериллатов возможно лишь из спиртовых растворов. Подобным путём были получены бесцветные K2BeO2 и Na2BeO2. В водной среде при отсутствии избытка щёлочи обе соли практически нацело гидролизованы. Сухим путём была получены бериллаты некоторых двухвалентных металлов.
Хотя для гидроксида магния кислотная функция совершенно нехарактерна, однако взаимодействие Mg(OH)2 с 65 %-ным раствором NaOH при 100 °С был получен бесцветный кристаллический гидроксомагнезат натрия —Na2(Mg(OH)4). Известны и аналогичные соли типа Э2(Mg(OH)6), где Э — Sr, Ba. Все эти соединения при контакте с водой подвергаются полному гидролизу.
Для обоих элементов изместны аналогичные гидроксидам этоксидные производные Э(OC2H5)2. Лучше изученный этоксид магния может быть получен взаимодействием его амальгамы со спиртом. Он представляет собой белый порошок, растворимый в спирте и разлагаемый водой. В качестве аналога бериллатов можно рассматривать этоксидный комплекс K2(Be(OC2H5)4).
Взаимодействие свежеосаждённого Mg(OH)2 с 30 %-ной H2O2 при 0 °С был получен пероксид магния — MgO2. Он описывается как бесцветное микрокристаллическое вещество (d(OO) = 150, d(MgO) = 208 пм), малорастворимое в воде и постепенно разлагающееся при хранении на воздухе. Данные эти нельзя считать полностью достоверными: возможно, что в действительности был получен гидрат пероксида (известны 2MgO2·H2O и MgO2·H2O). Нагревание последнего из них сопровождается при 100 °С его обезвоживанием, а при 375 °С — переходом MgO2 в MgO. Теплота образования MgO2 из элементов оценивается в 623 кДж/моль. Содержащие её препараты находят применение при отбелки тканей, для дезинфекции и в медицине (при некоторых желудочно-кишечных заболеваниях). Их иногда вводят также в состав зубных порошков.
Для бериллия пероксидные соединения не получены, но сообщалось об образовании BeO2 в результате взаимодействия озона с суспензией Be(OH)2 во фреоне-12 при -65 °С. В аналогичных условиях из MgO2 частично (до 60 %) образуется надпероксид магния — Mg(O2)2. Устойчивый лишь ниже -30 °С.
Большинство солей бериллия и магния хорошо растворимо в воде. Растворы содержат бесцветные ионы Э2+. Присутствие иона Мg2+ сообщает жидкости горький, иона Be2+ — сладковатый вкус. Соли Be заметно гидролизуются водой уже при обычных температурах, соли Mg и сильных кислот — лишь при нагревании раствора. Все соединения бериллия очень ядовиты.
Возможность отравления соединениями бериллия связана главным образом с их наличием в воздухе (которое для производственных помещений не должно превышать 0,001 мг/м3). При вдыхании нерастворимых соединений главная масса этого элемента откладывается в лёгких, а при вдыхании растворимых (или их поступлении через рот) — в костях. Первыми симптомами острого отравления обычно является раздражение верхних дыхательных путей и глаз. Хроническое отравление иногда проявляется лишь через очень долгое время, причём наблюдаются общая слабость, раствойство пищеварения, одышка, кашель и серьёзные изменения в лёгких. Соединения бериллия могут вызывать также поражение костей и кожи.
Галогениды Be и Mg бесцветны. Некоторые их константы сопоставлены выше:
BeF2 | BeCl2 | BeBr2 | BeI2 | MgF2 | MgCl2 | MgBr2 | MgI2 | |
Температура плавления, °С | 821 | 425 | 509 | 480 | 1253 | 714 | 710 | 650 |
Температура кипения, °С | 1169 | 510 | 520 | 488 | 2260 | 1418 | 1430 | - |
d(ЭГ), пм | 140 | 175 | 191 | 210 | 177 | 218 | 234 | 252 |
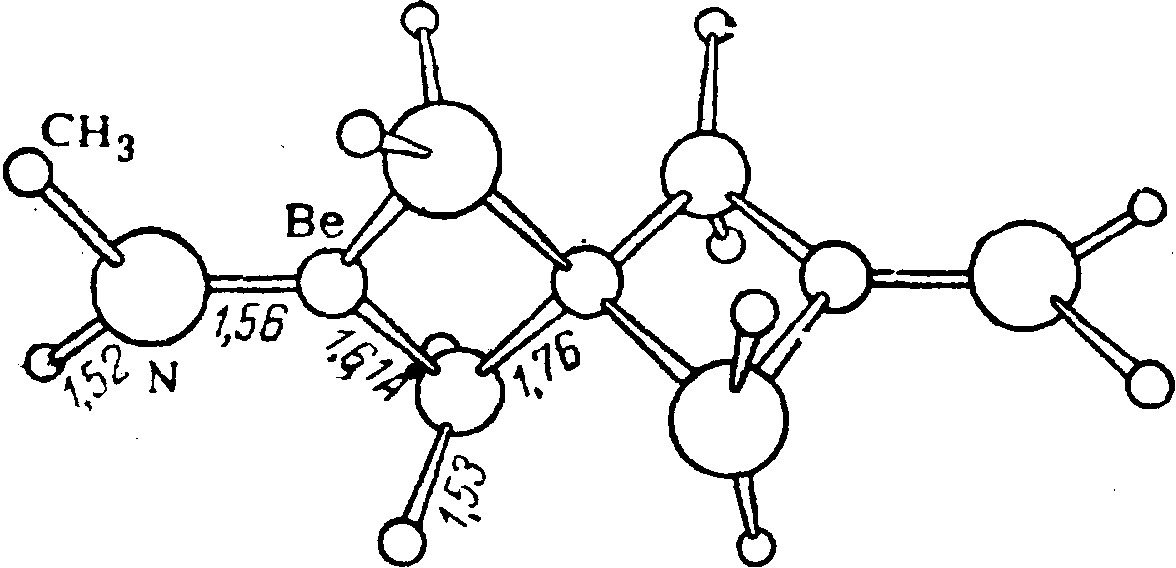
Приведённые значения ядерных расстояний относятся к индивидуальным молекулам рассматриваемых соединений в их парах. Молекулы эти линейны. Тенденция к их ассоциации выражена слабо: было показано, что в парах BeF2 почти не ассоциирован, а BeCl2 и галогениды магния содержат лишь около 1 % молекул (ЭГ2)2 и ещё раз в 100 меньше (ЭГ2)3. Для твёрдого BеСl2 характерно поканное на рис сочетание отдельных молекул в полимерные цепи типа ···BeCl2···BeCl2··· с мостиковыми связями бериллия через атомы хлора (d(BeCl) = 202 пм, ∠ClBeCl = 98°, ∠BeClBe = 82°). Следует отметить, что твёдрые галогениды способны существовать в различных модицикациях по некоторым характеристикам. Например, для BeF2 известна форма с т. пл. 542 °С. Расплавленные галогениды бериллия очень плохо проводят электрический ток. Для энергий решётки галогенидов MgГ2 дают следующие значения (кДж/моль): 2880 (F), 2487 (Cl), 2412 (Br), 2312 (I).
Почти все галогениды Be и Mg расплывыются на воздухе и легкорастворимы в воде. Исключением является MgF2 растворимость которого весьма мала (0,08 г/л). В растворах мало диссоциированы лишь ионы BeF• (К = 5·10-5) и MgF• (К=5·10-2). Подвижность иона Be•• почти вдвое меньше, чем иона Mg••. Большинство солей выделяется из растворов в виде кристаллогидратов BeCl2·4H2O, MgCl2·6H2O и т. д. При их нагревании происходит отщепление части галогенводородной кислоты и остаются труднорастворимые в воде основные соли.
Реакции присоединения характерны главным образом для фторидов, образующих комплексы преимущественно типов М(ЭГ3) и M2(ЭГ4), где М — однавалентный металл. Примерами могут служить K(BeF3) (т. пл. 406) и K(MgF3) (1070), K2(BeF4) (791) и K2MgF4) (846 °С с разл.). Особенно характерны для бериллия производные типа M2(BeF4). По растворимости они походи на сульфаты. Ядерное расстояние d(BeF) в ионе (BeF4)2- 155 пм, а полная константа его диссоциации в растворе (на Be + 4 F’) оценивается значением 4·10-17. Известен также ряд солей, производящихся от комплексной кислоты H2(BeF3OH).
Для других галогенидов бериллия комплексообразование с соответствующими галогенидами щелочных металлов не характерно, но некоторые производные аниона (BeCl4)2- (имеющего структуру тетраэдра d(BeCl) = 189 пм) известны. Магнийдихлорид дпёт производные типа M(MgCl3)·6H2O, к числу которых относятся, в частности, природный карналит и аналогичная аммонийная соль. Нагреванием последной может быть получен безводный MgCl2 (без образования основной соли). Безводный BeCl2 легко растворяется в спирте и эфире (причём из последнего раствора соль выделяется с двумя молекулами кристаллизационного эфира). Хорошо растворимы в эфире (и ряде других кислородсодержащих органических жидкостей) также MgBr2 и MgI2. Последняя соль при взаимодействии с эфиром образует два слоя, выше 38 °С смешивающихся друг с другом. Гидролиз её при взаимодействии с водой протекает очень бурно. Получать BeI2 удобно действием сухого HI на карбид бериллия при 700 °С (с последующей очисткой посредством возгонки в вакууме). Кристаллогидрат BeBr2·4H2O может быть выделен из насыщенного бромистым водородом концентрированного водного раствора этой соли. Из роданидов бериллия были получены стеклообразный Be(NCS)2 и кристаллический Cs2(Be(CNS)3)·2H2O.
Практическое применение из галогенидов Bе и Mg находит главным образом MgCl2 большие количества которого получаются в виде отходов от переработки карналита на KСl. При 176 °С карналит плавится в своей кристаллизационной воде и одновременно разлагается, причём KСl почти полностью осаждается, а MgCl2·6H2O (т. пл. 106 °С) остаётся в виде жидкости. Хлористый магний применяется для получения из него металлического Mg, магнезиального цемента, в медицине и т. д. Медицинское применение находит также MgI2. Из растворов этой соли в метиловом спирте может быть выделен кристаллогидрат MgI2·6CH3OH.
Гидриды бериллия и магния представляют собой белые твёрдые вещества, нелетучие и имеющие характер полимеров (вероятно, образованных посредством водородных мостиков). Оба они нерастворимы в эфире и могут быть получены по схеме:
Э(СН3)2 + LiAlH4 = LiAlH2(CH3)2 + ЭH2.
При температурах порядка 400-500 °С под давлением водорода 100-200 атм и в присутствии следов иода MgH2 образуется непосредственно из элементов (теплота образования 75 кДж/моль). Оба гидрида устойчивы на сухом воздухе, но разлагается водой (BeH2 — бурно, MgH2 — медленно). Термический распад BeH2 (теплота образования 21 кДж/моль) наступает около 190, а MgH2 — около 300 °С. Подобно другим гидридам металлов, они являются сильными восстановителями.
Взаимодействие диметильных производных Be и Mg с эфирным раствором HN3 при очень низких температурах были получены азиды этих элементов — Be(N3)2 и Mg(N3)2. Они представляют собой белые твёрдые вещества. Цианомид магния может быть получен осторожным нагреванием в вакууме его диаммиаката (Mg(NH3)2)(CN)2, осаждающегося при действии HCN и NH3 на концентрированный раствор Mg(NO3)2. Водой Mg(CN)2 гидролизуется, а при нагревании выше 200 °С переходит в цианамид магния — MgNCN.
Нитраты бериллия и магния легкорастворимы не только в воде, но и в спирте. Кристаллизуются они обычно в виде Be(NO3)2·4H2O (т. пл. 60) и Mg(NO3)2·6H2O (90 °С). При нагревании выше температур плавления оба нитрата отщепляют не только воду, но и HNO3, а затем переходят в сответствующие оксиды. Безводные Be(NO3)2 и Mg(NO3)2 могут быть получены осторожным нагреванием в вакууме их двойных соединений Be(NO3)2·2N2O4 и Mg(NO3)2·N2O4 (которые образуются при взаимодействии безводных хлоридов с диоксидом азота в присутствии этилацетата). Они представляют собой бесцветные твёрдые вещества.
Для сульфатов бериллия и магния характерны легкорастворимые кристаллогидраты BeSO4·4H2O и MgSO4·7H2O. Первый из них полностью обезвоживается при 400, второй — при 200 °С. Для солибериллия установлено строение (Be(OH2)4)SO4 с тетраэдрическим окружением атома Ве четырьмя молекулами воды, Подобная же структура (Be(OBe)4)SO4 вероятна и для основного сульфата бериллия, образующегося при растворении BeO в концентрированном растворе BeSO4. Интересно, что растворитель этой основной соли больше, чем самого мульфата бериллия. Раствор последнего способен растворять также металлический магний и его оксид по схемам:
2 BeSO4 + Mg + 2 H2O = H2 + (BeOH)2SO4 + MgSO4
и 2 BeSO4 + MgO + H2O = (BeOH)2SO4 + MgSO4.
Электролитическая диссоциация MgSO4 характеризуется значением константы 5·10-3. Безводный BeSO4 (т. пл. 540 °С) труднорастворим в холодной воде (но переводится в растворимое состояние горячей). Возможно, что это обусловлено его строением не по ионному, а по полимерному типу ···BeO2SO2BeO2SO2··· аналогичному структуре хлорида. Он начинает отщеплять SO3 около 580 °С, а термическое разложение MgSO4 (т. пл. 1130 °С при бычтром нагревании) становится заметным лишь выше 1000 °С.
В природе MgSO4 встречается в виде минералов горькой соли MgSO4·7H2O и кизерита MgSO4·H2O. Последний минерал даже при нагревании растворяется очень медленно (по-видимому, лишб после перехода в более богатый водой кристаллогидрат). Природный кизерит может служить хорошим материалом для получения MgO и SO2, так как при прокаливании с углём разлагается по схеме:
MgSO4 + C + 268 кДж = CO + SO2 + MgO.
Горькая соль применяется в текстильной промышленности, а также используется в медицине как слабительное.
С сульфатами некоторых одновалентных металлов BeSO4 и MgSO4 образуют двойные соли, для бериллия типа M2(Be(SO4)2), а для магния так называемые шениты состава M2(Mg(SO4)2)·6H2O, где M — одновалентный катион. Шенитом K2(Mg(SO4)2)·6H2O пользуются иногда в качестве калийного удобрения.
Почти нерастворимые в воде нормальные карбонаты ЭСO3 бериллия и магния могут быть получены лишь при одновременном присутствии в растворе большого избытка CO2. В противном случае осаждаются также почти нерастворимые основные соли (например, (ЭOH)2CO3). Последние всегда и образуются при действии на соли Be и Mg растворами углекислых солей. Нагревание с крепким раствором KHCO3 они могут быть переведены в нормальные карбонаты, для которых характерны кристаллогидраты BeCO3·4H2O и MgCO3·3H2O. Основная соль приблизительного состава 3MgCO3·Mg(OH)2·3H2O под названием белой магнезии находит медицинское применение (при повышенной кислотности желудочного сока) и вводится иногда в состав зубных порошков.
Нормальные карбонаты Be и Mg сравнительно легко отщепляют углекислый газ и переходит в соответствующие оксиды. Для BeCO3 такой расход становится заметным уже немного выше 100, для MgCO3 — около 500 °С. На этом основано использование природного магнезита для получения СО2 и MgO. Выделенный таким путем углекислый газ очень чист и служит, в частности, для производства искусственных минеральных вод. Обожженный магнезит (т. е. в основном MgO) идет на изготовление огнеупорных кирпичей и т. п.
49) При пропускании СО2 в жидкость, содержащую взвешенный MgCO3, происходит растворение осадка, обусловленное реакцией по схеме:
MgCO3 + H2O + СO2 = Mg(HCO3)2
В кристаллическом состоянии бикарбонат магния был получен при 0 °С под давлением СО2 в 18 атм. Он очень неустойчив и на воздухе отщепляет СО2.
50) Карбонаты Be растворяются в избытке карбонатов щелочных металлов и — особенно легко — крепкого раствора (NН4)2СО3. Растворение обусловлено образованием двойных солей типа М2(Ве(СО3)2). Аналогичные, но труднорастворимые соли дает и углекислый магний при обработке его крепкими растворами щелочных карбонатов (или бикарбонатов). Известны, например, K2(Mg(CO3)2)·4H2O, KH(Mg(CO3)2)·4Н2O и др. К солям этого типа относится и природный доломит — Ca(Mg(CO3)2). Образованием подобного же, но легкорастворимого аммонийного производного обусловлено, вероятно, отсутствие осаждения при действии на соли магния крепким раствором (NH4)2CO3. Напротив, разбавленные растворы этого реактива в отсутствие других аммонийных солей частично осаждают основные карбонаты магния (большей частью лишь при нагревании или после долгого стояния).
51) Большое практическое применение для сушки многих жидкостей и газов находит безводный перхлорат магния («ангидрон»). Получают его обезвоживанием (в вакууме при 240 °С) кристаллогидрата Mg(CIO4)2·6H2О (т. пл. 146 °С), выделяющегося из водных растворов этой соли. По интенсивности осушающего действия ангидрон приближается к фосфорному ангидриду, имея перед последним то важное преимущество, что длительным нагреванием до 240 °С под вакуумом поглотившая воду соль может быть вновь обезвожена и повторно использована. Термическое разложение Mg(CIO4)2 наступает при 382 °С. Соль эта хорошо растворима не только в воде, но и в ряде органических растворителей.
52) Известен и перхлорат бериллия — Ве(С1О4)2·4Н2О. Подобно остальны тетрагидратам иона Be2+, соль эта имеет, вероятно, строение (Ве(ОН2)4)(С1O4)2. При нагревании она не теряет воду вплоть до начала разложения аниона.
53) Нормальный ацетат бериллия — Be(СНзСОО)2 — не может быть получен из водных растворов. Он образуется, в частности, при нагревании BeCl2 с безводной уксусной кислотой. Соль эта не растворяется ни в органических растворителях, ни в воде (но медленно разлагается ею с образованием основных солей). При 295°С плавится с разложением.
54) Для хорошо растворимого в воде ацетата магния характерен кристаллогидрат Mg(CH3COO)2·4H20 (т. пл. 65°С). Растворы этой соли проводят электрический ток в несколько раз хуже, чем то обычно для солей типа ЭХ2, а при высоких концентрациях становятся очень вязкими. И то и другое обусловлено, по-видимому, полимеризацией молекул Mg(CH3COO)2, протекающей с возникновением донорно-акцепторных связей O-Mg от карбонильного кислорода анионов.
55) Оксалат бериллия — ВеС2O4·3Н2O — является единственным оксалатом двухвалентного металла, хорошо растворимым в воде. Электропроводность его разбавленного раствора примерно в 5 раз меньше, чем у BeSO4, и почти не изменяется при повышении концентрации. Такое поведение соли согласуется с трактовкой структуры по типу Ве1Ве(С2O4)21·6Н20. Вместе с тем для константы диссоциации молекулы ВеС2О4 было найдено значение 6·10!!!!. Известны и комплексные оксалаты, например Na2(Be(C2O4)2)·H2O.
56) В отличие от бериллия, оксалат магния — MgC2O4·2Н2О — малорастворим воде (0,1 г/л). Для константы электролитической диссоциации этой соли значение 4·10!!!!. В растворе (NH4)2C2O4 она растворяется с образованием довольно устойчивого комплекса (NI-l*IMg*O*l. Вместе с тем раствор щавелевой кислоты способен растворять гораздо больше MgO, чем то соответствует реакции нейтрализации, что указывает на лёгкое образование хорошо растворимых основных оксалатов магния.
57) Для фосфата магния — Mg3(PO4)2 (т. пл. 1357 °С) — даётся значение ПР = 2·10!!!!, т. е. соль эта очень малорастворима в воде. Образованием кристаллического осадка MgNH4ЭO4 (где Э — Р или As) пользуются в аналитической химии для открытия иона Mg2+ с одной стороны, фосфорной и мышьяковой кислот — с другой. Реакция идет, например, по уравнению:
MgCl2 + NH4OH + Na2HPO4 = MgNH4PO4 + 2 NaCl + Н2О.
Фосфаты бериллия известны, но изучены хуже.
58) Боранаты бериллия и магния могут быть получены в эфирной среде по схеме:
ЭН2+В2Н6 = Э(ВН4)2.
Оба они представляют собой белые твёрдые вещества, растворимые в эфире и разлагаемые водой. Боранат бериллия летуч (т. возг. 91, разлагается выше 120 °С), тогда как боранат магния нелетуч (плавится в вакууме около 180 и разлагается лишь выше 260 °С). Молекула Ве(ВН4)2 полярна (μ = 2,06). Данные трёх разных исследований её строения сильно расходятся, а Mg(BH4)3 имеет, вероятно, ионную структуру. Боранат бериллия мог бы, по-видимому, служить высококалорийной добавкой к реактивным топливам.
59) Алюмогидриды бериллия и магния были получены в эфирной среде по схеме:
ЭГ2 + 2 LiAlH4 = 2LiГ + 3 Э(AlH4)2
(где Г — С1, Вг). Они представляют собой белые твердые вещества, хорошо растворимые в эфире и разлагаемые водой. Строение их, вероятно, !!!! по типу Н2А1ННЭННА1Н2. Более устойчивый Mg(AlH4)2 термически разлагается (в отсутствие воздуха) лишь выше 140 °С.
60) Из других солей рассматриваемых элементов особенно интересны комплексные производные бериллия, в которых основным центральным атомом является кислород с координационным числом 4. Типичным представителем соединений этого типа является основной ацетат бериллия ОВе4(СН3СОО)6, получаемый взаимодействием его основного карбоната с безводной СНзСООН.


Рис. . Схема пространственного строения основного ацетата бериллия.
Рис. . Валентвая схема основного ацетата бериллия.
Как видно из рис. , центральный атом кислорода тетраэдрически окружён четырьмя атомами бериллия, а каждый из последних — четырьмя атомами кислорода. Помимо восьми обычных валентных связей в формировании молекулы участвуют 8 донорно-акцепторных связей О-Ве (рис. ). Получающаяся замкнутая структура так прочна, что кристаллизующийся в правильных октаэдрах основной ацетат бериллия не только плавится, но и кипит без разложения (т. пл. 285, т. кип. 331 °С). Это используется для очистки бериллия от примеси многих других элементов.
Основной ацетат нерастворим в воде, но растворяется в неполярных органических растворителях. Подобные ему производные бериллия известны и для некоторых других органических кислот. Вместе с тем, в отличие от Mg2+, А13+ и многих других катионов, Be2+ не имеет тенденции к комплексообразованию с “трилонами”. Обусловлено это, по-видимому, его очень малым радиусом.
61) Подобным основному ацетату неорганическим соединением бериллия является основной !!!!, который может быть получен термическим разложением Be(NO3)2 (в вакууме при 125 °С). Он представляет собой бесцветные летучие кристаллы, нерастворимые в неполярных органических растворителях. Известны и соли типа !!!! (где M-Na, К, NH4), строение аниона которых также аналогично основному ацетату бериллия. Для магния был выделен основной ацетат состава 4Mg(CH3COO)2·Mg(OH)2, при нагревании выше 200 °С разлагающийся до MgO.
62) Сходным по свойствам с основным ацетатом производным бериллия является его ацетилацетонат — !!!!. Он плавится при 108 °С и кипит без разложения при 270"С, почти нерастворим в воде, но хорошо растворяется в неполярных органических растворителях (СбНб, CSa и др.). Известен (но мало изучен) и ацетил- ацетонат магния.
63) Из циклопентадиенильных производных рассматриваемых элементов Ве(С5Н5)2 интересен своим строением: атом Be располагается между параллельными и отстояшими на 337 пм друг от друга плоскими кольцами C5H5 (с d(CC)= 143 н d(CH) = 110 пм), но на разных расстояниях от них ((ВеC) = 191 и 226 пм). Возможно, что этой асимметрией и обусловлено наличие у Be(C5H5)2 дипольного момента !!!!. Сама она связана, вероятно, с ионным характером данного !!!! и малыми размерами Be2+, что создает возможность существования двух чётких минимумов на кривой его потенциальной энергии (при перемещении между кольцами).
Аналогичный по составу циклопентадиенил магния — Mg(C5H5)2 — может быть получен прямым действием паров циклопентадиена на нагретый металл. Он представляет собой бесцветное кристаллическое вещество (т. пл. 177, т. кип. 221 °С), очень чувствительное не только к воде и воздуху, но даже к углекислоте.
64) Для многих безводных солей бериллия и магния характерно легкое образование комплексных аммиакатов. При обычных температурах для них типичны составы (Be(NH3)4)X2 и (Mg(NH3)4)X2 (где X — одновалентный анион). Некоторые аммиакаты довольно устойчивы по отношению к нагреванию. Например, давление аммиака над (Be(NH3)4)Cl2 при 156 °С равно лишь 6 мм рт. ст., а над !!!! оно достигает атмосферного лишь при 227 °С. Интересен гидразиновый комплекс !!!!, в котором бериллий имеет, по-видимому, необычное для него координаанонное число 6. Вероятно, таково же оно и в устойчивом лишь при низких температурах (давление аммиака достигает 90 мм рт. ст. уже при -50°С) аммиакате BeCl2·!!!!. Водой все эти соединения разлагаются.
65) Из амидных производных Be и Mg были описаны Be(NH2)2, !!!! (где M — Na, К). Известен также амидобромид Mg(NH2)Br.
Лучше других изученный Mg(NH2)2 медленно выделяется при хранении голубого раствора магния в жидком аммиаке. Он представляет собой белый порошок, самовоспламеняющийся на воздухе и бурно разлагаемый водой. При нагревании в отсутствие воздуха происходит его разложение по схеме:
3Mg(NH2)2 = Mg3N2 + 4NH3.
Из более сложных соединений того же типа интересен получаемый взаимодействием ВеН2 с диметиламином BeN(CH3)2, строение тримерной молекулы которого (образованной с участием донорно-акцепторных связей N-Be) показано на рис. .
66) Сульфиды бериллия и магния, а также аналогичные им селениды и теллуриды могут быть получены прямым синтезом из элементов. Производные бериллия с водой не взаимодействуют, тогда как производные магния более или менее гидролизуются. Для теплот образования из элементов даются значения (ккал/моль): 56 (BeS), 83 (MgS), 65 (MgSe) и 50 (MgTe). Удобным способом получения чистого бесцветного MgS является пропускание тока азота с примесью паров CS2
над нагретым до 800 °С оксидом магния. При 1200 °С подобным же образом реагирует с CS2 и окись бериллия. Для магния получены также полисульфиды MgS4 и MgS5.
67) Бесцветные нитриды Be и Mg могут быть получены непосредственным соединением элементов с азотом. В случае Be реакция быстро идет начиная с 900 °С, а в случае Mg — c 500 °С. Теплоты образования нитридов равны соответственно 140 и 111 ккал/моль. Оба они относятся к соединениям ионного типа (с радиусом !!!! около 140 пм). Нитрид бериллия Be3N2 очень твёрд, плавится лишь около 2200 °С (под давлением) и холодной водой почти не разлагается. Интересным путем его синтеза является протекающая при 700 °С реакция по уравнению:
3 Be + 2 KCN = Be3N2 + 2 C + 2 K.
Нитрид магния (Mg3N2) выше 700 °С начинает распадаться на элементы, при нагревании на воздухе сгорает до MgO, а водой тотчас разлагается на Mg(OH)2 и NH3. Известны также смешанные нитриды !!!! (где Э — Ве, Mg) и нитрофториды магния (!!!! MgaNF, MggNFg). Для аналогов Mg3N2 даются следующие значения теплот образования из элементов (ккал/моль): 128 (Мg3Р2), 96 (Mg3As2), 79 (Mg3Sb2) и 40 (Mg3Bi2). Фосфид состава Ве3Р2 известен и для бериллия.
68) Карбид бериллия состава Ве2С (т. пл. 2150 °С с разл.) образуется при накаливании ВеО с углем в электрической печи. Теплота его образования из элементов равна 22 ккал/моль. Судя по строению кристаллической решетки (обратный тип CaF2), карбид бериллия может рассматриваться как ионное соединение (Ве2+С4-). Водой он медленно разлагается с выделением метана. Образующийся при 450 °С по схеме
!!!!
карбид бериллия разлагается водой с выделением ацетилена. Он является, следовательно, типичным ацетилидом.
69) Из карбидов магния — MgC2 и Mg4C3 — первый удобно получать нагреванием порошкообразного Mg до 500 °С в токе этана, второй — до 600 °С в токе пентана. Оба карбида являются эндотермичными соединениями с теплотами образования из элементов соответственно -21 и -18 ккал/моль. Водой MgC2 разлагается с выделением ацетилена, а Mg4C3 — аллилена (СН3-С≡СН) и аллена (H2C=C=CH2). Выше 550 °С MgC2 распадается на углерод и Mg2C3, который выше 750 °С разлагается на элементы. Последний карбид является единственным соединением этого класса, содержащим в своей структуре анионы (С=С=С)4+.
70) Из силицидов магния известны Mg2Si (т. пл. 1100 °С) и Mg!!!!Si!!!!. В отличие от MgC2, теплота образования Mg2Si из элементов положительна (19 ккал/моль). Бериллий сплавляется с кремнием, но определённых соединений с ним не образует. Из аналогов силицида магния были получены !!!!MgaSn (т. пл. 780 °С) и Mg2Pb (теплоты образования из элементов соответственно 18 и 13 ккал/моль). Последнее соединение бурно реагирует с водой.
71) Основными типами боридов являются, по-видимому, для бериллия !!!!, а для магния — !!!!. Наиболее характерны из них медно-красный Ве2В и черный MgB2. Бориды с относительно малым содержанием бора кислотами (или даже водой) разлагаются, с большим — не разлагаются.
72) Для бериллия довольно характерно образование с некоторыми другими металлами соединений (“бериллидов”), обычно содержащих относительно много атомов Be. Примерами могут служить !!!!. Последнее из этих соединений находит использование в качестве источника нейтронов.
73) Производные одновалентных бериллия и магния не получены. В качестве промежуточных продуктов ионы Be+ и Mg+ образуются, по-видимому, при анодном окислении этих металлов. С равновесием по схеме !!!! связана, вероятно, частичная (порядка одного атома на 100 молекул) растворимость магния в расплаве его хлорида.
Существование BeF и Be!!!! при высоких температурах установлено для систем ВеГ2(г) + Ве(ж) ⇔ 2 ВеГ(г). Теплота образования газообразного BeF из элементов положительна (40 ккал/моль) а BeCl — отрицательна (-4 ккал/моль). Теоретические расчеты показывают, что галогениды ЭГ не должны устойчиво существовать при обычных условиях (так как их дисмутация на ЭГ2 и Э энергетически выгодна). Напротив, при очень высоких температурах одновалентное состояние становится устойчивее двухвалентного, как то видно из показанных на рис. результатов теоретического расчета равновесий термической диссоциации хлоридов магния.
74) Нульвалентное состояние Bе и Mg представлено их малоизученными дипиридильными производными - Э(Dipу)2. Они представляют собой тёмноокрашенные твердые вещества, растворы которых в тетрагидрофуране (при отсутствии даже следов кислорода) имеют зеленый (Be) или красный (Mg) цвет.
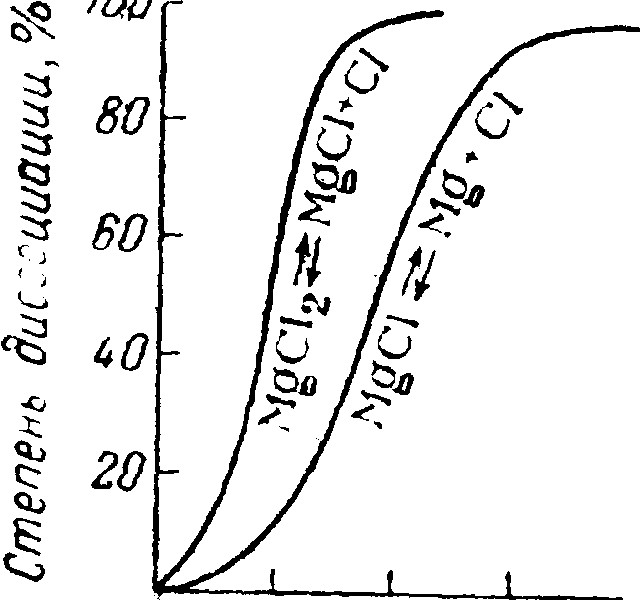
Рис. XII-6. Термическая
диссоциация магния.
заметным лишь немного выше 100, для MgCO3 — около 500 °С. CO2 MgO (MgO)
MgCO3
MgCO3 + H2O + CO2 = Mg(HCO3)2
CO2
Be (NH42CO3 M2(Be(CO3)2) K2(Mg(CO3)2)·4H2O KH(Mg(CO3)2)·4H2O Ca(Mg(CO3)2). (NH4)2CO3
Mg(ClO4)2·6H2O Mg(ClO4)2
Be(ClO4)2·4H2O (Be(OH2)4)(ClO4)2
Be(CH3COO)2 BeCl2
Mg(CH3COO)2·4H2O Mg(CH3COO)2 O→Mg
BeC2O4·3H2O BeSO4 Be(Be(C2O4)2)·6H2O BeC2O4 Na2(Be(C2O4)2)·H2O
47
33-74
По химическому характеру оба рассматриваемых элемента, в общем похожи друг на друга. Основные различия между ними связаны со значительным увеличением ионного радиуса при переходе от Be2+ (34 пм) к Mg2+ (78 пм).